中国湖泊细菌群落的生物地理分布格局及驱动机制——基于文献数据的统计分析
高鹏飞,王 鹏*,丁明军,张 华,聂明华,黄高翔
中国湖泊细菌群落的生物地理分布格局及驱动机制——基于文献数据的统计分析
高鹏飞1,2,王 鹏1,2*,丁明军1,2,张 华1,2,聂明华1,2,黄高翔1,2
(1.江西师范大学,鄱阳湖湿地与流域研究教育部重点实验室,江西 南昌 330022;2.江西师范大学地理与环境学院,江西 南昌 330022)
为阐明中国湖泊细菌群落的生物地理分布格局及驱动机制,基于已发表文献,收集了228个湖泊的浮游或沉积物细菌门水平分类数据和环境因子数据进行分析.结果表明:中国湖泊浮游细菌群落的优势类群为变形菌门(Proteobacteria,35.92%)、放线菌门(Actinobacteria,25.03%)和拟杆菌门(Bacteroidetes,10.77%),沉积物中的优势类群为变形菌门(Proteobacteria,40.37%)、绿弯菌门(Chloroflexi,8.74%)和拟杆菌门(Bacteroidetes,8.55%).中国湖泊浮游细菌距离衰减程度显著低于沉积物细菌;湖泊细菌群落结构在北方、南方、青藏高原的空间差异显著,北方水体及沉积物中细菌的距离衰减模式均不显著,南方水体中显著但沉积物中不显著,青藏高原水体及沉积物中均显著.浮游细菌优势类群中除Proteobacteria外,Actinobacteria(南方>北方>青藏高原)和Bacteroidetes(青藏高原>北方>南方)的丰度在三个地区均具有显著差异;沉积物细菌优势类群Proteobacteria(北方>南方>青藏高原)、Chloroflexi(南方>北方>青藏高原)、Bacteroidetes(青藏高原>北方>南方)的丰度在三个地区均具有显著差异.影响北方湖泊浮游细菌群落分布的主要环境因子是溶解性有机碳,南方是溶解氧,青藏高原是硝酸盐氮;影响北方湖泊沉积物细菌群落分布的主要环境因子是总氮和pH值,南方是总磷,青藏高原是pH值.空间扩散限制与环境筛选作用共同塑造了中国湖泊细菌的生物地理分布格局.扩散限制对浮游细菌的影响小于沉积物细菌,对青藏高原湖泊浮游及沉积物细菌影响最大,对北方湖泊浮游及沉积物细菌影响最小;环境筛选作用对青藏高原湖泊浮游及沉积物细菌影响最大,对南方湖泊浮游细菌及北方湖泊沉积物细菌影响较小.
中国湖泊;细菌群落;地理距离衰减;环境筛选;扩散限制
湖泊生态系统对全球气候变化反应迅速[1],在维持地球生态平衡及促进生物地球化学循环等方面发挥着重要作用[2].细菌是水生微生物食物网的重要组成部分[3],促进了湖泊生态系统的有机质分解和养分循环[4-5].浮游细菌和沉积物细菌的来源、多样性以及影响因素不同[6-7],对湖泊浮游及沉积物细菌进行综合研究,有利于加深对菌群构建机制及湖泊生态功能的理解.
生物地理分布格局包括物种组成的相似性随地理距离衰减[8]及种群结构的空间异质性.细菌群落存在生物地理分布现象,如以Proteobacteria和Bacteroidetes为优势类群的南极周边海洋菌群、以Proteobacteria、蓝藻菌门(Cyanobacteria)、Actinobacteria为优势类群的长江浮游菌群,都具有显著的距离衰减模式[6, 9].细菌主动扩散的能力差,因地理隔绝而产生的扩散限制可能是菌群呈现特定分布格局的原因;环境因子的筛选作用也是这一现象产生的原因,湖泊细菌群落可能受温度[10-11]、pH值[10,12]、总磷[13-14]、总氮[15]和硝酸盐氮[13]等环境因子的影响.研究表明,芬兰东北部Kitkajarvi湖浮游细菌群落的构建受到了扩散限制的强烈影响[16],扩散限制还明显影响了热带、亚热带海洋表层以及德国地下含水层中微生物群落的构建[17-18];此外,总氮对包头南海湖中的固氮微生物的生长具有明显的促进作用[19],温度、pH值、透明度等环境因子会显著影响丹江口水库的浮游细菌群落[20].研究的空间尺度不同,影响细菌分布格局的因素可能也会不同[21].在大规模尺度上研究湖泊细菌群落生物地理分布格局及形成原因,对于系统性了解细菌地带性分布及湖泊生态环境监测具有重要意义.然而,相比于动植物的广泛研究,对湖泊细菌群落在较大空间尺度上分布格局及驱动机制的研究仍然有限.
目前我国已有许多关于湖泊细菌群落特征及影响因素的研究,如我国中东部湖泊、水库浮游细菌优势类群主要为Actinobacteria、Bacteroidetes、Proteobacteria和疣微菌门(Verrucomicrobia),丰富和稀有细菌类群均具有显著的距离衰减关系,稀有类群主要受电导率、水体透明度等环境因子的影响,丰富类群主要受空间变量的影响[22];长江中下游湖泊浮游细菌优势类群为Proteobacteria和Actinobacteria,菌群距离衰减模式明显,随机过程主导了菌群的构建[23];青藏高原湖泊优势类群为Bacteroidetes和Cyanobacteria,盐度是最重要的影响因子[24].这些研究工作在我国部分地区开展,研究结论是否适用于全国仍然未知.本研究基于文献的统计数据,假设细菌群落的距离衰减程度反映了扩散限制机制,环境因子的影响反映了环境筛选机制,主要研究目的:(1)阐明中国湖泊浮游及沉积物细菌群落的生物地理分布格局;(2)探究驱动中国湖泊细菌群落生物地理分布格局形成的主要机制.
1 材料与方法
1.1 数据收集
通过Web of science学术搜索引擎(https:// www.webofscience.com)和中国知网(https://www. cnki.net),收集采用第二代测序技术(高通量测序)对中国湖泊浮游及沉积物细菌群落开展研究的相关文献.检索位置为“主题”,检索式分别为“bacteria* AND lake AND China”、“细菌AND 湖泊AND中国”,得到100篇符合研究需求的文献,包含228个湖泊.由于35%的文献未提及其是否将原始序列信息上传至基因数据库,且所收集文献中细菌群落的相对丰度多在门水平分类上统计分析,为便于后续比较分析,本研究未基于测序原始序列分析中国湖泊细菌群落特征,而是整理了文献中细菌门水平分类的相对丰度数据.
本研究共统计了9种常见门分类细菌的相对丰度,并将未统计的细菌门类归类为其他(Others),将变形菌亚门(Alphaproteobacteria、Betaproteobacteria、Deltaproteobacteria和Gammaproteobacteria)的数据统一归为Proteobacteria.筛选在25%以上的水体或沉积物样本中都出现的环境因子,选择的水体环境因子为温度、pH值、溶解氧(DO)、总磷(TP)、总氮(TN)、氨氮(NH4+-N)、硝酸盐氮(NO3--N)和溶解性有机碳(DOC),沉积物环境因子为温度、pH值、TP、TN、NO3--N和总有机碳(TOC).如果一个湖泊采样点不唯一或在同一季节内有数次采样,在统计细菌数据及环境因子时取其平均值;如果文献数据以图片形式给出,使用Origin2017软件的Digitizer插件从图中获取数据.此外,统计的文献信息还包括“采样时间”、“采样点数量”、“采样点经纬度及所在省份”等.
某些文献同时研究了浮游和沉积物细菌,将该文献拆分为不同生境样本数据,样本数据统计量见表1.北方和南方分界线为“秦岭—淮河”线;青藏高原边缘线:北至昆仑山、阿尔金山、祁连山,东至横断山脉,南至喜马拉雅山脉,西部为帕米尔高原.中国湖泊细菌群落已发表文献采样点空间分布见图1.
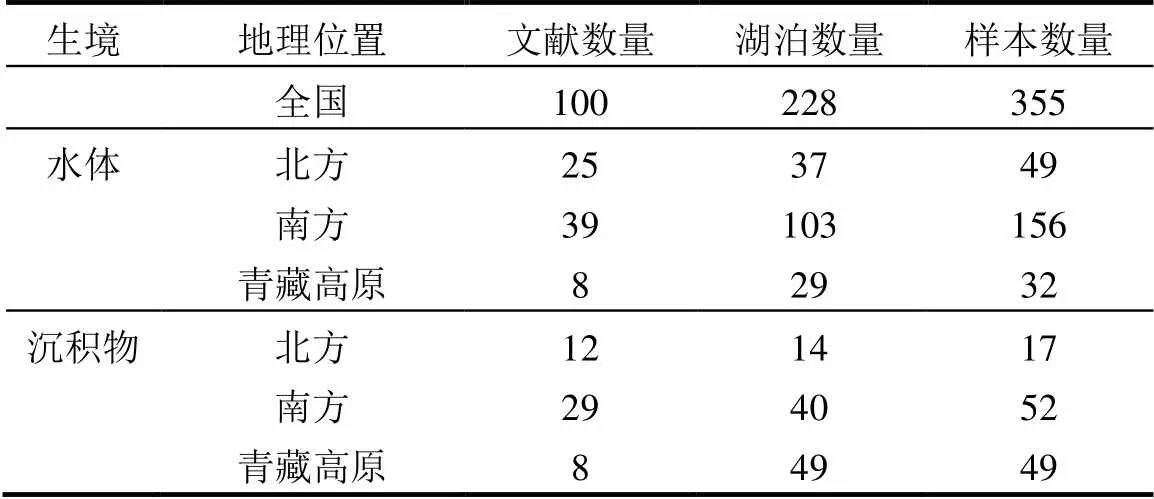
表1 样本数据统计量
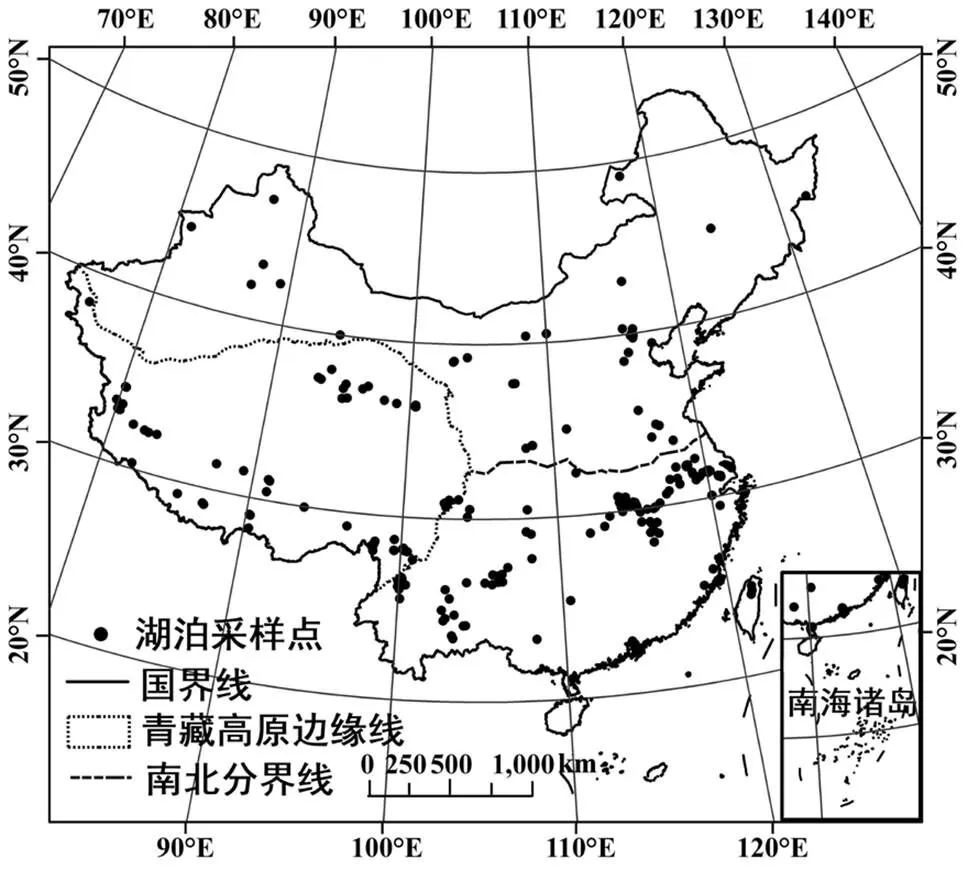
图1 中国湖泊细菌群落已发表文献采样点空间分布
中国地图由国家标准地图网提供(http://bzdt.ch.mnr.gov.cn)
审图号为GS(2020)4632
1.2 数据分析
在数据分析之前,对除pH以外的所有环境因子进行对数转换,使其尽量符合正态分布.采用R语言(R 4.0.5)进行统计分析.使用“kruskal.test”函数,基于Kruskal-Wallis检验比较北方、南方、青藏高原(或称三个地区)湖泊门分类细菌平均相对丰度的空间差异[25],基于“circlize”软件包绘制弦图展示细菌群落结构及菌门空间差异[26].采用“aov”函数的单因素方差分析(ANOVA)检验三个地区环境因子差异[27].为研究细菌群落距离衰减模式,采用“vegan”软件包的“vegdist”函数计算湖泊间细菌群落的Bray-Curtis相似性矩阵,采用“geosphere”软件包的“distm”函数,根据各湖泊的经纬度坐标计算地理距离,使用Spearman相关计算群落相似性与地理距离的相关性[28-29].采用“vegan”软件包的“mrpp”函数和“adonis”函数,基于多重响应排列程序分析MRPP)和置换多元方差分析(PERMANOVA)检验细菌群落结构在三个地区的空间差异[27, 30].因门分类细菌与环境因子的样本量不一致,不能采用排序分析方法分析二者相关性;本文使用Spearman相关计算细菌与环境因子的相关性,将与各类菌门显著相关(<0.05)次数最多的环境因子视为影响该地区菌群的最主要环境因子,采用Origin 2017软件绘制相关性热图.
2 结果
2.1 中国湖泊细菌群落结构与菌门空间差异
弦图描述了湖泊细菌群落在全国三个地区的分布情况,连线表示该区域存在对应的细菌门类,线条越粗,该菌门丰度越高(图2).全国湖泊浮游细菌的优势类群为Proteobacteria(35.92%)、Actinobacteria (25.03%)和Bacteroidetes(10.77%). Proteobacteria的平均丰度在青藏高原最高(44.44%),在北方最低(34.22%),在南方为35.19%,但Proteobacteria的平均丰度在三个地区差异不显著; Actinobacteria的平均丰度在三个地区有显著差异,在南方最高(29.83%),在青藏高原最低(9.83%),在北方为16.36%; Bacteroidetes的平均丰度在三个地区有显著差异,在青藏高原最高(15.77%),在南方最低(9.11%),在北方为13.85%.全国湖泊沉积物细菌的优势类群为Proteobacteria(40.37%)、Chloroflexi (8.74%)、Bacteroidetes(8.55%),这三类菌门的平均丰度在三个地区均存在显著差异.Proteobacteria的平均丰度在北方最高(45.85%),在青藏高原最低(35.81%),在南方为42.14%;Chloroflexi的平均丰度在南方最高(11.78%),在青藏高原最低(3.76%),在北方为10.62%; Bacteroidetes的平均丰度在青藏高原最高(11.74%),在南方最低(5.90%),在北方为9.94%.全国湖泊浮游细菌中未统计的细菌门类(Others, 5.72%)占比低于沉积物细菌(18.35%).

图2 中国湖泊浮游细菌(a)及沉积物细菌(b)门水平分类群落结构及其在北方、南方、青藏高原的空间差异显著性
细菌门类名称后的“*”表示该细菌在三个地区的空间差异显著;*表示0.01<<0.05,**表示0.001<£0.01,***表示£0.001
2.2 中国湖泊细菌群落结构空间差异及距离衰减模式
全国湖泊浮游及沉积物细菌群落结构在北方、南方、青藏高原的空间差异极显著,且其在任何两个地区之间进行比较后均存在显著空间差异.其中,北方和青藏高原的群落结构空间差异相对较小,但其差异仍显著(表2).

表2 中国湖泊浮游及沉积物细菌群落结构空间差异
注: *表示0.01<<0.05,**表示0.001<£0.01,***表示£0.001;<0.05时用粗体表示;值大于0说明组间差异大于组内差异, 小于0说明组内差异大于组间差异.
全国湖泊细菌群落结构Bray-Curtis相似性与地理距离之间呈现出显著的距离衰减关系,且浮游细菌距离衰减程度小于沉积物细菌,相关系数分别为-0.15、-0.27(图3).
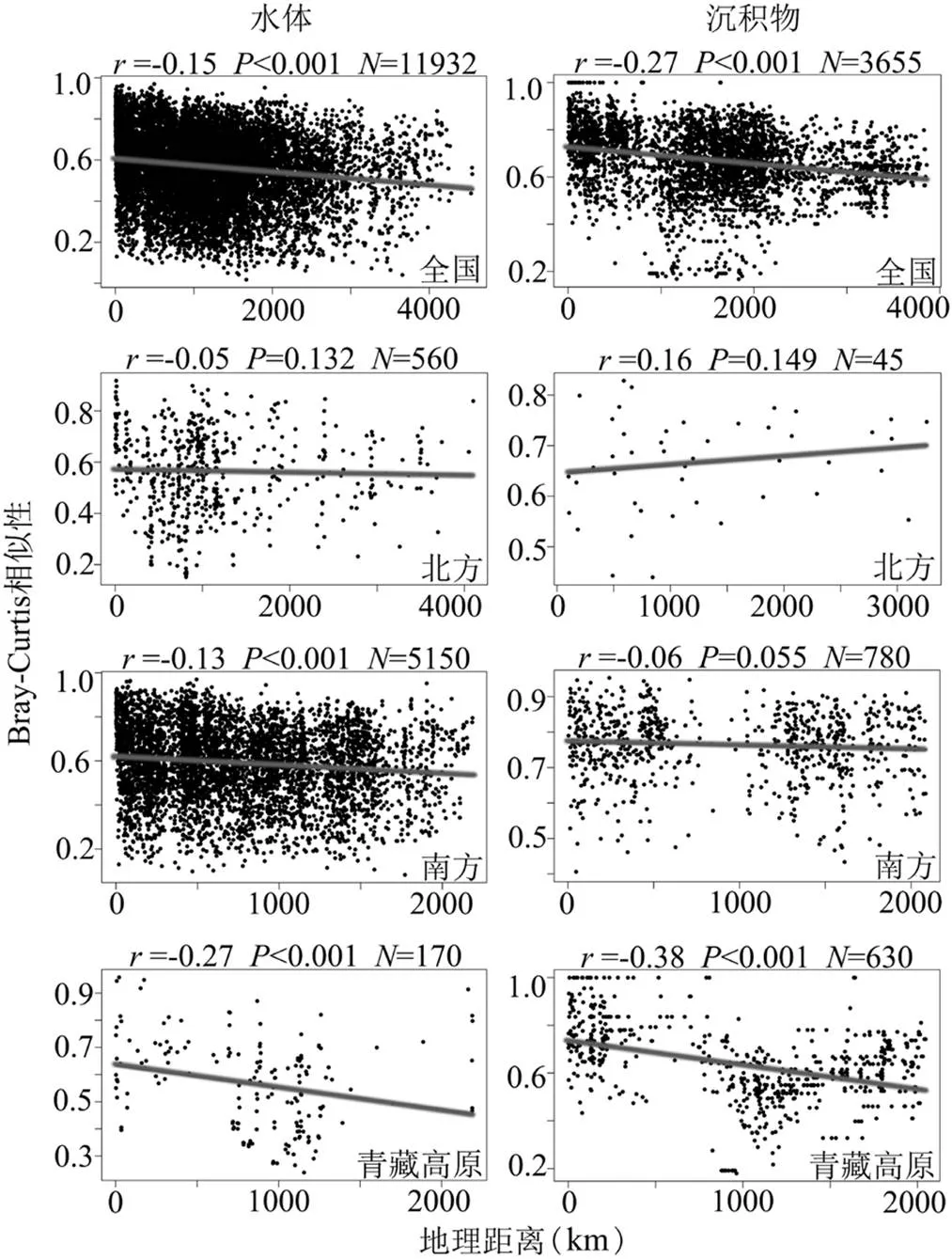
图3 中国湖泊浮游及沉积物细菌群落Bray-Curtis相似性与地理距离之间的Spearman相关性
为比较次数
这说明距离较近的湖泊比距离较远的湖泊具有更相似的细菌群落结构.北方湖泊浮游细菌存在距离衰减模式但不显著,沉积物细菌中不存在距离衰减现象;这一现象在南方湖泊水体中显著,在沉积物中不显著;青藏高原湖泊浮游及沉积物细菌的距离衰减模式均显著.
全国湖泊浮游细菌群落中除Proteobacteria与Firmicutes外,其余门分类细菌均具有显著的距离衰减关系(<0,<0.01)(图4(a)).全国湖泊沉积物中除Actinobacteria与Cyanobacteria外,其余门分类细菌的距离衰减关系均显著(<0,<0.001)(图4(b)).

图4 中国湖泊门水平分类浮游细菌(a)及沉积物细菌(b)Bray-Curtis相似性与地理距离间的Spearman相关性
1.Proteobacteria;2.Actinobacteria;3.Cyanobacteria;4.Bacteroidetes;5.Verrucomicrobia;6.Firmicutes;7.Planctomycetes;8.Chloroflexi;9.Acidobacteria
2.3 影响中国湖泊细菌群落的主要环境因子
湖泊水体中,北方、青藏高原的NO3--N和DOC的平均含量均显著高于南方,DO在三个地区的大小分别为南方>北方>青藏高原,但差异不显著.湖泊沉积物中,南方与北方的TP、TN平均含量显著高于青藏高原,但TP、TN在南北方之间差异不显著;北方和青藏高原的pH值显著高于南方,青藏高原的pH值高于北方,但差异不显著(表3).
影响中国湖泊浮游细菌群落分布的主要环境因子是DO、NO3--N和DOC (图5).北方是DOC, Actinobacteria、Bacteroidetes与DOC显著负相关,Cyanobacteria与DOC显著正相关,其余细菌门类与DOC呈负相关但不显著;南方是DO, Actinobacteria、Verrucomicrobia、Planctomycetes与DO显著正相关,Cyanobacteria、Acidobacteria与DO显著负相关;青藏高原是NO3--N,Proteobacteria和Acidobacteria与NO3--N显著负相关,Cyanobacteria、Bacteroidetes与NO3--N显著正相关.
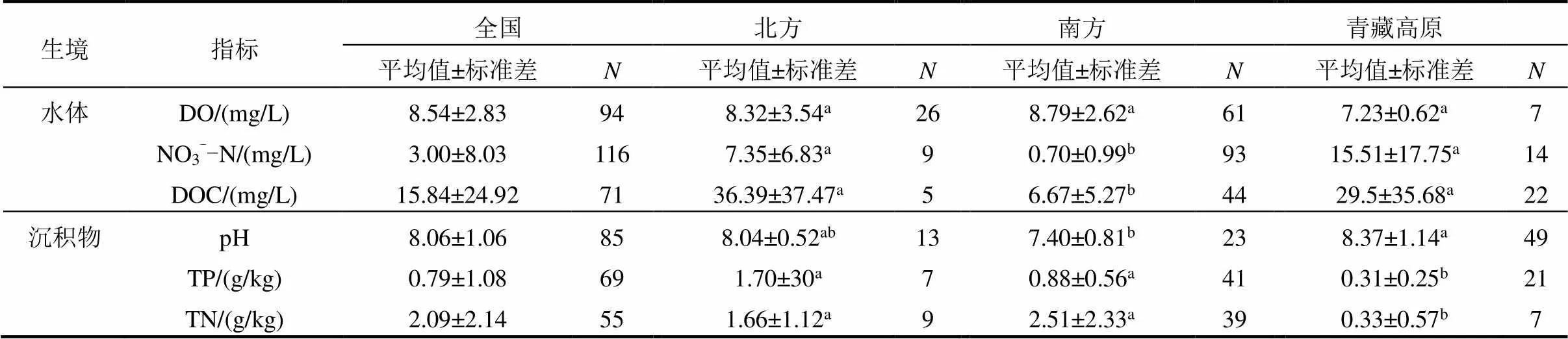
表3 中国北方、南方、青藏高原湖泊水体及沉积物环境因子差异
注: 表中不同字母表示采样点间显著性(LSD检验,<0.05);表示样本数量.
影响中国湖泊沉积物细菌群落分布的主要环境因子是pH值、TP和TN(图6).北方是TN和pH值,丰度最高的Proteobacteria与TN呈显著正相关,Firmicutes与pH值显著负相关;南方是TP,Actinobacteria、Cyanobacteria和Verrucomicrobia与TP显著正相关,Bacteroidetes与TP显著负相关;青藏高原是pH值,Verrucomicrobia、Planctomycetes、Chloroflexi和Acidobacteria与pH值显著负相关.
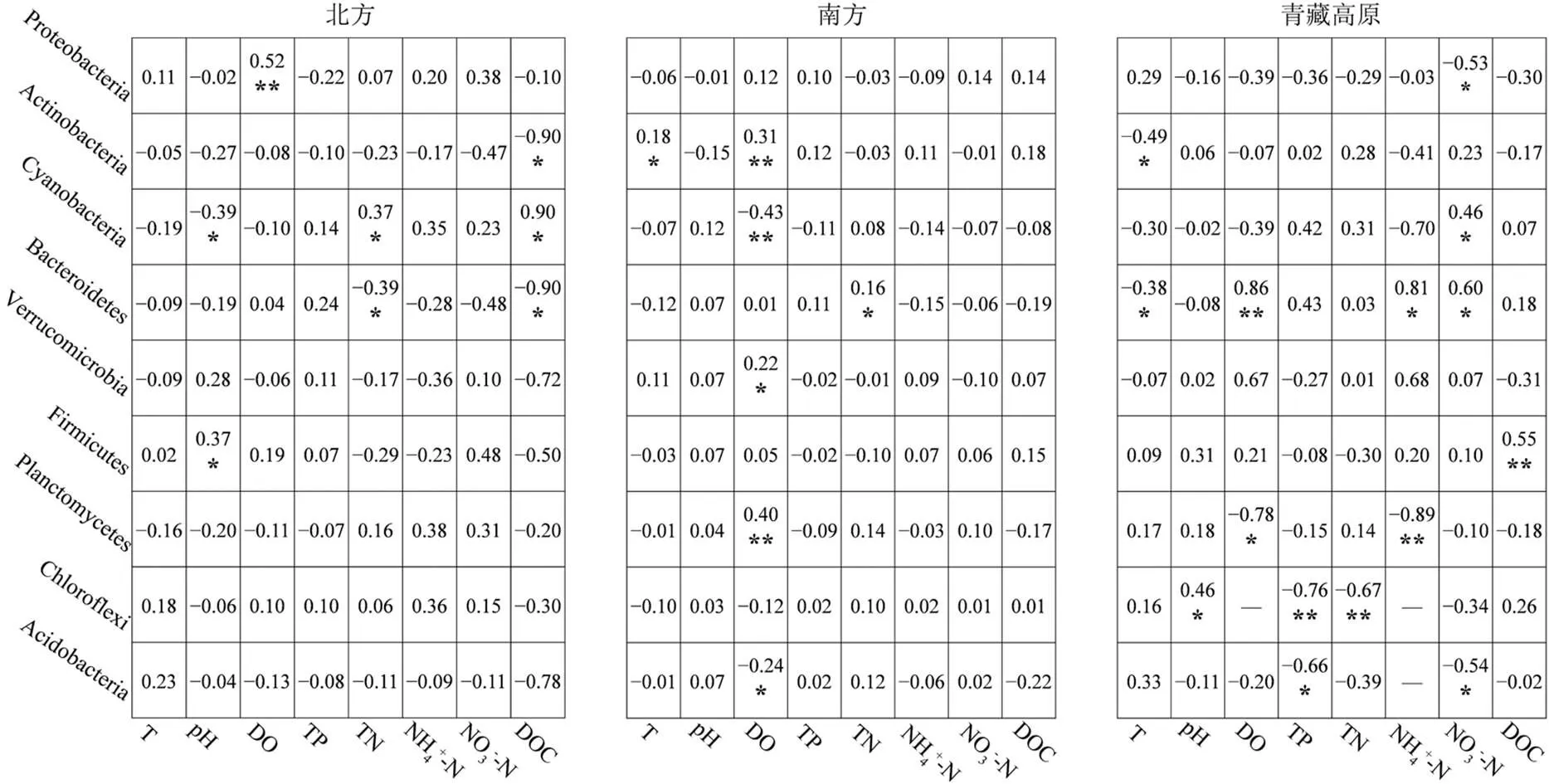
图5 中国湖泊门水平分类浮游细菌与环境因子的Spearman相关分析
图中数字为相关系数;显著相关:*表示0.01<<0.05,**表示0.001<£0.01;-为缺失值
3 讨论
3.1 细菌群落空间差异及距离衰减模式
中国湖泊细菌群落结构在北方、南方、青藏高原的空间差异显著,全国湖泊浮游及沉积物细菌群落均存在显著的距离衰减模式.浮游细菌群落中最优势类群为Proteobacteria,其次是Actinobacteria和Bacteroidetes;国外研究也表明,Proteobacteria、Actinobacteria、Bacteroidetes是湖泊浮游细菌群落中丰度排名前三的类群[31-32].Actinobacteria与Bacteroidetes的平均丰度在三个地区都存在显著差异,Actinobacteria在三个地区的丰度大小分别为南方>北方>青藏高原,Bacteroidetes为青藏高原>北方>南方;Actinobacteria与Bacteroidetes都存在明显的距离衰减模式,Actinobacteria的距离衰减程度高于Bacteroidetes.Proteobacteria在三个地区的平均丰度大小分别为青藏高原>南方>北方,但三个地区的丰度差异不显著,且不存在距离衰减现象,这可能是因为水体表层的Proteobacteria更容易通过河流[33]、空气[34]或水鸟迁移[35-36]等途径扩散,它的高丰度占比与快速繁殖能力,使其突破扩散限制的影响,生物地理分布格局不明显.全国湖泊沉积物细菌群落中最优势门类是Proteobacteria,其次是平均丰度接近的Chloroflexi和Bacteroidetes,这与国外湖泊研究结论类似[37-38].这三种细菌类群的平均丰度在三个地区都具有显著差异,Proteobacteria在三个地区的丰度大小分别为北方>南方>青藏高原,Chloroflexi为南方>北方>青藏高原,Bacteroidetes为青藏高原>北方>南方;这三类细菌均存在明显的距离衰减模式,衰减程度大小分别为Chloroflexi>Proteobacteria> Bacteroidetes.此外,浮游细菌中Others占比低于沉积物细菌,这表明湖泊浮游细菌的物种多样性低于沉积物细菌.
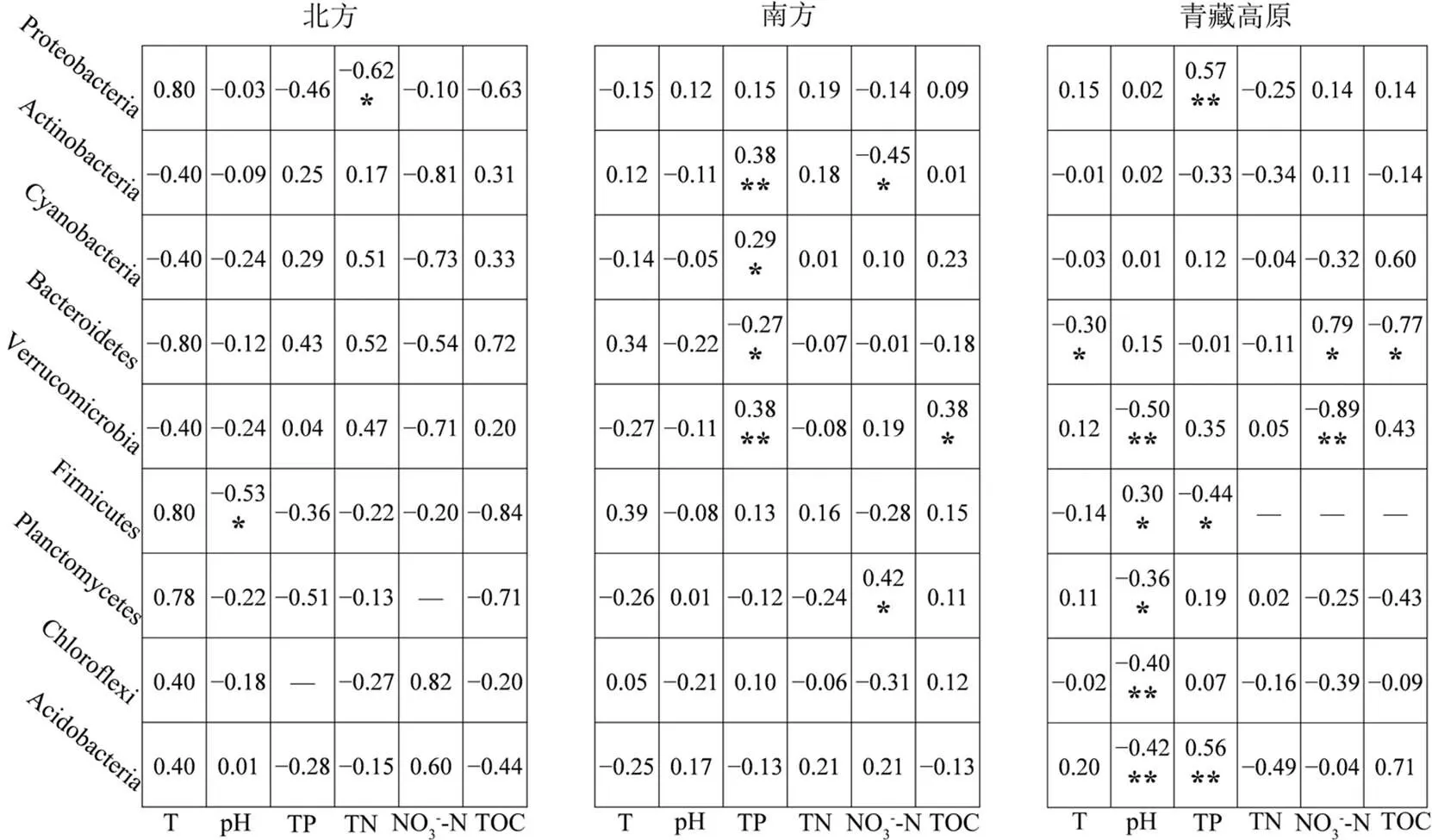
图6 中国湖泊门水平分类沉积物细菌与环境因子的Spearman相关分析
图中数字为相关系数;显著相关:*表示0.01<<0.05,**表示0.001<£0.01;-为缺失值
全国湖泊细菌群落与多数细菌门类均存在显著的距离衰减模式.这与扩散有关[39],扩散是构建生物元群落的基本力量,包括均质化扩散以及扩散限制,扩散会影响局地生物群落的组成、多样性和功能[40].在北美洲五大湖区及克拉马斯河等地的研究表明,扩散限制是影响该地铜绿微囊藻分布格局的重要因素[41];扩散限制也主导了中国东海和南海表层水体中丰富微生物类群的构建[42].我国拥有山脉、高原、平原、盆地和丘陵等各类复杂地形,本次研究的湖泊采样点遍布全国,地理障碍使得内陆湖泊之间的连通性弱,细菌体积小且主动扩散的能力差,在大规模空间尺度上的扩散受到限制,导致全国湖泊细菌群落的相似性随地理距离递减.因此,扩散限制是塑造中国湖泊细菌群落生物地理分布格局的原因之一.
3.2 环境筛选作用与空间扩散限制对菌群的影响
影响北方湖泊浮游细菌群落分布的主要环境因子是DOC,南方是DO,青藏高原是NO3--N;影响北方湖泊沉积物细菌群落分布的主要环境因子是pH值和TN,南方是TP,青藏高原是pH值.北方湖泊水体的DOC与除Cyanobacteria之外的所有菌门呈负相关(图5),DOC通过影响细菌的代谢与呼吸作用从而影响微生物的碳素循环[43].南方湖泊水体的DO与优势菌门Actinobacteria显著正相关,与另一优势菌门Cyanobacteria显著负相关,Actinobacteria的生存对氧含量的依赖度高[44],而Cyanobacteria的呼吸作用则需要消耗大量氧气,这导致南方湖泊水体中的Actinobacteria平均丰度(29.83%)高于全国平均水平(25.03%),Cyanobacteria的平均丰度(9.55%)低于全国平均水平(10.45%),形成了独特的细菌群落结构.NO3--N作为一种营养物质,在青藏高原湖泊水体中的平均浓度高于其他地区,改变了该地区湖泊浮游细菌群落结构.北方湖泊沉积物TN与固氮菌Proteobacteria显著负相关(图6),Proteobacteria大量转化沉积物中的氮进而参与更高级别的物质循环.南方湖泊沉积物中的TP与优势类群Proteobacteria和Chloroflexi正相关,磷作为一种限制湖泊生产力的关键营养物质[45],为细菌的生长和繁殖提供了必需的能量.pH值通过改变青藏高原湖泊沉积物细菌细胞壁上H+和OH-离子的平衡影响细菌的生长和代谢[46].综上所述,不同环境因子对细菌的筛选作用,使北方、南方、青藏高原湖泊细菌群落结构的空间差异显著,是塑造中国湖泊细菌群落生物地理分布格局的另一重要原因.
全国湖泊浮游细菌的距离衰减程度比沉积物细菌更低,这表明扩散限制对浮游细菌的影响比沉积物细菌更小,对长江流域浮游与沉积物细菌群落距离衰减现象的研究也有类似发现[6].此外,由于青藏高原的平均海拔大于4000米[47],其气候特殊性与地形起伏度[48-49]强于我国其他地区,导致青藏高原湖泊浮游及沉积物细菌群落的距离衰减程度均高于北方和南方,环境因子与各类菌门显著相关的次数也比其他地区更多,这表明扩散限制和环境筛选作用对青藏高原湖泊浮游及沉积物细菌的影响比北方和南方更强.北方湖泊浮游及沉积物细菌群落距离衰减模式均不显著,可能是因为北方湖泊采样点大多位于黄河及京杭大运河沿岸,河湖连通提高了细菌的扩散速率,细菌受到的扩散限制比其他地区更小,加之该地区样本数量较少,使得菌群未表现出明显的距离衰减模式.湖泊水体中,环境因子与各类菌门显著相关的次数在南方最少,湖泊沉积物中为北方最少,这表明环境筛选作用分别在南方湖泊水体及北方湖泊沉积物中最弱.由于本次研究仅收集了湖泊门分类尺度,未获得测序原始序列,且各湖泊研究中的环境因子也不一致,无法准确量化扩散限制与环境筛选作用的相对贡献大小;在今后的研究中,可针对全国湖泊微生物群落开展系统性研究,进一步明确空间扩散限制与环境筛选作用对中国湖泊细菌生物地理分布格局的影响.
4 结论
4.1 中国湖泊浮游细菌群落的优势类群为Proteobacteria(35.92%)、Actinobacteria(25.03%)和Bacteroidetes(10.77%),沉积物中的优势类群为Proteobacteria(40.37%)、Chloroflexi(8.74%)和Bacteroidetes(8.55%).
4.2 中国湖泊沉积物细菌距离衰减程度显著高于浮游细菌;湖泊细菌群落结构在北方、南方、青藏高原的空间差异显著,北方水体及沉积物中细菌的距离衰减模式均不显著,南方水体中显著但沉积物中不显著,青藏高原水体及沉积物中均显著.
4.3 浮游细菌优势类群中除Proteobacteria外, Actinobacteria(南方>北方>青藏高原)和Bacteroidetes (青藏高原>北方>南方)的丰度在三个地区均具有显著差异;沉积物细菌优势类群Proteobacteria (北方>南方>青藏高原)、Chloroflexi (南方>北方>青藏高原)、Bacteroidetes(青藏高原>北方>南方)的丰度在三个地区均具有显著差异.
4.4 影响北方湖泊浮游细菌群落分布的主要环境因子是溶解性有机碳,南方是溶解氧,青藏高原是硝酸盐氮;影响北方湖泊沉积物细菌群落分布的主要环境因子是总氮和pH值,南方是总磷,青藏高原是pH值.
4.5 空间扩散限制与环境筛选作用共同塑造了中国湖泊细菌的生物地理分布格局.扩散限制对浮游细菌的影响小于沉积物细菌,对青藏高原湖泊浮游及沉积物细菌影响最大,对北方湖泊浮游及沉积物细菌影响最小;环境筛选作用对青藏高原湖泊浮游及沉积物细菌影响最大,对南方湖泊浮游细菌及北方湖泊沉积物细菌影响最小.
[1] Adrian R, O'Reilly C M, Zagarese H, et al. Lakes as sentinels of climate change [J]. Limnol and Oceanogr, 2009,54(6,part 2):2283- 2297.
[2] Tranvik L J, Downing J A, Cotner J B, et al. Lakes and reservoirs as regulators of carbon cycling and climate [J]. Limnology and oceanography, 2009,54(6):2298-2314.
[3] Pernthaler J. Predation on prokaryotes in the water column and its ecological implications [J]. Nature Reviews Microbiology, 2005,3(7): 537-546.
[4] Newton R J, Jones S E, Eiler A, et al. A guide to the natural history of freshwater lake bacteria [J]. Microbiology and Molecular Biology Reviews, 2011,75(1):14-49.
[5] Huang W, Chen X, Jiang X, et al. Characterization of sediment bacterial communities in plain lakes with different trophic statuses [J]. Microbiologyopen, 2017,6(5):1-14.
[6] Liu T, Zhang A N, Wang J, et al. Integrated biogeography of planktonic and sedimentary bacterial communities in the Yangtze River [J]. Microbiome, 2018,6(1):16.
[7] Dai Y, Yang Y, Wu Z, et al. Spatiotemporal variation of planktonic and sediment bacterial assemblages in two plateau freshwater lakes at different trophic status [J]. Applied Microbiology and Biotechnology, 2016,100(9):4161-4175.
[8] Li Y, Sun L L, Sun M L, et al. Vertical and horizontal biogeographic patterns and major factors affecting bacterial communities in the open South China Sea [J]. Scientific Reports, 2018,8(1):8800.
[9] Wang Z B, Sun Y Y, Li Y, et al Significant bacterial distance-decay relationship in continuous, well-connected Southern ocean surface water [J]. Microbial Ecology, 2020,80(1):73-80.
[10] 薛银刚,刘 菲,江晓栋,等.太湖不同湖区冬季沉积物细菌群落多样性 [J]. 中国环境科学, 2018,38(2):719-728.
Xue Y G, Liu F, Jiang X D, et al. The diversity of bacterial communities in the sediment of different lake zones of Lake Taihu in winter [J]. China Environmental Science, 2018,38(2):719-728.
[11] Li Q, Huang Y, Xin S, et al. Comparative analysis of bacterioplankton assemblages from two subtropical karst reservoirs of southwestern China with contrasting trophic status [J]. Scientific Reports, 2020, 10(1):22296.
[12] Shang Y, Wu X, Wei Q, et al. Total arsenic, pH, and sulfate are the main environmental factors affecting the microbial ecology of the water and sediments in Hulun lake, China [J]. Frontiers in Microbiology, 2020,11:548607.
[13] 杨文焕,石大钧,张 元,等.高原湖泊沉积物中反硝化微生物的群落特征——以包头南海湖为例 [J]. 中国环境科学, 2020,40(1):431- 438.
Yang W H, Shi D J, Zhang Y, et al. Community characteristics of denitrifying microorganisms in plateau lake sediments—taking Nanhaihu lake as example [J]. China Environmental Science, 2020, 40(1):431-438.
[14] Song H, Li Z, Du B, et al. Bacterial communities in sediments of the shallow Lake Dongping in China [J]. Journal of Applied Microbiology, 2012,112(1):79-89.
[15] Xie G, Tang X, Shao K, et al. Bacterial diversity, community composition and metabolic function in Lake Tianmuhu and its dammed river: Effects of domestic wastewater and damming [J]. Ecotoxicology and Environmental Safety, 2021,213:112069.
[16] Langenheder S, Wang J, Karjalainen S M, et al. Bacterial metacommunity organization in a highly-connected aquatic system [J]. FEMS Microbiology Ecology, 2016:w225.
[17] Fillinger L, Hug K, Griebler C. Selection imposed by local environmental conditions drives differences in microbial community composition across geographically distinct groundwater aquifers [J]. FEMS Microbiology Ecology, 2019,95(11):fiz160.
[18] Logares R, Deutschmann I M, Junger P C, et al. Disentangling the mechanisms shaping the surface ocean microbiota [J]. Microbiome, 2020,8(1).
[19] 杨文焕,张 元,王志超,等.寒旱区湖泊沉积物中固氮微生物群落特征——以包头南海湖为例[J]. 中国环境科学, 2020,40(6):2674- 2682.
Yang W H, Zhang Y, Wang Z C, et al. Community characteristics of nitrogen-fixing microorganisms in lake sediment—taking Nanhaihu lake as example [J]. China Environmental Science, 2020,40(6):2674- 2682.
[20] 陈兆进,丁传雨,朱静亚,等.丹江口水库枯水期浮游细菌群落组成及影响因素研究[J]. 中国环境科学, 2017,37(1):336-344.
Chen Z J, Ding C Y, Zhu J Y, et al. Community structure and influencing factors of bacterioplankton during low water periods in Danjiangkou Reservoir [J]. China Environmental Science, 2017, 37(1):336-344.
[21] Leibold M A, Holyoak M, Mouquet N, et al. The metacommunity concept: a framework for multi-scale community ecology [J]. Ecology Letters, 2004,7(7):601-613.
[22] Liu L M, Yang J, Yu Z, et al. The biogeography of abundant and rare bacterioplankton in the lakes and reservoirs of China [J]. The ISME journal, 2015,9(9):2068-2077.
[23] Bai C, Cai J, Zhou L, et al. Geographic patterns of bacterioplankton among lakes of the middle and lower reaches of the Yangtze river basin, China J]. Applied and Environmental Microbiology, 2020, 86(6):e02423-19.
[24] Liu Y, Yao T, Jiao N, et al. Salinity impact on bacterial community composition in five high-altitude lakes from the Tibetan Plateau, Western China [J]. Geomicrobiology journal, 2013,30(5):462-469.
[25] Ostertagová E, Ostertag O, Kováč J. Methodology and Application of the Kruskal-Wallis Test [J]. Applied Mechanics and Materials, 2014, 611:115-120.
[26] Gu Z, Gu L, Eils R, et al. Circlize Implements and enhances circular visualization in R [J]. Bioinformatics (Oxford, England), 2014,30(19): 2811-2812.
[27] Yan Q, Stegen J C, Yu Y, et al. Nearly a decade-long repeatable seasonal diversity patterns of bacterioplankton communities in the eutrophic Lake Donghu (Wuhan, China) [J]. Molecular Ecology, 2017, 26(14):3839-3850.
[28] Chen W, Ren K, Isabwe A, et al. Stochastic processes shape microeukaryotic community assembly in a subtropical river across wet and dry seasons [J]. Microbiome, 2019,7(1):138.
[29] Lu Z, Liu Z, Zhang C, et al. Spatial and seasonal variations of sediment bacterial communities in a river-bay system in South China [J]. Applied Microbiology and Biotechnology, 2021,105(5):1979- 1989.
[30] Dixon P. VEGAN, a package of R functions for community ecology [J]. Journal of Vegetation Science, 2003,14(6):927-930.
[31] Kosek K, Luczkiewicz A, Kozioł K, et al. Environmental characteristics of a tundra river systemin Svalbard. Part 1:Bacterial abundance, community structure and nutrient levels [J]. Science of the Total Environment, 2018,653:1571-1584.
[32] Núñez Salazar R, Aguirre C, Soto J, et al. Physicochemical parameters affecting the distribution and diversity of the water column microbial community in the high-altitude Andean lake system of La Brava and La Punta [J]. Microorganisms, 2020,8(8):1181.
[33] Tang X M, Xie G J, Shao K Q, et al. Contrast diversity patterns and processes of microbial community assembly in a riverlake continuum across a catchment scale in northwestern China [J]. Environmental Microbiome, 2020,1(15):10.
[34] Hamilton W D, Lenton T M. Spora and Gaia: how microbes fly with their clouds [J]. Ethology, Ecology & Evolution, 1998,10(1):1-16.
[35] Figuerola J, Green A J, Michot T C. Invertebrate eggs can fly: evidence of waterfowl-mediated gene flow in aquatic invertebrates [J]. The American Naturalist, 2005,165(2):274-280.
[36] Wang W, Zhou L, Fu R, et al. Effects of foraging site distances on the intestinal bacterial community compositions of the sympatric wintering hooded crane and domestic duck () [J]. Avian Research, 2021,12(1):1-11.
[37] Ruuskanen M O, St P K, St L V, et al. Physicochemical Drivers of Microbial Community Structure in Sediments of Lake Hazen, Nunavut, Canada [J]. Frontiers in Microbiology, 2018,9:1138.
[38] Jin L, Lee C S, Ahn C, et al. Abundant iron and sulfur oxidizers in the stratified sediment of a eutrophic freshwater reservoir with annual cyanobacterial blooms [J]. Scientific Reports, 2017,7(1):43814-43827.
[39] Martiny J B H, Bohannan B J M, Brown J H, et al. Microbial biogeography: putting microorganisms on the map [J]. Nature Reviews Microbiology, 2006,4(2):102-112.
[40] Verreydt D, De Meester L, Decaestecker E, et al. Dispersal-mediated trophic interactions can generate apparent patterns of dispersal limitation in aquatic metacommunities [J]. Ecology Letters, 2012, 15(3):218-226.
[41] Shirani S, Hellweger F L. Neutral evolution and dispersal limitation produce biogeographic patterns in microcystis aeruginosa populations of lake systems [J]. Microbial Ecology, 2017,74(2):416-426.
[42] Wu W, Logares R, Huang B, et al. Abundant and rare picoeukaryotic sub-communities present contrasting patterns in the epipelagic waters of marginal seas in the northwestern Pacific Ocean [J]. Environmental Microbiology, 2017,19(1):287-300.
[43] 叶琳琳,孔繁翔,史小丽,等.富营养化湖泊溶解性有机碳生物可利用性研究进展 [J]. 生态学报, 2014,34(4):779-788.
Ye L L, Kong F X, Shi X L, et al. The bioavailability of dissolved organic carbon in the eutrophic lakes [J]. Acta Ecologica Sinica, 2014, 34(4):779-788.
[44] Taipale S, Jones R I, Tiirola M. Vertical diversity of bacteria in an oxygen-stratified humic lake, evaluated using DNA and phospholipid analyses [J]. Aquatic Microbial Ecology, 2009,55:1-16.
[45] Jin X, Wang S, Pang Y, et al. The adsorption of phosphate on different trophic lake sediments [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2005,254(1):241-248.
[46] Harrison J P, Gheeraert N, Tsigelnitskiy D, et al. The limits for life under multiple extremes [J]. Trends in Microbiology, 2013,21(4):204- 212.
[47] 张镱锂,李炳元,刘林山,等.再论青藏高原范围 [J]. 地理研究, 2021, 40(6):1543-1553.
Zhang Y L, Li B Y, Liu L S, et al. Redetermine the region and boundaries of Tibetan Plateau [J]. Geographical Research, 2021,40 (6):1543-1553.
[48] 游 珍,封志明,杨艳昭.中国1km地形起伏度数据集 [J]. 全球变化数据学报(中英文), 2018,2(2):151-155.
Y Z, Feng Z M, Yang Y Z. Relief degree of land surface dataset of China (1km) [J]. Journal of Global Change Data & Discovery, 2018, 2(2):151-155.
[49] 封志明,李文君,李 鹏,等.青藏高原地形起伏度及其地理意义[J]. 地理学报, 2020,75(7):1359-1372.
Feng Z M, Li W J, Li P, et al. Relief degree of land surface and its geographical meanings in the Qinghai-Tibet Plateau, China [J]. Acta Geographica Sinica, 2020,75(7):1359-1372.
Biogeographic patterns and assembly mechanisms of bacterial communities in lakes, China—statistical analysis based on the published literature.
GAO Peng-fei1,2, WANG Peng1,2*, DING Ming-jun1,2, ZHANG Hua1,2, NIE Ming-hua1,2, HUANG Gao-xiang1,2
(1.Key Laboratory of Poyang Lake Wetland and Watershed Research, Ministry of Education, Jiangxi Normal University, Nanchang 330022, China;2.School of Geography and Environment, Jiangxi Normal University, Nanchang 330022, China)., 2022,42(6):2754~2763
In order to examine the biogeographic patterns and assembly of bacterial communities in Chinese lakes, data from the published literature on water or sediment bacteria at the phylum level and environmental factors from 228 lakes were collected. Results showed that the dominant taxa of the water bacteria communities in Chinese lakes were Proteobacteria (35.92%), Actinobacteria (25.03%) and Bacteroidetes (10.77%), and the dominant taxa in sediment were Proteobacteria (40.37%), Chloroflexi (8.74%) and Bacteroidetes (8.55%).Distance decay of water bacteria communities was significantly lower than that of sediment bacteria. There was significant spatial difference of lake bacteria communities between Northern China, Southern China and Tibetan Plateau. The distance decay of bacterial communities was not significant in Northern China, but significant in Tibetan Plateau; in Southern China, the distance decay of bacterial communities was significantin lake water, but not significant in lake sediment. The abundance of Actinobacteria (Southern China>Northern China>Tibetan Plateau) and Bacteroidetes (Tibetan Plateau >Northern China>Southern China) in lake waterwere significantly different between the three regions, while Proteobacteria was not. The abundance of Proteobacteria (Northern China>Southern China> Tibetan Plateau), Chloroflexi (Southern China>Northern China> Tibetan Plateau), and Bacteroidetes (Tibetan Plateau >Northern China>Southern China) in lake sediment were significantly different between the three regions. The main environmental factor influencing bacterial communities in lake water of Northern China was dissolved organic carbon, in Southern Chinawas dissolved oxygen, and in Tibetan Plateau was nitrate nitrogen. The main environmental factor influencing bacterial communities in lake sediment of Northern China were total nitrogen and pH, in Southern China was total phosphorus, and in Tibetan Plateauwas pH. Dispersal limitation and variable selection collectively shaped the biogeographic patterns of lake bacteria in China. Dispersal limitation had less impact on water bacteria than sediment bacteria;it had the greatest impact on water and sediment bacteria inTibetan Plateau lakes, and the least impact on water and sediment bacteria in Northern China lakes. Variable selection had the greatest impact on water and sediment bacteria in Tibetan Plateau lakes, andless impact on water bacteria in Southern China lakes and sediment bacteria in Northern China lakes.
Chinese lakes;bacterial community;geographical distance decay;variable selection;dispersal limitation
X172
A
1000-6923(2022)06-2754-10
高鹏飞(1997-),男,山西阳泉人,江西师范大学硕士研究生,主要从事水环境微生物研究.
2021-11-09
国家自然科学基金项目(42167013);江西省自然科学基金(20202BABL203032);江西省教育厅研究生创新基金项目(YC2021-S231)
* 责任作者, 教授, wangpengjlu@jxnu.edu.cn

