内镜联合腹腔镜在胃肠微创手术治疗中的应用效果
陈树强
广西防城港市港口区人民医院 广西 防城港 538001
胃肠道疾病具有多发性特征,其中部分疾病需要通过手术治疗,如胃肠息肉、胃间质瘤等[1]。以往临床所应用的开腹手术治疗创伤性大,不利于患者术后恢复。后期在微创外科技术的支持下,普遍实现了胃肠道疾病的微创手术治疗,基于降低手术创伤性,进一步提升患者安全保障水平,预防潜在并发症[2]。除此之外,微创手术治疗后患者恢复周期较短,对于实现术后快速康复目标而言具有重要意义[3]。腹腔镜与内镜是微创手术治疗中常用技术,有助于明确病灶部位及其与邻近组织关系,并提供清晰术野,促使手术顺利完成[4]。本研究中对院内94例胃肠疾病患者进行分组调查,旨在探究内镜联合腹腔镜微创手术治疗效果。
1 资料与方法
1.1 一般资料
以2020年2月~2021年5月院内行胃肠手术治疗患者94例为研究对象,以随机数字表法分对照组、观察组,各47例。对照组:男26例,女21例;年龄46~78岁,平均(61.24±8.61)岁;直肠息肉7例,胃间质瘤5例,胃癌22例,直肠癌13例。观察组:男25例,女22例;年龄47~78岁,平均(62.68±8.46)岁;直肠息肉8例,胃间质瘤7例,胃癌21例,直肠癌11例。组间基线资料无差异性,可对比研究。纳入标准:①内镜与腹腔镜手术适应证;②影像学检查排除淋巴结转移与外侵;③签署知情同意书。排除标准:①放化疗、免疫治疗者;②合并胃穿孔或胃溃疡;③凝血功能障碍。
1.2 方法
对照组:开腹术治疗,具体如下:
术前行病理检查,结合既往史与病情制定手术方案。全麻处理,结合病灶部位取手术位,常规头高脚低卧位。分开双腿,结合病灶部位、形状、大小,给予切除治疗,术后常规留置引流管。
观察组:内镜联合腹腔镜微创术治疗,具体如下:
胃部病变:仰卧位,10mm Trocar置入脐下,与脐水平左侧6cm置入Trocar,为观察孔、主操作孔。Trocar置入剑突与脐连线中点右侧,为辅助操作孔,另以直径5mmTrocar置入左腋前线与右锁骨中线肋缘,暴露视野。建立气腹后,经口置入胃镜,明确病变部位,活检钳推动瘤体缝合固定。对胃底或胃体瘤体以超声刀行脾胃、肝胃韧带游离,胃腔外楔形切除胃结肠韧带。以内镜支持下,楔形切除胃部肿瘤与邻近组织。有必要胃切除者,行胃空肠吻合术,重建消化道。
肠道病变:利用内镜进行大体积肿瘤定位,腹腔镜进行瘤体切除,并清扫淋巴组织。利用内镜无法完全摘除瘤体者,以肠镜识别肠段,圈套住瘤体,若有穿孔或出血现象,对肠壁薄弱处缝合加固。
1.3 观察指标
(1)手术一般情况,如手术时间、出血量、导管留置时间、排气时间。(2)检测应激相关指标,如肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、C反应蛋白(CRP)。(3)检测免疫功能相关指标,如CD4+、CD8+、CD4+/CD8+。(4)统计术后不同阶段疼痛评分,以VAS法进行,分值高提示疼痛程度严重。(5)统计术后并发症发生情况。
1.4 统计学处理
2 结果
2.1 比较患者手术一般情况
观察组比照对照组手术时间较长,术中出血量、导管留置时间、排气时间、住院时间均短于对照组患者(P<0.05)。见表1。
表1 比较患者手术一般情况(±s)

表1 比较患者手术一般情况(±s)
组别例数手术时间(min) 术中出血量(ml) 导管留置时间(d) 排气时间(d) 住院时间(d)观察组 47 136.28±10.35 47.52±5.18 2.15±0.61 2.45±0.17 7.62±1.05对照组 47 108.54±10.27 98.26±10.24 4.65±1.25 4.15±1.07 9.54±1.21 t-13.043 30.313 12.322 10.757 8.216 P-<0.001 <0.001 <0.001 <0.001 <0.001
2.2 比较患者应激相关指标
术前进行应激相关指标检测水平均无差异性,术后患者TNF-α、IL-6、CRP几项指标水平均有所升高,以对照组为参照,观察组患者术后水平相对较低(P<0.05)。见表2。
表2 比较患者应激相关指标(±s)
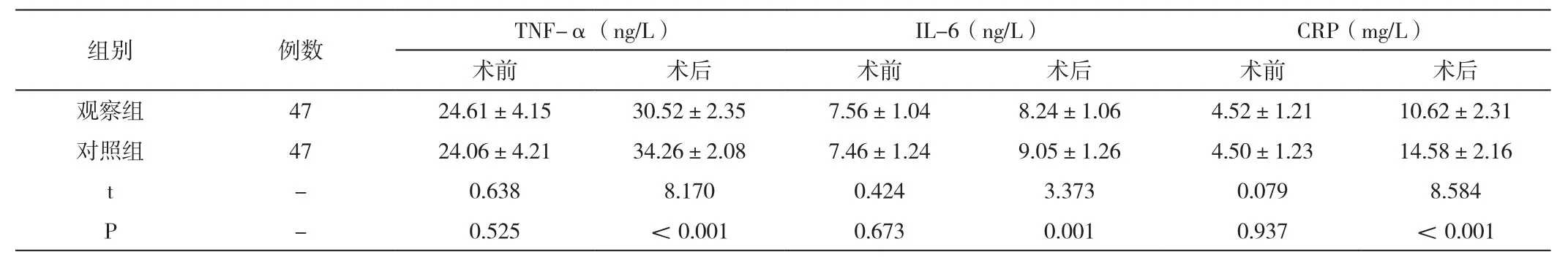
表2 比较患者应激相关指标(±s)
组别例数 TNF-α(ng/L) IL-6(ng/L) CRP(mg/L)术前术后术前术后术前术后观察组 47 24.61±4.15 30.52±2.35 7.56±1.04 8.24±1.06 4.52±1.21 10.62±2.31对照组 47 24.06±4.21 34.26±2.08 7.46±1.24 9.05±1.26 4.50±1.23 14.58±2.16 t-0.638 8.170 0.424 3.373 0.079 8.584 P-0.525 <0.001 0.673 0.001 0.937 <0.001
2.3 比较患者免疫功能指标
术前进行免疫功能指标检测水平均无差异性,术后以对照组患者为参照,观察组患者CD4+、CD4+/CD8+水平较高,CD8+指标水平较低(P<0.05)。见表3。
表3 比较患者免疫功能指标(±s)

表3 比较患者免疫功能指标(±s)
组别例数 CD4+ CD8+ CD4+/CD8+术前术后术前术后术前术后观察组 47 52.62±6.14 42.26±5.06 35.15±4.05 39.52±5.32 1.32±0.15 1.15±0.21对照组 47 52.31±6.25 36.24±5.14 35.06±4.32 42.25±5.01 1.33±0.20 0.91±0.24 t-0.243 5.722 0.104 2.561 0.274 5.159 P-0.809 <0.001 0.917 0.012 0.785 <0.001
2.4 比较患者术后疼痛评分
以对照组患者为参照,观察组患者在术后当日、术后3d、术后1周几个时段进行疼痛程度测定,评分均明显较低(P<0.05)。见表4。
表4 比较患者术后疼痛评分[(±s),分]
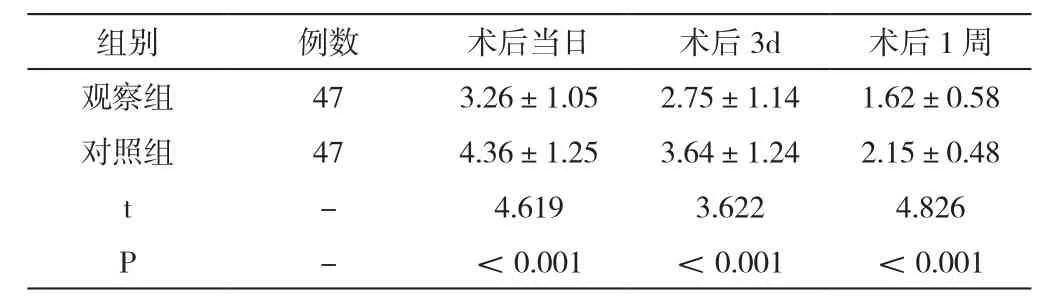
表4 比较患者术后疼痛评分[(±s),分]
组别例数 术后当日 术后3d 术后1周观察组 47 3.26±1.05 2.75±1.14 1.62±0.58对照组 47 4.36±1.25 3.64±1.24 2.15±0.48 t-4.619 3.622 4.826 P-<0.001 <0.001 <0.001
2.5 比较患者术后并发症发生率
术后少数患者发生切口感染、腹腔感染、吻合口瘘、切口出血并发症,观察组的2.13%,明显小于对照组12.77%(P<0.05)。见表5。

表5 比较患者术后并发症发生率(n,%)
3 讨论
外科手术技术的发展从最初实现对于多种疾病的有效治疗,逐渐发展为更倾向于关注手术操作的创伤性以及患者治疗后的安全性[5]。而此种目标的实现,需要建立在微创外科技术的不断发展基础之上。以胃肠道疾病患者的外科手术治疗为例以往开腹手术治疗基于创伤性较大且术中出血量较多,术后容易发生感染与出血等并发症[6]。而相关并发症的发生,将直接影响患者术后恢复质量甚至于加重病情。为降低此类风险可利用微创外科技术降低手术对于患者机体创伤性,从而实现术后快速康复目标[7]。内镜与腹腔镜是现代临床治疗中常用微创技术,其作用在于明确病变部位与邻近组织关系情况,为手术操作提供清晰术野,在小切口条件下确保手术操作顺利完成[8]。
对于微创手术与开腹手术的治疗,目前临床实践以及大量研究资料均已经证实,两种手术方式可达到相近的治疗效果[9]。代表微创手术的应用并不会影响到患者疾病治疗效果[10]。但在手术操作以及相关情况方面,微创手术的应用可呈现出诸多优势。观察组比照对照组手术时间较长,术中出血量、导管留置时间、排气时间、住院时间均短于对照组患者。在手术操作上,微创手术治疗较为复杂,为此所需手术时间相对较长。但在内镜与腹腔镜技术下,可对患者做小切口手术,从而降低手术创伤性。同时基于微创手术操作中视野较大,可对病灶情况进行全面检测,有助于实现精准操作而减少术中出血量。基于微创手术操作,对于患者创伤性较小,为此术后恢复快,可减少排气时间与导管留置时间。
在手术治疗安全性方面,对于胃肠疾病患者的外科手术治疗中容易引起应激反应或免疫功能下降。本次研究结果显示,术前进行应激相关指标检测水平均无差异性,术后患者TNF-α、IL-6、CRP几项指标水平均有所升高,以对照组为参照,观察组患者术后水平相对较低。术前进行免疫功能指标检测水平均无差异性,术后以对照组患者为参照,观察组患者CD4+、CD4+/CD8+水平较高,CD8+指标水平较低。开腹手术治疗对于患者应急水平与免疫功能的影响较大,而微创手术基于创伤性较小且术中出血量较低,不容易引发患者应激反应,且患者免疫功能下降水平明显较低。免疫功能调查中CD4+属于辅助性T细胞,能够释放出大量细胞因子,提升机体抗肿瘤能力。而CD8+属于抑制性T细胞,可特异性杀伤靶细胞,实现清除病毒功能。两项指标的比值可进行机体免疫状态的评估,若比值失衡则代表存在免疫功能紊乱情况。基于对以上指标的观察证实了微创手术治疗对于机体具有一定免疫功能保护作用。另外,以对照组患者为参照,观察组患者在术后当日、术后3d、术后1周几个时段进行疼痛程度测定,评分均明显较低。术中切口大小如何以及术中出血量对于患者术后疼痛程度具有明显影响,对比之下微创手术操作有助于降低患者术后疼痛程度。
对于外科手术治疗的安全性,最为受到的关注是术后并发症风险问题。以往临床所用开腹手术治疗胃肠疾病,术后切口感染与出血以及腹腔感染的风险较高。对比之下,在内镜与腹腔镜技术支持下进行微创手术治疗,可有效防控术中潜在并发症。例如微创手术中视野清晰不存在盲区,而腹腔镜的辅助应用还具有视觉放大效应,有助于进行手术口吻合,进而降低术后出血与吻合口瘘等并发症发生风险。
综上所述,在胃肠手术中,以开腹手术对比,在内镜与腹腔镜支持下的微创手术可极大降低创伤性,并预防感染与出血等潜在并发症,对于实现患者术后早期恢复具有积极作用。

