Apbb1 基因对心肌细胞增殖影响的探究
刘 俊孙 佳刘维静郝琰琰廉 虹∗王玉瑶∗
(1.山西医科大学基础医学院 生物化学与分子生物学教研室,太原 030000;2.河北燕达陆道培医院检验科,河北 廊坊 065201;3.中国医学科学院,北京协和医学院,国家心血管疾病中心,动物实验中心, 心血管植入材料临床前研究评价北京市重点实验室,北京 102300)
目前,缺血性心脏病是导致人类死亡的首要病因,而心肌梗死是缺血性心脏病产生的主要原因之一[1]。 心肌梗死会导致大量的心肌细胞丢失,丢失的心肌细胞由于心肌细胞本身绝大部分都处于终末分化时期,不能通过剩余的心肌细胞增殖补充[2]。 因此,如何诱导已处于终末分化的心肌细胞增殖对于缺血性心脏病的治疗异常重要。
H9c2 心肌细胞是一种大鼠胚胎心脏来源的心肌细胞系,由于其具有与心肌细胞相似的特性,并且经济易得,所以研究人员经常用其作为研究心脏与心肌细胞相关通路的研究对象。 相较于H9c2 细胞,从小鼠与大鼠体内分离的原代心肌细胞虽然更能代表体内心肌细胞的状态,但原代心肌细胞分离过程不仅复杂,而且分离后的状态很难保证。 利用状态不佳的原代心肌细胞进行研究很有可能会得出不正确的结果与结论。 因此,可以将H9c2 心肌细胞作为心肌细胞增殖研究的实验对象,用于解析心肌细胞增殖涉及的具体机制。
β 淀粉样蛋白前体蛋白结合蛋白B-1(APBB1)是一种衔接蛋白,其主要在神经性疾病如阿尔兹海默症中被研究[3]。 然而,Mahmoud 等[4]发现,在显著促进心肌细胞增殖的Meis1 敲除小鼠心脏中,Apbb1 mRNA 表达水平显著降低。 此外,Apbb1 被视为心脏肥大的早期标志物[5],而心脏肥大与心肌细胞肥大相关,心肌细胞肥大相关因子可能参与调控心肌细胞增殖[6]。 但是,Apbb1 是否在心肌细胞增殖过程中发挥一定的生物学功能,从而影响心肌细胞的增殖,目前无相关文献报道。
因此,本研究通过siRNA 敲低技术与质粒过表达的方式改变了H9c2 心肌细胞中Apbb1 基因的表达量,探究了Apbb1 基因对H9c2 心肌细胞增殖的影响,并利用在线数据库String 分析了APBB1 蛋白的互作蛋白,发现其互作蛋白KAT5 的转录水平与Apbb1 的调控趋势变化一致。 这可能为解析心肌细胞增殖的机制,促进对心脏再生的理解,以及治疗缺血性心脏病提供新的思路。
1 材料和方法
1.1 细胞
大鼠胚胎心脏来源的H9c2 心肌细胞系购自中科院上海细胞生物学研究所细胞库。
1.2 主要试剂与仪器
Gibico 澳洲胎牛血清与DMEM 高糖基础培养基均购自美国Gibico 公司,澳洲胎牛血清货号为10099-141C;lipo3000 转染试剂、Opotimem-Medium与TRIzol 均购自美国Invitrogen 公司;逆转录试剂盒购自TaKaRa 公司;CCK8 增殖检测试剂盒购自博士德生物公司;qPCR 试剂盒购自北京聚合美生物公司;Aurora B 一抗购自Abcam 公司,货号为Ab239837;PH3 一抗购自美国Millipore 公司,货号为3377;荧光二抗Alexa Fluor 488 购自美国Invitrogen 公司,货号为A1108;敲低组使用的非特异性小干扰RNA(NC)与特异性的si-Apbb1 均购自汉恒生物科技(上海)有限公司;过表达组使用的pcDNA3.1+空质粒与携带Apbb1 基因的pcDNA3.1+质粒均购自通用生物系统(安徽)有限公司。
1.3 实验方法
1.3.1 细胞培养
用含10%血清与含1%青链霉素的DMEM 高糖培养基培养H9c2 心肌细胞,将细胞置于培养条件为37℃,5% CO2的细胞培养箱中进行培养。
1.3.2 siRNA 转染及分组
取处于对数生长期的H9c2 细胞105个,接种至六孔板中,待其生长至70%左右,准备转染。 转染方案确定前,利用带荧光的FAM siRNA 进行最佳siRNA 转染浓度的摸索。 具体摸索过程按照siRNA转染说明书所描述的进行, 固定 lipo3000 与opotimen-Medium 的用量,对说明书推荐的20、50 与100 nmol/L 3 个浓度的siRNA 进行转染。 最终根据转染后细胞荧光强弱以及细胞状态,确定50 nmol/L为最佳siRNA 转染浓度,50 nmol/L 在六孔板中对应的体积为6.5 μL。 正式转染时,先分别配置转染复合物与敲低复合物。 通过6.5 μL lipo3000 与125 μL Opotimem-Medium 培养基配置转染复合物;6.5 μL siRNA 与125 μL Opotimem-Medium 培养基配置敲低复合物。 两种混合物配置完成之后,室温静置5 min。 静置完成之后,将两种混合物混匀,室温再次静置10 min,然后再加入培养孔内,开始转染。 由于lipo3000 对细胞生物毒性较小,可以将转染处理时长延长至12 h,再将其传入6 cm 皿中培养36 h,最后利用qPCR 实验检测细胞转染效率。 分组上,将转染的组别按照所转染的siRNA 不同分别设为Si-NC组、1Si-Apbb1 组、2Si-Apbb1 组和3Si-Apbb1 组。 Si-NC 组表示为转染非特异性小干扰RNA 的对照组,1Si-Apbb1 与2Si-Apbb1 以及3Si-Apbb1 组代表转染从公司购买的3 组特异性针对Apbb1 基因的siRNA序列的组。 上述用到的siRNA 具体序列如下(5’-3’), si-NC 正 向: UUCUCCGAACGAACGUGUC ACGUTT,反向:ACGUGACACGUUCGGAGAATT;1si-Apbb1 正向:CCUACGUAGCUCGAGAUAATT,反向:UUAUCUCGAGCUACGUAGGTT; 2si-Apbb1 正 向:GCUCAAGUGCCACGUGUUUTT,反向:AAACACGUG GCACUUGAGCTT; 3si-Apbb1 正 向: CCCAGCACC AAAGAAUGAATTT,反向:UUCAUUCUUUGGUGCU GGGTT; FAM siRNA 正 向: UUCUCCGAACGUGU CACGUTT,反向:ACGUGACACGUUCGGAGAATT。
1.3.3 pcDNA3.1+质粒转染及分组
取处于对数生长期的H9c2 细胞105个,接种至六孔板中,待其生长至70%左右,准备转染。 转染时,首先配置转染复合物与过表达复合物。 配置转染复合物需要加入2 μL lipo3000 与125 μL Opotimem-Medium 培养基。 配置过表达复合物需要加入1 μg pcDNA3.1+的质粒与2 μL P3000 以及125 μL Opotimem-Medium。 配置完成之后,先分别混匀室温静置5 min,然后再将两种混合物混合在一起,室温静置10 min。 最后将混匀好的混合物分别加入相应的培养孔中,开始转染。 后续转染过程同siRNA 转染过程,最终利用qPCR 实验检测细胞转染效率。 根据转染的质粒不同,将转染的组别分别设为OE-NC 组与OE-Apbb1 组,OE-NC 组代表转染pcDNA3.1+空质粒的组,OE-Apbb1 组代表转染携带Apbb1 基因的pcDNA3.1+质粒的组。
1.3.4 利用qPCR 法检测Apbb1 转染效率与细胞增殖
转染完成之后,首先利用TRIzol 提取出RNA,再将RNA 逆转录为cDNA,最后完成qPCR 反应。TRIzol 提取RNA 过程按照提取细胞RNA 的方式进行提取,逆转录以及qPCR 反应的具体操作、具体条件以及具体参数均按照所用试剂对应的说明书指示进行。 数据统计时,以Gapdh为内参,利用ΔΔCT法定量分析Apbb1 转染效率与细胞增殖相关基因的表达水平。 上述实验所用相关引物序列如下(5’-3’):Gapdh正向:CGCCTGGAGAAACCTGCC,反向:GTAGGCCATGAGGTCCACCAC;Apbb1 正向:ACCTA CTACTGGCACATCCC, 反 向: TCCTTCCTCAAAGC CTTCT;Ccnb1 正向:TCCCACACGGAGGAATCTCT,反 向: TCTGCAGACGAGGTAGTCCA;Ki67 正 向:GCAAGAGGCAAATCATCCGAACCC,反向:GAGAAC CTTGCCACTCTTCTGCCC;PCNA正向:GCTGACAT GGGACACTTA,反向:CTCAGGTACAAACTTGGTG;Ccnd1 正向:GAGGAGCAGAAGTGCGAAGA,反向:GGCGGATAGAGTTGTCAGTGTAG;Ccna2 正向:AG CAGGAAGACCAGGAGAAT,反向:GGTGAAGGCAG GCTGTTTA;Kat5 正向: CCTATAGCGCACTCAGCT CC,反向:CGATTATCTCCCCCACCTCC;App正向:CCAACCGTGGCATCCTTTTG, 反 向: GCGTCGACA GGCTCAACTTC;Lrp1 正向:GCGGTGTGACAACGA CAA,反向:AACTGGGTACTGGAGCAGGA。
1.3.5 利用细胞免疫荧光法检测细胞增殖
取转染完成后的细胞按照相应组别以每孔5×104个细胞均匀铺入含爬片的12 孔板孔中,待细胞长至60%~70%左右,利用细胞增殖标志物Aurora B 与PH3 的免疫荧光抗体对细胞进行细胞免疫荧光实验,以检测细胞增殖。 实验具体过程如下:首先利用PBS 清洗细胞3 次,清洗后弃去废液,再用4%多聚甲醛对细胞进行固定20 min。 固定后,利用含1%的Triton 对细胞进行通透5 min,通透后再利用5% BSA 封闭1 h,封闭后利用一抗进行孵育,4℃过夜。 孵育后利用PBS 清洗3 次洗去多余一抗,接着利用二抗室温孵育1 h,注意荧光二抗操作时需要避光。 孵育完二抗后,利用PBS 洗3 次洗去多余二抗,然后加入DAPI 染液对细胞核进行染色,染5~10 min。 染核后,用PBS 洗3 次洗去多余DAPI 染液,最后利用防荧光淬灭剂与盖玻片进行封片。
1.3.6 利用CCK8 法检测细胞增殖
取转染完成后的细胞按照相应组别以每孔3×103个细胞每孔均匀铺入96 孔板中。 铺的孔数取决于组别与检测的时间点以及复孔数。 组别主要包括Si-NC、Si-Apbb1、OE-NC 与OE-Apbb1 4 个组别,检测的时间点主要包括24、48 与72 h 3 个时间点,每个组别的每个时间点设置6 个复孔。 具体实验过程如下:铺完细胞后,每隔24 h 往孔中加入无血清DMEM 高糖培养基稀释的CCK8 试剂,稀释比例为10 ∶1,每孔加入100 μL。 加完CCK8 试剂后,在培养箱中培养2 h,然后在酶标仪中检测其在OD450的吸光度值。 数据统计上为避免偏差,对于6个复孔吸光度值的处理方式是去掉一个最高值与一个最低值,然后利用归一化方法按照组别与时间点进行统计分析。
1.3.7 蛋白互作网络分析
进入在线数据库String(https:/ /cn.string-db.org/),输入目的蛋白与种属,得到目的蛋白的互作蛋白网络。 为获得可信度较高的互作蛋白,将其互作得分设置为最高的可信度0.9。
1.4 统计学方法
采用Graphpad prism 8.02 对结果进行统计分析。 实验数据采用平均数±标准差(±s)表示,组间比较采用未配对的student’st检验与单因素方差分析,P<0.05 被认为差异具有统计学意义。
2 结果
2.1 siRNA 最佳转染浓度确定
为了探究siRNA 最佳转染浓度,我们分别用20、50 和100 nmol/L 3 个浓度进行H9c2 细胞的转染,镜下观察结果显示,siRNA 最佳转染浓度为50 nmol/L,具体见图1。

注:A:20 nmol/L siRNA 转染荧光图;B:50 nmol/L siRNA 转染转染荧光图;C:100 nmol/L siRNA 转染荧光图。图1 siRNA 最佳转染浓度的筛选Note. A,Fluorescence plot of 20 nmol/L siRNA transfection. B,Fluorescence plot of 50 nmol/L siRNA transfection. C,Fluorescence plot of 100 nmol/L siRNA transfection.Figure 1 Screening for optimal transfection concentration of siRNA
2.2 敲低效率最佳的si-Apbb1 筛选
对从公司获得的3 组特异性si-Apbb1 进行转染,筛选敲低效率最佳的si-Apbb1。 qPCR 结果显示,相较于Si-NC 组,2Si-Apbb1 组的敲低效率最高,Apbb1 mRNA 水平的敲低效率可以达到51%(Si-NC组:(1.01±0.21);2Si-Apbb1 组:(0.49±0.03),P<0.05,n=3)(见图2),因此,敲低实验最终选用2si-Apbb1,文章后续提到的Si-Apbb1 组均指利用2si-Apbb1 进行转染。
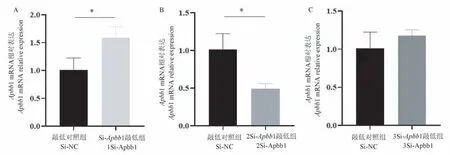
注:A:1Si-Apbb1 组的敲低效率;B:2Si-Apbb1 组的敲低效率;C:3Si-Apbb1 组的敲低效率。 与Si-NC 组相比,∗P<0.05。图2 筛选敲低效率最佳的si-Apbb1Note. A,Knockdown efficiency of 1Si-Apbb1 group. B,Knockdown efficiency of 2Si-Apbb1 group. C,Knockdown efficiency of 3Si-Apbb1 group. Compared with Si-NC group,∗P<0.05.Figure 2 Screening for Si-Apbb1 with the best knockdown efficiency
2.3 CCK8 实验检测Apbb1 对H9c2 心肌细胞增殖的影响
CCK8 细胞增殖实验中,相较于Si-NC 组,Si-Apbb1 组H9c2 心肌细胞虽然在48 h 时增殖显著下降0.44 倍(Si-NC 组:(3.06±0.12);Si-Apbb1 组:(2.62±0.16),P<0.01,n=3),但是在72 h 时增殖显著增加0.86 倍(Si-NC 组:(5.30±0.13);Si-Apbb1 组:(6.16±0.36),P<0.0001,n= 3),见图3A。 相较于OE-NC 组,OE-Apbb1 组H9c2 心肌细胞在48 h 与72 h 增殖分别降低1.23 倍(OE-NC组:(4.4±0.14);OE-Apbb1 组:(3.17±0.53),P<0.0001,n=3)和1.04 倍(OE-NC 组:(6.04±0.22);OE-Apbb1 组:(5.00±0.27),P<0.0001,n=3),增殖明显受到抑制,见图3B。
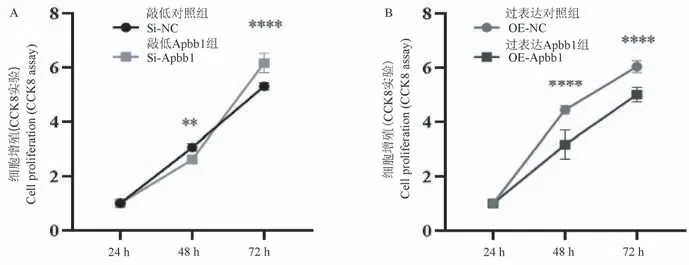
注:A:利用CCK8 法检测Si-NC 组与Si-Apbb1 组的增殖情况;B:利用CCK8 法检测OE-NC 组与OE-Apbb1 组的增殖情况。 与各自的NC 组相比,∗∗P<0.01,∗∗∗∗P<0.0001。图3 CCK8 实验检测H9C2 心肌细胞增殖结果Note. A,Proliferation of Si-NC group and Si-Apbb1 group was detected by CCK8 assay. B,Proliferation of Si-NC group and Si-Apbb1 group was detected by CCK8 assay. Compared with their respective NC group,∗∗P<0.01,∗∗∗∗P<0.0001.Figure 3 Determination of proliferation of H9C2 cardiomyocytes by CCK8 assay
2.4 qPCR 实验检测Apbb1 对细胞增殖的影响
相较于Si-NC 组,Si-Apbb1 组敲低效率达到52%(Si-NC 组:(1.00±0.12);Si-Apbb1 组:(0.48±0.03),P<0.01,n=3);Si-Apbb1 组典型的细胞增殖标志分子Ki67 与PCNAmRNA 表达水平虽然具有升高趋势,但不具有显著差异性,然而细胞周期标志分子Ccnb1 与Ccna2 表达显著增加,Ccnb1 和Ccna2 分别增加80%(Si-NC 组:(1.00±0.05);Si-Apbb1 组:(1.81±0.09),P<0.001,n=3)和76%(Si-NC 组:(1.01 ± 0.22);Si-Apbb1 组:(1.76 ±0.30),P<0.001,P<0.05,n=3),具体见图4A 与图4B。 相较于OE-NC 组,OE-Apbb1 组过表达效率达到119 倍(OE-NC 组:(1.00±0.10);OE-Apbb1 组:(119.33±2.64),P<0.001,n=3);OE-Apbb1 组细胞增殖标志分子Ki67 与细胞周期标志分子Ccnb1 与Ccna2 均发生显著下调,Ki67、Ccnb1 和Ccna2 分别下调25%(OE-NC 组:(1.00±0.03);OE-Apbb1 组:(0.75±0.02),P<0.01,n= 3)、72%(OE-NC 组:(1.00±0.09);OE-Apbb1 组:(0.28±0.03),P<0.001,n=3)和38%(OE-NC 组:(1.00±0.01);OEApbb1 组:(0.62±0.08),P<0.001,n=3),其中另一个增殖标志分子PCNA也呈现下调趋势,但无统计学意义,具体见图4C 与图4D。

注:A:Si-Apbb1 组的敲低效率;B:Si-Apbb1 组的细胞增殖标志物与细胞周期标志物的表达变化;C:OE-Apbb1 组的过表达效率;D:OEApbb1 组细胞增殖标志物与细胞周期标志物的表达变化。 与各自的NC 组相比,∗∗P<0.01,∗∗∗∗P<0.0001。图4 qPCR 实验检测Apbb1 对H9C2 心肌细胞增殖标志物与细胞周期标志物表达的影响Note. A, Knockdown efficiency of Si-Apbb1group. B, Expression changes of cell proliferation markers and cell cycle markers in OE-Apbb1 group. C,Overexpression efficiency of OE-Apbb1 group. D, Expression changes of cell proliferation markers and cell cycle markers in OE-Apbb1 group.Compared with their respective NC group,∗∗P<0.01,∗∗∗∗P<0.0001.Figure 4 qPCR assay was used to detect the effects of Apbb1 on the expression of proliferation and cell cycle markers in H9C2 cardiomyocytes
2.5 细胞免疫荧光法检测Apbb1 对细胞增殖的影响
为了进一步确定Apbb1 对H9c2 心肌细胞增殖的影响,我们采用细胞免疫荧光实验检测了心肌细胞增殖的标志物Aurora B 与PH3。 相较于Si-NC组,Si-Apbb1 组PH3 与Aurora B 阳性细胞增加4.33%(Si-NC 组:(12.00±1.00)%;Si-Apbb1 组:(16.33±1.52)%,P<0.001,n=3)和4.67%(Si-NC组: (14.67 ± 1.53)%; Si-Apbb1 组: (19.33 ±1.53)%,P<0.001,n=3)(图5A~5D)。 相较于OENC 组,PH3 与Aurora B 阳性细胞分别降低3.7%(OE-NC 组:(13.00±1.02)%;OE-Apbb1 组:(9.33±0.58)%,P<0.01,n= 3)和4.36%(OE-NC 组:(14.33±1.15)%;OE-Apbb1 组:(9.67±1.52)%,P<0.05,n=3)(图5E~5H)。
2.6 APBB1 可能通过与KAT5 蛋白互作影响心肌细胞增殖
为了进一步确定Apbb1 调控心肌细胞增殖的机制,我们利用在线数据库String 分析了与大鼠APBB1 蛋白相互作用的蛋白,发现赖氨酸乙酰转移酶5(KAT5)、淀粉样前体蛋白(APP)与淀粉前体样蛋白(Aplp2)等蛋白可能是APBB1 蛋白的互作蛋白,其中KAT5 与APP 蛋白相互作用最强,具体见图6。 KAT5 是一种组蛋白乙酰转移酶,下调KAT5影响前列腺癌细胞、乳腺癌细胞与肝癌等癌细胞增殖[7-9]。 在心肌细胞中,单敲KAT5 能激活心肌细胞细胞周期进而影响心肌细胞增殖[10]。 KAT5 作为APBB1 最为显著的互作蛋白,APBB1 蛋白可能通过与KAT5 蛋白互作抑制心肌细胞增殖。
2.7 qPCR 实验探究与细胞增殖相关的APBB1 互作蛋白的mRNA 表达变化
在APBB1 蛋白的5 个互作蛋白中,APP 能够调控肺腺癌细胞与卵巢癌细胞增殖[11-12];LRP1 能够调控成纤维细胞与内皮细胞增殖[13-14];KAT5 能够调控肝癌细胞与甲状腺癌细胞增殖,并影响心肌细胞周期[10,15-16]。 为了进一步探究APBB1 蛋白能否够通过与其互作蛋白互作进而影响心肌细胞增殖,我们检测了敲低与过表达Apbb1 基因对Kat5、App和Lrp1 的mRNA 表达变化的影响。 相较于Si-NC组,Si-Apbb1 组Kat5 mRNA 表达水平显著降低0.34倍(Si-NC 组:(1.00±0.14);Si-Apbb1 组:(0.66±0.04),P<0.05,n=3),AppmRNA 表达水平显著上调0.18 倍(Si-NC 组:(1.00±0.02);Si-Apbb1 组:(1.17±0.02),P<0.05,n=3),Lrp1 mRNA 表达水平没有发生显著变化,具体见图7A。 相较于OE-NC组,OE-Apbb1 组Kat5 mRNA 表达水平显著升高0.72 倍(OE-NC 组:(1.00±0.13);OE-Apbb1 组:(1.72±0.20),P<0.01,n=3),AppmRNA 表达水平显著下调0.24 倍(OE-NC 组:(1.00±0.10);OEApbb1 组:(0.76 ± 0.05),P< 0.01,n= 3),Lrp1 mRNA 表达水平没有发生显著变化,具体见图7B。Kat5 mRNA 变化趋势与Apbb1 mRNA 的变化趋势一致,APBB1 蛋白可能通过与KAT5 蛋白互作抑制心肌细胞增殖。
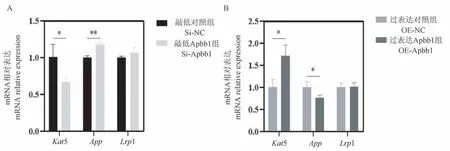
注:A:Si-Apbb1 组与Si-NC 组的Kat5、App 与Lrp1 的表达情况;B:OE-Apbb1 组与OE-NC 组Kat5、App 与Lrp1 的表达情况。与各自的NC 组相比,∗P<0.05,∗∗P<0.01。图7 qPCR 实验检测与细胞增殖相关的APBB1 互作蛋白的mRNA 表达变化Note. A, Expression of Kat5,App and Lrp1 in Si-Apbb1 group and Si-NC group. B,Expression of Kat5,App and Lrp1 in OE-Apbb1 group and OE-NC group. Compared with their respective NC group,∗P<0.05, ∗∗P<0.01.Figure 7 qPCR assay was used to detect the mRNA expression of APBB1 interacting protein associated with cell proliferation
3 讨论
APBB1 蛋白是一种衔接蛋白,目前主要在神经领域被研究[3]。 基于Apbb1 在再生心脏中发生显著降低以及其可作为心脏肥大前期的标志物[5-6],我们试图探究Apbb1 与心肌细胞增殖之间的关系。我们的研究结果表明Apbb1 能够影响H9c2 心肌细胞增殖,敲低Apbb1 基因促进H9c2 心肌细胞增殖,过表达Apbb1 基因抑制H9c2 心肌细胞增殖。 为了进一步了解Apbb1 如何在机制上调控心肌细胞增殖,我们利用在线数据库String 分析了APBB1 的互作蛋白,探究APBB1 能否通过互作蛋白影响心肌细胞增殖。 此外,我们还以细胞增殖这个表型入手,查阅了目前Apbb1 与细胞增殖的相关研究,试图通过了解Apbb1 调控细胞增殖的机制进而明确Apbb1调控H9c2 心肌细胞增殖的具体机制。
目前,关于APBB1 调控细胞增殖的方式主要有3 种可能:第1 种可能是通过调节淀粉样前体蛋白(APP),APP 是APBB1 的经典下游,在阿尔茨海默症的发病中发挥关键作用[17]。 有研究表明APBB1能通过调节APP 进而影响T-47D 和ZR-75-1 乳腺癌细胞增殖[18]。 第2 种可能是通过调节Notch 信号,Kim 等[19]研究表明APBB1 能够对Notch 信号进行双向调控,而Notch 信号是调节脊椎动物与无脊椎动物细胞增殖的关键调节器,大量的研究表明Notch 能够调控心肌细胞增殖[20-23]。 最后一种可能是通过与互作蛋白互作进而影响细胞增殖,Schrötter 等[24]研究表明APBB1 与BLM 和MCM 蛋白的相互作用可能有助于在受阿尔茨海默病影响的大脑中的神经元细胞重新进入细胞周期。 我们的APBB1 互作蛋白网络分析结果表明KAT5、APP与APLP2 等蛋白是APBB1 的互作蛋白,在这些互作蛋白中有研究表明KAT5 蛋白能影响心肌细胞增殖[10]。 我们的qPCR 实验结果表明,App与Apbb1的变化趋势相反,两者之间可能存在负反馈调节。在敲低Apbb1 基因诱导心肌细胞增殖时,Kat5 mRNA 表达显著下调;在过表达Apbb1 基因抑制心肌细胞增殖时,Kat5 mRNA 表达显著上升。 因此,APBB1 有可能通过与KAT5 互作进而影响心肌细胞增殖。 心肌细胞增殖受Notch 信号与APBB1 蛋白互作蛋白KAT5 调控,那么APBB1 能否通过调控Notch 信号或者与KAT5 互作进而影响心肌细胞增殖呢? 这值得我们下一步进行实验探究。
对于某些因素对细胞系增殖影响的实验验证,CCK8 实验是目前常用的验证方式之一。 我们的CCK8 实验结果表明过表达Apbb1 基因能够显著抑制H9c2 心肌细胞增殖,而敲低Apbb1 基因虽然在第48 h 不能表现出促进H9c2 心肌细胞增殖的趋势,但是在第72 h 能显著诱导H9c2 心肌细胞增殖。 这表明siRNA 敲低Apbb1 基因后,可能需要经历较长的时间才能影响H9c2 心肌细胞增殖。
qPCR 实验中,敲低Apbb1 基因能够显著提升Ccnb1 与Ccna2 的表达水平,同时诱导Ki67 与PCNA不显著升高;而过表达Apbb1 基因能够诱导Ki67、Ccnb1 与Ccna2 显著下降,同时诱导PCNA不显著下降。Ki67 与PCNA作为细胞增殖的典型标志分子,为什么敲低Apbb1 基因能够诱导H9c2 心肌细胞增殖却不能诱导这两个分子同时发生显著变化呢? 这可能与这两种标记分子在细胞增殖周期中发挥的作用以及Apbb1 在细胞周期中发挥的作用有关。 一个完整的细胞增殖周期包括G0 期、G1 期、S期、G2 期、M 期。 Ki67 是一种增殖细胞相关的核抗原,其功能与有丝分裂密切相关,主要在有丝分裂期即M 期发挥作用。 PCNA 是一种DNA 聚合酶δ的辅助蛋白,与DNA 合成显著相关,其表达量与DNA 合成一致,在G0/G1 期细胞中表达无明显变化,G1 晚期表达大幅度增加,S 期达到高峰,G2/M期明显下降。 Ccnb1 代表的是G2/M 期转变的周期蛋白,CCNA2 代表的是控制细胞周期G1/S 和G2/M 过渡阶段的周期蛋白。Ki67 与PCNA的表达没有在敲低Apbb1 基因组与过表达Apbb1 基因组同时发生显著变化的原因可能在于Apbb1 主要在H9c2心肌细胞的G2/M 期发挥作用,所以PCNA 无论是在敲低与过表达Apbb1 基因组,变化趋势均不明显;Ki67 在敲低时可能基于Apbb1 本身的表达水平不高没有非常显著的变化,但是过表达119 倍发生显著变化,显著影响H9c2 细胞完成G2/M 期的过渡。
总之,本研究证明敲低Apbb1 基因促进心肌细胞增殖,过表达Apbb1 基因抑制心肌细胞增殖,此结论开拓了Apbb1 基因在心脏领域的功能研究,提示Apbb1 有可能成为诱导心肌细胞增殖的潜在靶点。此外,本研究还利用在线网络数据库String 预测了APBB1 的互作蛋白,qPCR 探究了其互作蛋白随Apbb1 干预的变化,推测APBB1 可能通过与KAT5蛋白互作进而影响心肌细胞增殖,为进一步了解Apbb1 基因调控心肌细胞增殖的机制提供了思路。

