紫芜菁乙醇提取物通过miR-223-3p调节过氧化氢诱导的肺上皮细胞中NF-κB信号通路介导IL-8表达
周芳 陈林 谭小武 曾赛丽 肖玉蓉 邵春
(南华大学衡阳医学院附属第二医院呼吸与危重症医学科,湖南 衡阳 421001)
紫芜菁是十字花科芸薹属芜菁种可食用植物,在新疆是药食两用植物。研究发现,紫芜菁乙醇提取物在体外有较强的抗氧化作用,可改善过氧化氢(H2O2)诱导的人肠上皮Caco-2细胞氧化损伤,抑制炎症因子白细胞介素(IL)-8和IL-1β的分泌〔1〕。研究表明高寒山区芜菁有抑菌作用,新疆芜菁有止咳、平喘、祛痰的药理作用〔2,3〕。紫芜菁乙醇提取物对H2O2诱导肺上皮细胞的作用及其保护机制还不清楚。研究发现miR-223-3p在小鼠肺上皮细胞中表达下调可能与严重肺部炎症相关〔4〕。研究表明,IL-1β通过激活核转录因子(NF)-κB信号途径介导了肺上皮细胞A549分泌炎性因子IL-8〔5〕。本研究假设紫芜菁乙醇提取物可通过miR-223-3p调控肺上皮细胞内NF-κB信号途径介导IL-8表达,影响H2O2诱导的肺上皮细胞的增殖和凋亡。本研究以H2O2诱导的肺上皮细胞A549细胞为模型,以低、中、高3种浓度紫芜菁乙醇提取物处理模型细胞,上调或下调miR-223-3p的表达来检测紫芜菁乙醇提取物对模型细胞增殖和凋亡的影响及机制。
1 材料与方法
1.1材料 人肺上皮细胞A549购自美国ATCC;新鲜紫芜菁购自植物研究所;RPMI1640培养基和胎牛血清(FBS)购自美国Gibco公司,放射免疫沉淀试验(RIPA)细胞裂解液、胰蛋白酶Trypsin、四甲基偶氮唑蓝(MTT)和二甲基亚砜(DMSO)购自美国Sigma-Aldrich公司;细胞周期蛋白(Cyclin)D1抗体、酶切含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3抗体、IL-8抗体、p-IκBα抗体和β-actin抗体购自英国Abcam公司;miR-223-3p模拟物(miR-223-3p)、miR-223-3p抑制物(anti-miR-223-3p)和阴性对照(miR-NC和anti-miR-NC)购自苏州吉玛基因;双染色流式法细胞凋亡检测试剂盒购自美国BD公司;Lipofectamine2000转染试剂购自美国Invitrogen公司;二喹啉甲酸(BCA)蛋白含量检测试剂盒购自江苏凯基生物技术股份有限公司;流式细胞仪购自美国BD公司,实时荧光定量-聚合酶链反应(qRT-PCR)仪购自美国Bio-Rad公司。
1.2方法
1.2.1细胞培养和实验分组〔1〕细胞培养:将A549细胞培养在含10% FBS的RPMI1640培养液,培养液中添加1%青霉素+1%链霉素,置于37℃ 5%CO2培养箱中常规培养,消化传代。紫芜菁乙醇提取物处理:根据文献〔1〕进行紫芜菁乙醇提取物的制备,将可食用部分真空冷冻干燥,粉碎后过60目筛。每100 g芜菁粉用500 ml乙醇浸提6 h然后离心,真空低压蒸发后即制成紫芜菁乙醇提取物,除菌后-80℃保存。
实验分为NC组、H2O2组、50、100、200 μg/ml紫芜菁乙醇提取物+H2O2组、转染物+H2O2组和转染物+紫芜菁乙醇提取物+H2O2组。NC组:为常规培养的A549细胞;H2O2组:用含150 μmol/L H2O2的培养液37 ℃ 条件下诱导培养A549细胞4 h;各剂量紫芜菁乙醇提取物+H2O2组:A549在37℃条件下用H2O2诱导培养4 h,弃培养液,添加含50、100、200 μg/ml紫芜菁乙醇提取物的培养液继续培养24 h;H2O2+转染组:A549用H2O2诱导培养4 h,然后转染miR-223-3p或anti-miR-223-3p;转染物+紫芜菁乙醇提取物+H2O2组:A549用H2O2诱导培养4 h,紫芜菁乙醇提取物200 μg/ml培养24 h,然后转染anti-miR-223-3p。
1.2.2MTT比色法测定细胞存活率 根据1.2.1方法处理A549细胞,收集细胞,以2×103个细胞/孔接种于96孔板中培养48 h,进行MTT实验,每孔加入20 μl MTT溶液,培养4 h,弃去上清培养液,每孔加入150 μl DMSO溶解结晶,室温振荡5 min,酶标仪测定OD490 nm 处的吸光度(A)值。细胞存活率=实验组A值/对照组A值×100%。
1.2.3流式细胞术测定细胞凋亡率 将根据1.2.1方法处理后的各组A549细胞,以每孔2×104个细胞接种于6孔板中,于37℃ 5%CO2培养箱中培养72 h后弃去培养液,用磷酸盐缓冲液(PBS)洗涤2次,胰蛋白酶消化细胞,按凋亡检测试剂盒说明书进行操作,上流式细胞仪测定细胞凋亡率。
1.2.4Western印迹检测蛋白表达 收集根据1.2.1方法处理后的各组A549细胞,用RIPA裂解液重悬细胞,超声破碎后收集蛋白,试剂盒测定总蛋白浓度。将样本进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转聚偏氟乙烯(PVDF)膜,5%脱脂奶粉室温封闭2 h,加入稀释的一抗(CyclinD1抗体1∶2 000、酶切caspase-3抗体1∶1 000、IL-8抗体1∶2 000、p-IκBα抗体1∶1 000和β-actin抗体1∶3 000),4℃孵育过夜,洗膜2次,加入稀释的酶标二抗室温孵育1 h,显影,扫描,以β-actin为内参照,分析蛋白表达水平。
1.2.5细胞转染 待A549细胞培养至细胞融合为一层时,将细胞稀释为1×106个/ml,以每孔200 μl接种于6孔板中,培养至细胞融合度达到80%时按照Lipofectamine2000说明书进行转染。将miR-223-3p、miR-NC、anti-miR-223-3p、anti-miR-NC分别转染入A549 细胞,转染48 h后收集细胞检测miR-223-3p的表达情况,进行后续实验。
1.3统计学方法 采用SPSS19.0软件进行单因素方差分析、t检验。
2 结 果
2.1紫芜菁乙醇提物对H2O2诱导的A549存活率和凋亡的影响 与NC组相比,H2O2组细胞存活率和CyclinD1水平显著降低,凋亡率和酶切caspase-3水平显著升高(均P<0.05);与H2O2组相比,50、100、200 μg/ml紫芜菁乙醇提物+H2O2组细胞存活率和CyclinD1水平显著升高,凋亡率和酶切caspase-3水平显著降低,且呈剂量依赖性(均P<0.05),见表1、图1、图2。

表1 紫芜菁乙醇提物对H2O2诱导的A549存活率和凋亡的影响

1~5:NC组、H2O2组、50 μg/ml紫芜菁乙醇提物+H2O2组、100 μg/ml紫芜菁乙醇提物+H2O2组、200 μg/ml紫芜菁乙醇提物+H2O2组;图2、3同图1 紫芜菁乙醇提取物对H2O2诱导的A549细胞凋亡的影响
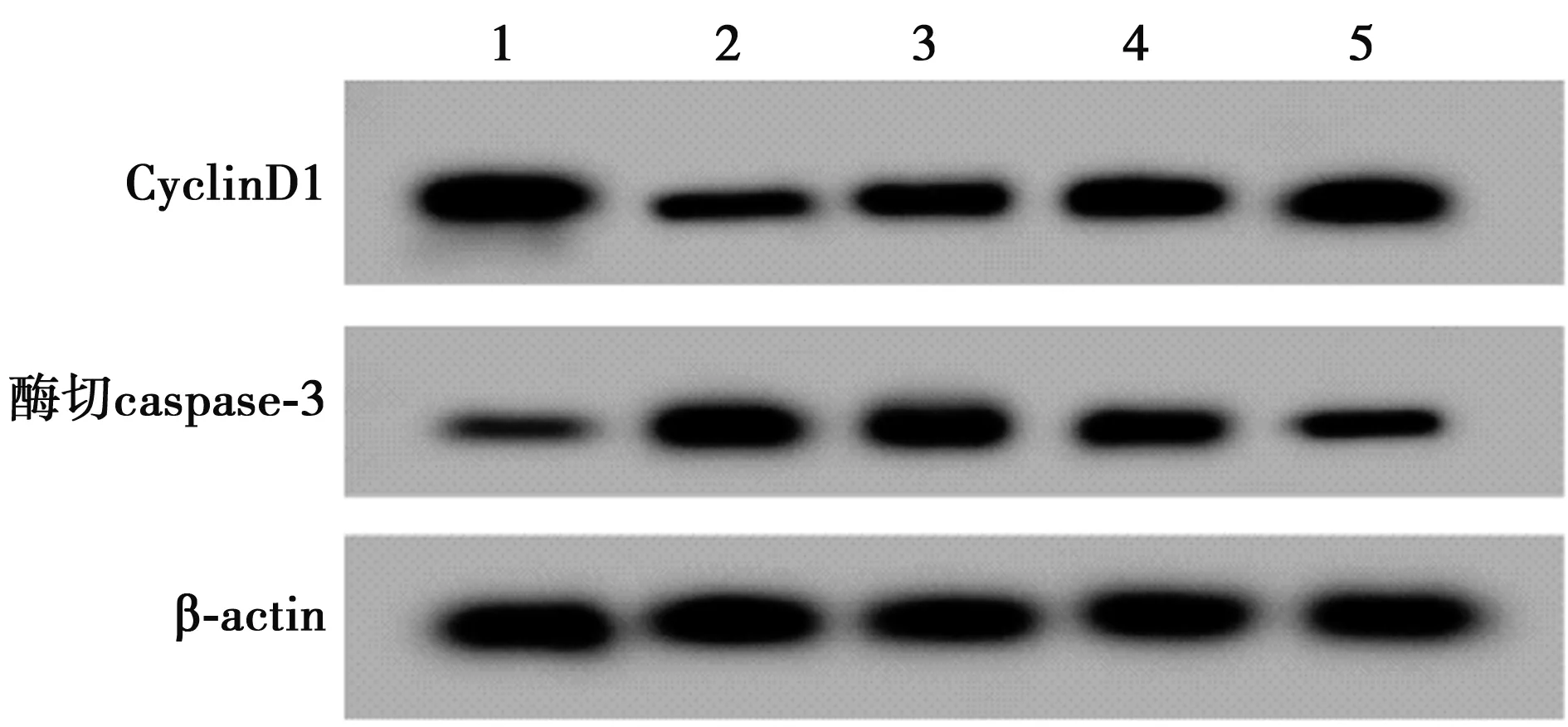
图2 Western印迹检测CyclinD1和酶切caspase-3蛋白表达
2.2紫芜菁乙醇提物对H2O2诱导的A549细胞中IL-8、p-IκBα表达水平 与NC组相比,H2O2组IL-8和p-IκBα水平显著升高(P<0.05);与H2O2组相比,50、100、200 μg/ml紫芜菁乙醇提物+H2O2组IL-8和p-IκBα水平显著降低且呈剂量依赖性(均P<0.05),见图3、表2。选择效果较为明显的200 μg/ml紫芜菁乙醇提取物浓度进行后续实验。
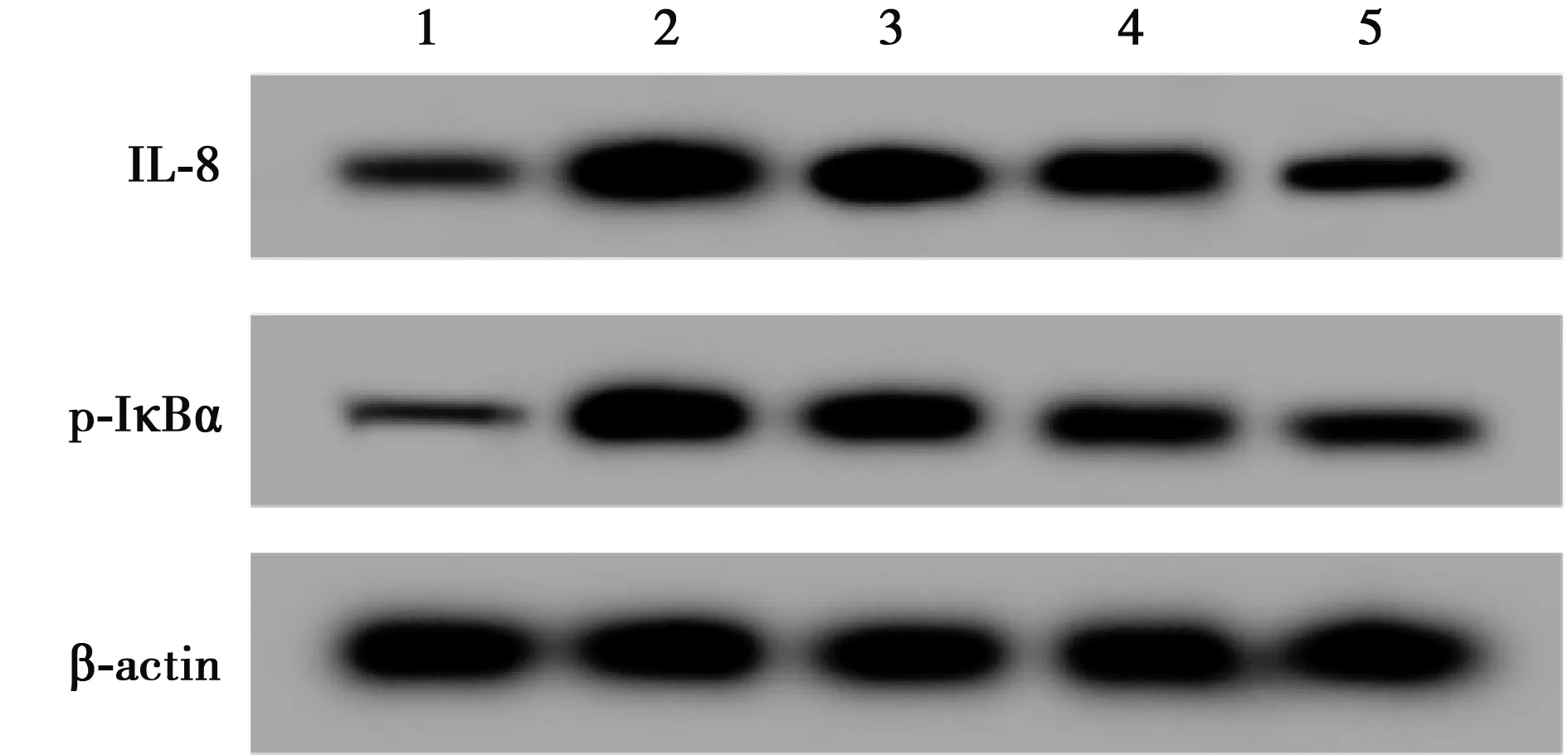
图3 Western印迹检测IL-8 、p-IκBα 蛋白的表达

表2 Western印迹检测IL-8 、p-IκBα 蛋白的 表达
2.3紫芜菁乙醇提物对H2O2诱导的A549细胞中miR-223-3p表达水平的影响 H2O2组A549细胞中miR-223-3p水平(0.40±0.04)显著低于NC组(1.02±0.11,P<0.05);200 μg/ml紫芜菁乙醇提物+H2O2组A549细胞中miR-223-3p含量(0.86±0.09)显著高于H2O2组(P<0.05)。
2.4过表达miR-223-3p对H2O2诱导A549细胞存活率、凋亡和IL-8、p-IκBα表达水平的影响 与miR-NC+H2O2组相比,miR-223-3p+H2O2组A549细胞存活率、miR-223-3p、CyclinD1水平均显著升高,细胞凋亡率、酶切caspase-3、IL-8和p-IκBα水平均显著降低(P<0.05),见表3和图4。说明过表达miR-223-3p可提高细胞存活率,抑制细胞凋亡。

表3 过表达miR-223-3p对H2O2诱导人肺上皮细胞A549存活率、凋亡和IL-8、p-IκBα表达水平的影响

图4 Western印迹检测CyclinD1、酶切caspase-3、 IL-8 、p-IκBα 蛋白的表达
2.5下调miR-223-3p对H2O2诱导A549细胞的存活率、凋亡和IL-8、p-IκBα表达水平的影响 与anti-miR-NC+H2O2组相比,anti-miR-223-3p+H2O2组A549细胞存活率、miR-223-3p、CyclinD1水平均显著降低,细胞凋亡率、酶切caspase-3、IL-8和p-IκBα水平均显著升高(P<0.05),见图5和表4。

图5 Western印迹检测CyclinD1、酶切caspase-3、 IL-8、p-IκBα 蛋白的表达

表4 下调miR-223-3p对H2O2诱导人肺上皮细胞A549的存活率、凋亡和IL-8、p-IκBα表达水平的影响
2.6下调miR-223-3p可以逆转紫芜菁乙醇提物对H2O2诱导A549细胞的存活率、凋亡和IL-8、p-IκBα表达水平的影响 与anti-miR-NC+紫芜菁乙醇提物+H2O2组相比,anti-miR-223-3p+紫芜菁乙醇提物+H2O2组A549细胞存活率、miR-223-3p、CyclinD1水平显著降低,细胞凋亡率、酶切caspase-3、IL-8和p-IκBα 水平显著升高(P<0.05),见表5和图6。说明下调miR-223-3p可逆转紫芜菁乙醇提取物对H2O2诱导A549细胞的存活率、凋亡和IL-8、p-IκBα表达水平的影响。

表5 下调miR-223-3p可以逆转紫芜菁乙醇提物对H2O2诱导人肺上皮细胞A549的存活率、凋亡和 IL-8、p-IκBα表达水平的影响

1~2:anti-miR-NC+紫芜菁乙醇提物+H2O2组、anti-miR-223-3p+紫芜菁乙醇提物+H2O2组图6 Western印迹检测CyclinD1、酶切caspase-3、 IL-8 、p-IκBα 蛋白的表达
3 讨 论
紫芜菁是药食两用的植物,在全国范围内都有种植。研究表明,芜菁的乙醇提取物、正丁醇提取物、水提取物、醚提取物等有止咳平喘〔6〕、降低血糖〔7〕、抗急性低压缺氧损伤〔8〕、抗衰老〔9〕、抗氧化增强机体免疫力〔10〕等作用。本研究结果表明,H2O2抑制A549细胞增殖并促进细胞凋亡,促进Cyclin D1蛋白表达,降低酶切caspase-3蛋白表达;各剂量紫芜菁乙醇提取物均可促进H2O2诱导的A549细胞增殖,并抑制细胞凋亡,200 μg/ml紫芜菁乙醇提取物促增殖效果最好,证实了紫芜菁乙醇提取物对H2O2诱导的A549细胞损伤有保护作用。但其具体机制尚不清楚。
研究显示,miR-223-3p在大鼠肺动脉高压(PAH)中表达下调,miR-223-3p高表达能减轻大鼠肺血管重塑,改善PAH病理特征〔11〕。miR-223-3p在肺鳞状细胞癌(LSCC)组织中表达显著下调,过表达miR-223-3p在体外抑制癌细胞增殖和迁移,在体内可抑制肿瘤生长〔12〕。过表达miR-223-3p在机械通气或金黄色葡萄球菌感染引起的急性肺损伤中起到保护作用,可能通过抑制聚腺苷二磷酸核糖聚合酶(PARP)1抑制急性肺损伤〔4〕。NF-κB信号通路参与肺部炎症例如急性肺损伤、慢性阻塞性肺疾病、肺纤维化等,介导炎性细胞因子的表达〔13〕。IκBα是IκB家族成员之一,IκB是NF-κB信号通路重要蛋白之一,炎症发生后泛素化降解p-IκBα大量增多,持续激活NF-κB信号通路,产生IL-8等炎症因子〔14〕。
综上,紫芜菁乙醇提取物通过上调miR-223-3p的表达,抑制NF-κB信号通路介导产生IL-8,促进H2O2诱导的肺上皮细胞A549增殖并抑制细胞凋亡,达到对A549细胞的保护作用。本研究只进行了体外细胞实验,下一步将从体外动物模型试验方面着手研究紫芜菁乙醇提取物对A549细胞保护作用的具体分子机制,为肺部炎症的临床研究提供更多的数据支持。

