冠心病合并不同程度的慢性肾功能不全患者行冠状动脉旁路移植术的疗效分析
李 扬,侯 琮,候雪见,刘韬帅,许士俊,黄柱辉,董 然
慢性肾脏疾病(chronic renal disease,CKD)的发病率逐年上升[1-2],而在我国估计有超过1亿的CKD患者[3]。大约60%的CKD患者同时伴有冠状动脉粥样硬化性疾病(coronary atherosclerotic disease,CAD。CAD是引起CKD患者死亡的主要原因之一[4-5],而肾脏功能的下降也增加了心血管疾病的发病率、死亡率并降低了远期预后[6]。合并CKD的CAD患者冠状动脉病变更为严重,两种疾病同时存在增加了冠状动脉旁路移植术(coronary artery bypass grafting,CABG)或经皮冠状动脉介入术的手术风险[7]。目前国内尚缺乏大规模的关于合并CKD的CAD患者行CABG长期预后的研究,且针对不同程度肾脏功能的下降是否增加手术风险也尚无定论。本回顾性研究分析了本院CKD中度和重度患者接受CABG的临床疗效和中长期随访结果,旨在改善患者的预后。
1 资料与方法
1.1 资料采集收集2014年1月至2020年6月共850例CAD合并CKD[实验室肾小球滤过率(glomerular filtration rate,eGFR)≤60 ml/(min·1.73m2)]的患者临床资料,包括561例CKD中度[eGFR 30~60 ml/(min·1.73 m2)]患者和289例CKD重度[eGFR<30 ml/(min·1.73 m2)]患者。采集资料包括术前基线资料,术中及术后情况,并且完成随访获取患者的预后结果。术前资料包括基础情况(性别、年龄、体质量指数)、合并症(高血压史、糖尿病史、颈动脉狭窄、吸烟史、心梗史、心衰史、房颤史及脑梗史等)、实验室检查(eGFR、血红蛋白、甘油三酯、胆固醇)及心脏状态(冠脉病变情况、心脏功能等)。
1.2 手术方法CABG的术式包括心脏不停跳CABG(off pump CABG,OPCABG)和体外循环下CABG(on-pump CABG)。所有患者均采用气管插管机械通气,静脉复合麻醉,胸骨正中切口,取乳内动脉、大隐静脉或挠动脉等血管材料备用。OPCABG患者给予肝素1 mg/kg,首先使用心表固定器固定靶血管,行左乳内动脉与左前降支吻合。再行静脉远端与升主动脉吻合(尽量采用无接触技术),最终依次完成其他靶血管的吻合。行on-pump CABG患者给予肝素3 mg/kg,常规建立体外循环后降温至浅低温,阻断升主动脉并灌注停搏液,心脏表面覆盖冰屑,先行吻合桥血管与远端靶血管(每完成一支桥血管都即刻行桥灌注),最后行桥血管与升主动脉吻合。两种术式均使用流量仪测定桥血管流量,对于流量不满意者重新进行吻合。
1.3 随访所有患者术后通过电话或邮件方式进行随访,初级终点事件为全因死亡,次级终点事件包括主要心脑血管事件(main cardiovascular cerebrovascular events,MACCE)、脑卒中、再发心绞痛、再次心肌梗塞、再次住院和再次血运重建治疗。
1.4 统计方法应用SPSS 22.0进行统计分析,两组数据计量资料服从正态分布时,数值以平均数±标准差(±s)表示,并应用t检验;两组数据不服从正态分布时,应用秩和检验,数值以中位数(四分位数间距)表示。计数资料应用卡方检验,用百分数表示,P<0.05差异有统计学意义。
2 结 果
CKD中度患者561例,平均年龄(65.41±8.72)岁,男性患者比例86.5%,CKD重度患者289例,平均年龄(64.27±8.90)岁,术前需要长期透析的患者56例(19.4%),男性患者比例83.4%。CKD重度组患者术前合并陈旧性心梗史(P=0.002)和心衰史(P=0.022)比例高于CKD中度患者,两组患者其余术前合并症、实验室检查、心脏功能、左心室射血分数低于35%的比例及冠状动脉病变情况无统计学差异(P>0.05)。见表1。

表1 两组慢性肾脏疾病患者术前基线资料
CKD中度和重度两组在全部手术中的OPCABG占比、平均吻合桥数、主动脉内球囊反搏(intra-aortic ballon pump,IABP)使用率两组间均无统计学差异(P>0.05)。CKD中度和重度组乳内动脉的使用率、两根以上动脉桥的比例组间均无统计学差异(P>0.05)。两组间总体手术时间、不同手术方式组的手术时间及体外循环时间和主动脉阻断时间同样无统计学差异(P>0.05)。CKD重度组术后新发透析的风险是中度组的2倍,二次开胸止血、围术期心梗和感染的发生率也均高于CKD中度组(P<0.05)。两组间在院死亡率、新发房颤、新发脑梗等的发生率及住院费用均无统计学差(P>0.05)。见表2。
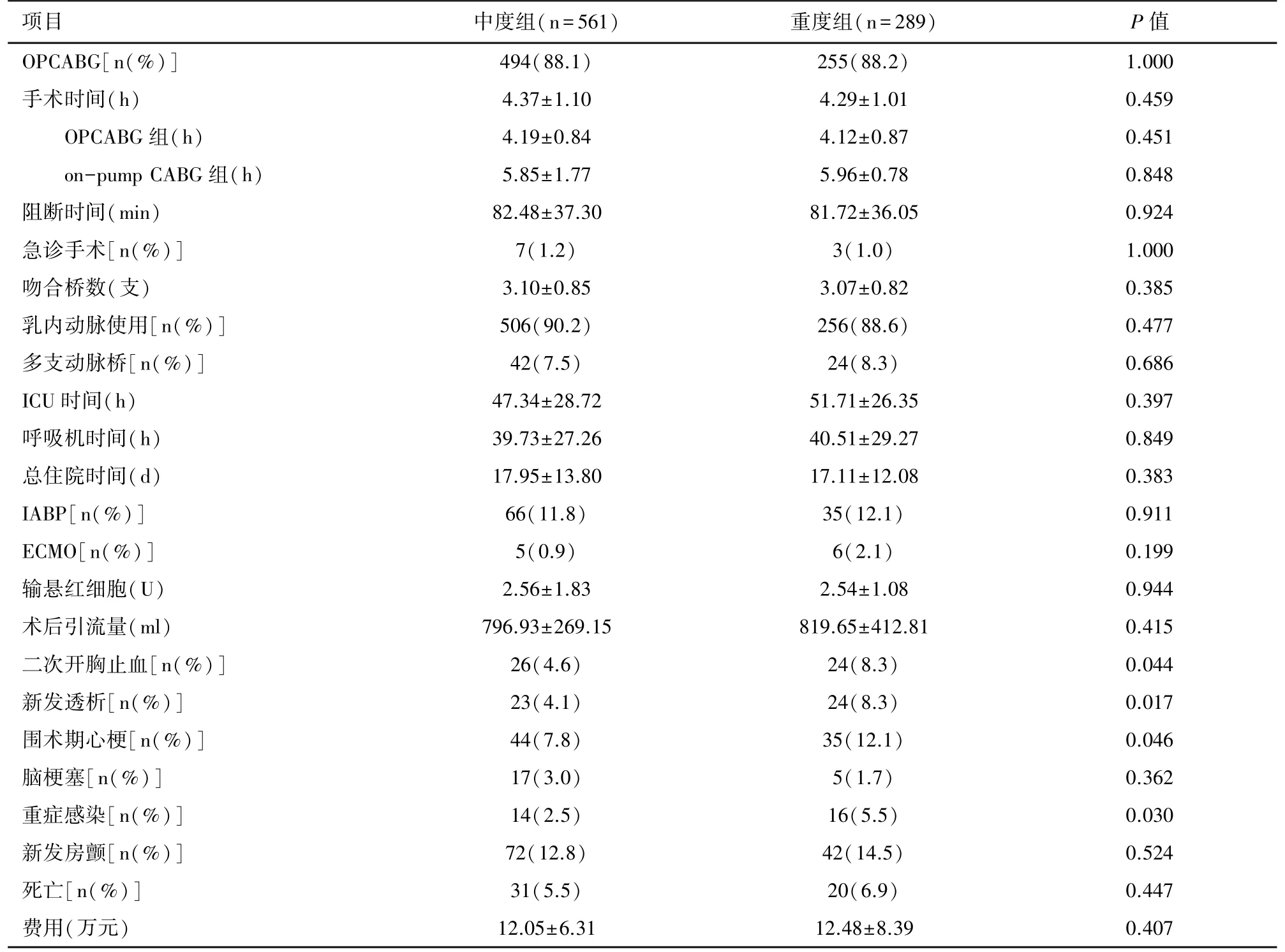
表2 两组慢性肾脏疾病患者术中及术后资料
术后随访742例,随访率为91.8%。中位随访时间4(1~7)年。全因死亡率二组间无统计学差异(P=0.727)。CKD重度组MACCE发生率、再发心绞痛、再次入院及再次血运重建的发生率均高于CKD中度组(P<0.05),两组患者再发脑卒中和再发心梗率无统计学差异(P>0.05)。见表3。
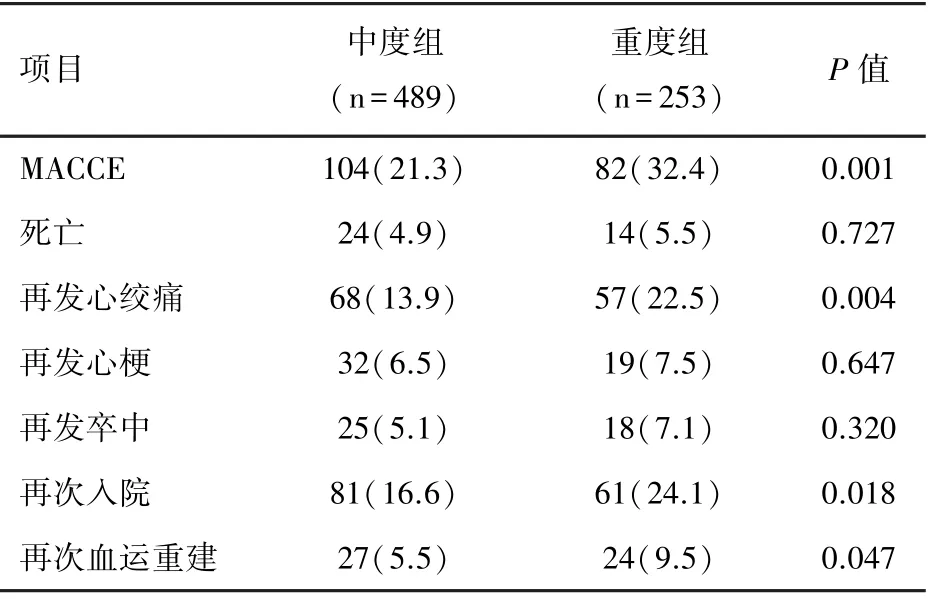
表3 两组慢性肾脏疾病患者随访情况[n(%)]
3 讨 论
CAD与慢性肾脏功能不全常同时存在,CAD也是引起CKD患者死亡最常见的死亡原因之一[8]。根据美国肾脏数据系统统计显示,心源性死亡约占CKD患者死亡原因的45%左右[9]。国外文献报道在一项包括112万人的研究中发现中度以上CKD的患者中,约14.9%的患者合并CAD。对于肾功能不全的CAD患者接受血运重建的风险及预后明显低于肾功能正常的患者[10]。目前世界范围内尚缺乏关于CKD患者血运重建治疗的指南,而关于不同程度肾脏功能下降对CABG手术效果的影响也鲜有报道。
本研究表明CKD重度患者行CABG的手术风险要高于CKD中度患者,主要包括围术期出血、心肌梗塞以及重症感染的风险,而且中远期的预后也低于后者,由于心肌缺血发生再次心绞痛及再次住院行血运重建的比例也较高。这可能是由于CKD重度患者术前心脏基础状态较差,合并心梗史和心衰史的比例较高,对外科手术的耐受性低于CKD中度患者。随着肾功能的下降,外科手术的风险逐渐提高,CKD会加重冠状动脉钙化程度及全身动脉系统病变的严重性和复杂性,增加术后血栓形成、围术期心梗、出血等并发症的风险[11]。然而两组间住院死亡率和长期生存率无差异,ICU治疗时间、住院时间及住院费用也基本相同,说明肾功能重度损害虽然增加了围术期并发症的发生率,但是手术的安全性与中度损害患者相似,也没有增加患者的经济负担。随着外科手术技术的进步、对于肾脏功能关注度的提高以及围术期连续性肾替代治疗的及时应用,都可能降低了手术的死亡率。肾脏功能的下降会增加心脏术后透析的风险,国外报道对于术前eGFR正常、30~60 ml/(min·1.73 m2)和<30 ml/(min·1.73 m2)的患者行CABG术后透析发生的概率分别为0.2%~1.2%、2.1%和14.5%[12]。本研究也同样提示eGFR重度下降患者术后透析风险是中度患者的近2倍,因此围术期选择肾毒性低的药物,减少缩血管药物的使用以及维持有效的肾动脉血流灌注可以减少术后急性肾损伤的发生。
慢性肾功能不全作为CKD患者血运重建术后预后不良的独立危险因素之一,其具体病理生理机制并不明确[13]。除了高血压、糖尿病、高脂血症等危险因素外,还可能与高同型半胱氨酸血症、钙磷代谢紊乱等有关,加重了动脉粥样硬化的进展,增加心血管事件的风险。Bianco[14]报道CKD患者围术期输血的使用、呼吸机通气时间、伤口感染及房颤的风险都高于普通患者。对于终末期肾衰患者,冠状动脉钙化更为严重,并且与肾功能的钙化程度成正相关。Rahmanian发现透析患者心脏手术的死亡风险增高了3.9倍。冠脉钙化可降低冠状动脉的微循环和血管的弹性、并加重左心室肥厚。本研究CKD中度组围术期死亡率为5.5%,CKD重度组死亡率为6.9%,均高于普通CABG患者1%~2%的住院死亡率。
两组患者住院治疗效果及随访结果较为满意,术后4年的生存率达到了95%左右,可能与以下因素有关:首先两组患者术前肝功能、血红蛋白等生化指标基本正常。贫血会导致一系列病理生理变化,引起生活质量和生存率下降[15],而本研究中两组术前的血红蛋白水平分别为(110.67±22.78)g/L和(111.98±22.26)g/L,接近正常。其次,手术方式主要采用OPCABG,避免了体外循环的使用,减少了输血和炎性介质的释放,缩短了呼吸机辅助时间。对于因心功能较差而不能耐受不停跳手术的患者,及时使用IABP和体外循环可以保证完全血运重建和手术的安全。最后,生存率的提高可能与手术人群有关,Rangrass等[16]发现不同种族的人群行CABG治疗后生活质量差异很大,还有研究指出白种人是导致心脏手术死亡的危险因素之一[17]。
本研究不足之处在于样本量较少,随访时间较短,且为单中心回顾性分析结果,缺乏有效的影像学随访检查结果。综上所述,对于合并慢性肾功能不全的冠心病患者,CKD中度和重度患者行CABG的住院死亡率和长期生存率无显著统计学差异,但是CKD中度组围术期并发症的发生率及长期随访MACCE的发生率均低于CKD重度组。重度肾功能下降的患者显著增加了CABG后需要透析治疗的风险。

