不同生境人参茎叶总皂苷对气虚血瘀大鼠的作用比较
娄云云,房庆伟,李 坤,叶 冠
(上海医药集团股份有限公司中央研究院·上海·201203)
气虚血瘀证是中医里面最常见的证候之一,气虚则血运无力,血流淤滞,伴随有自由基积聚、炎症反应、血管内皮损伤、肝肾损伤等,而这些又进一步促进了血瘀的发生,危害性极大[1]。人参为五加科植物人参(Panax ginseng C.A.Mey.)的干燥根及根茎,具有大补元气、复脉固托之功效,为气虚体弱之要药。金洪键等[2]研究发现人参花提取物与同等剂量人参根提取物均能使气虚血瘀模型大鼠的血液流变性明显改善,并且没有统计学差异。目前,人参茎叶和人参花等非药用部位的资源利用还未引起足够的重视,而大量研究表明,人参地上部位具有与传统药用部位相似的化学成分和生物学功能[3]。前期文献调研发现,国内外尚无关于人参茎叶总皂苷对气虚血瘀作用的相关报道。在本文中,我们研究了园参茎叶总皂苷和林下山参茎叶总皂苷对气虚血瘀模型大鼠的治疗作用研究,并通过相关指标的测定,探讨其可能的作用机制。本研究将为后期人参茎叶资源的更好利用提供一定的借鉴依据。
1 材料与仪器
1.1 实验动物
SD大鼠80只,雌雄各半,体重约180~220 g,由常州卡文斯实验动物有限公司提供,实验动物生产许可证:SCXK(苏)2016-0010。
1.2 药物
园参茎叶总皂苷(人参茎叶总皂苷含量77.37%,人参皂苷Rg1、Re、Rd含量之和为34.06%),林下参茎叶总皂苷(人参茎叶总皂苷含量77.07%,人参皂苷Rg1、Re、Rd含量之和为37.46%),均为实验室自制,其制法参考2020版《中国药典》[4]。实验用园参茎叶及林下参茎叶样品经叶冠教授级高级工程师鉴定为五加科植物人参(Panax ginseng C.A.Mey.)的干燥茎叶;盐酸肾上腺素注射液(哈尔滨三马兽药业有限公司,批号:20201002)。
1.3 试剂
肌酸激酶(CK)测定试剂盒、超微量Na+-K+-ATP酶测定试剂盒、一氧化氮(NO)测定试剂盒(购于南京建成生物工程研究所);大鼠肌酸激酶同工酶MB(CK-MB)ELISA试剂盒、大鼠内皮素-1(ET-1)ELISA试剂盒、大鼠血栓素B2(TXB2)ELISA试剂盒(购于江苏雨桐生物科技有限公司)。
1.4 实验仪器
BSA 224S电子天平(德国赛多利斯公司);YF116B型打粉机(瑞安永历制药机械);3K15型高速离心机(德国sigma);MultiskanFC型酶标仪(美国Thermo);全自动血液流变测试仪(北京赛科希德)。
2 实验方法
2.1 动物分组及给药
SD大鼠80只,雌雄各半,随机分为8组:正常组、模型组、园参茎叶总皂苷低(10 mg/kg)、中(20 mg/kg)、高(40 mg/kg)剂量组(YSD、YSZ、YSG)、林下山参茎叶总皂苷低(10 mg/kg)、中(20 mg/kg)、高(40 mg/kg)剂量组(LXD、LXZ、LXG),每组10只。各给药组给予相应药物,正常组及模型组给予等量溶媒。各组动物每天灌胃给药1次,给药体积为10 mL/kg体重。
2.2 模型制备
各给药组大鼠预先连续给药7天,除正常对照组外,其余各组大鼠每日游泳至力竭(以头沉入水中5~10 s为准),连续7天。正常组从实验开始至结束正常饮水、喂食。各组动物在实验第7天下午禁食不禁水12 h,第8天上午,除正常组外,其余各组均皮下注射盐酸肾上腺素注射液(0.1 mL/200 g大鼠)制备气虚血瘀模型,注射1 h后开始取材[5-6]。
2.3 药物制备
园参茎叶总皂苷组:分别精密称取药物14、28、56 mg,用100μL DMSO充分溶解,用生理盐水稀释至14 mL,分别得到低(10 mg/kg)、中(20 mg/kg)、高(40 mg/kg)剂量组。
林下山参茎叶总皂苷组:同园参茎叶总皂苷配制过程。
2.4 检测方法
采血方法:大鼠经1.5%戊巴比妥钠溶液麻醉后自腹主动脉采血约3.0 mL用于血流变学检测,约2.0 mL用于血清生化学指标检测。
血样处理方法:血流变学检测将血液置于枸橼酸钠抗凝管,立即检测;血清生化学指标检测将不经抗凝处理血液3000 r/min离心10 min,取上清液置于-20℃冰箱保存备用。
2.5 统计学方法
所有数据用SPSS 13.0统计软件处理,计数资料组间比较采用t检验分析法,结果以均数±标准差(x±SD)表示,以P<0.05为差异有显著性。
3 结果
3.1 园参茎叶总皂苷与林下山参茎叶总皂苷对气虚血瘀模型大鼠血流变学的影响
与正常组比较,模型组全血黏度(低切、中切、高切)均有明显增加(P<0.01)。与模型组比较,YSD、YSZ、YSG、LXD、LXZ、LXG组全血黏度(低切、中切)均有明显降低(P<0.01);与模型组比较,YSZ、YSG、LXZ、LXG组全血黏度(高切)有明显降低(P<0.01);与模型组比较,YSD、LXD组全血黏度(高切)变化无明显差异。详见表1。
表1 园参茎叶总皂苷与林下山参茎叶总皂苷对气虚血瘀模型大鼠血流变学的影响(n=10,±s)

表1 园参茎叶总皂苷与林下山参茎叶总皂苷对气虚血瘀模型大鼠血流变学的影响(n=10,±s)
注:与模型组比较,**P<0.01;与正常对照组比,△△P<0.01
组别 全血黏度低切(5 s) 中切(50 s) 高切(200 s)正常组 9.46±0.66** 5.36±0.55** 4.26±0.33**模型组 17.55±1.25△△ 8.45±0.65△△ 5.49±0.48△△YSD 14.51±1.45**△△ 7.01±0.29**△△ 5.21±0.24△△YSZ 14.01±1.58**△△ 6.23±0.62**△△ 5.07±0.36*△△YSG 12.85±1.38**△△ 6.10±0.70**△ 4.86±0.48**△△LXD 15.25±1.61**△△ 6.82±0.33**△△ 5.19±0.28△△LXZ 14.71±1.74**△△ 6.35±0.78**△△ 4.96±0.54*△△LXG 11.76±0.96**△△ 6.11±0.59**△△ 4.72±0.60**△
3.2 园参茎叶总皂苷与林下山参茎叶总皂苷对气虚血瘀模型大鼠血清生化指标的影响
模型组较正常组各项指标均有显著性差异(P<0.01);与模型组比较,YSZ、YSG、LXZ、LXG组6项指标均有不同程度升高或降低,且具有统计学意义(P<0.05,P<0.01);与模型组比较,YSD组Na+-K+-ATP酶有所升高(P<0.01);与模型组比较,LXD组Na+-K+-ATP酶有所升高(P<0.05),CK-MB酶有所降低(P<0.05)。详见表2、3。
表2 园参茎叶总皂苷与林下山参茎叶总皂苷对CK、CK-MB、Na+-K+-ATP水平的影响(n=10,±s)

表2 园参茎叶总皂苷与林下山参茎叶总皂苷对CK、CK-MB、Na+-K+-ATP水平的影响(n=10,±s)
注:与模型组比,*P<0.05,**P<0.01;与正常对照组比,△P<0.05,△△P<0.01
组别 CK(U/mL) CK-MB(U/L)Na+-K+-ATP(μmol/mg·h)正常组 0.43±0.17** 26.81±5.60** 9.17±1.70**模型组 0.87±0.21△△ 72.56±11.06△△ 3.92±1.09△△YSD 0.69±0.24△ 65.78±9.47△△ 5.81±1.71**△△YSZ 0.60±0.18**△ 59.72±10.24*△△ 6.41±2.30**△△YSG 0.54±0.21** 55.59±8.10**△△ 6.50±1.78**△△LXD 0.71±0.16△△ 60.56±10.63*△△ 5.60±1.93*△△LXZ 0.61±0.27* 58.47±7.82**△△ 7.10±1.67**△LXG 0.49±0.15** 55.50±10.90**△△ 7.28±1.58**△
表3 园参茎叶总皂苷与林下山参茎叶总皂苷对NO、ET-1、TXB2水平的影响(n=10,±s)
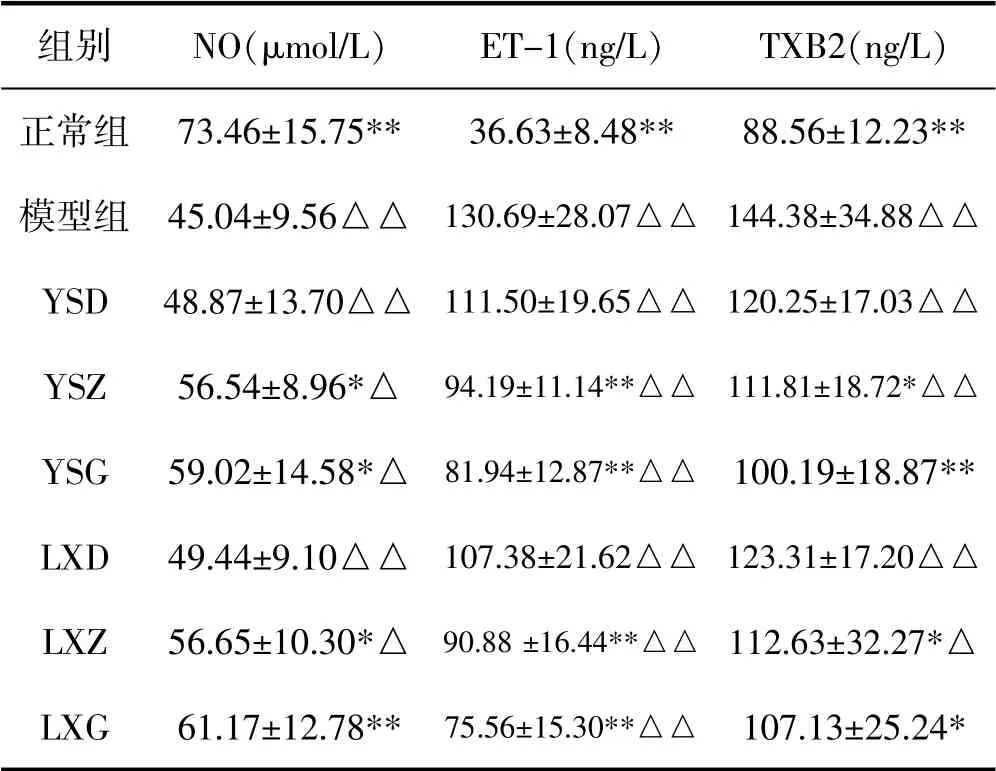
表3 园参茎叶总皂苷与林下山参茎叶总皂苷对NO、ET-1、TXB2水平的影响(n=10,±s)
注:与模型组比,*P<0.05,**P<0.01;与正常对照组比,△P<0.05,△△P<0.01
组别 NO(μmol/L) ET-1(ng/L) TXB2(ng/L)正常组 73.46±15.75** 36.63±8.48** 88.56±12.23**模型组 45.04±9.56△△ 130.69±28.07△△ 144.38±34.88△△YSD 48.87±13.70△△ 111.50±19.65△△ 120.25±17.03△△YSZ 56.54±8.96*△ 94.19±11.14**△△ 111.81±18.72*△△YSG 59.02±14.58*△ 81.94±12.87**△△ 100.19±18.87**LXD 49.44±9.10△△ 107.38±21.62△△ 123.31±17.20△△LXZ 56.65±10.30*△ 90.88±16.44**△△ 112.63±32.27*△LXG 61.17±12.78** 75.56±15.30**△△ 107.13±25.24*
4 讨论
人参茎叶总皂苷是由人参的干燥茎叶经加工制成的皂苷,其中园参茎叶是生产该提取物的主要原料。近年来,随着人参茎叶总皂苷需求的不断增加,导致人参茎叶资源的利用问题进一步放大。本文以两种不同生境的人参茎叶总皂苷为研究对象,发现不同生境人参茎叶总皂苷对于气虚血瘀模型大鼠的改善作用没有显著性差异,这在一定程度上为林下山参茎叶资源的利用提供理论依据。
血液流变学的改变是研究气虚血瘀证的重要指标[7-8]。血液黏度的最大特征是随剪切速率的增加而降低,所以全血黏度就是特定剪切速率下的表观黏度。全血黏度可分为高切、中切和低切黏度,其中高切黏度是指血流较快时的血液黏度,主要反映了红细胞的变形对血流的影响,而低切黏度是指血流缓慢时的血液黏度,主要反映了红细胞凝聚对血流的影响,中切黏度则介于两者之间。如表1所示,模型组较正常组在高切、中切和低切黏度等各指标均具有显著的统计学差异。与模型组比较,给药组可使气虚血瘀模型大鼠的血液黏度得到不同程度的改善。
CK是一种与ATP再生、肌肉收缩、细胞能量转运有直接相关的重要激酶。其中CK的同工酶CKMB在心肌损伤诊断中的特异性更高。当心肌组织损伤严重时,CK-MB被释放到血液中,血清中CK-MB的升高是诊断心肌损伤和急性心肌梗死的重要标准。如表2所示,模型大鼠CK-MB水平明显升高,表明气虚血瘀模型大鼠心肌出现损伤。YSZ、YSG、LXZ、LXG组均可以显著降低CK-MB水平,表明不同生境人参茎叶总皂苷均具有良好的心肌保护作用。Na+-K+-ATP酶是实现Na+和K+的逆电化学梯度跨膜转运的关键酶,对于机体的能量代谢具有重要意义,可在一定程度上作为诊疗气虚状态的指标[9-10]。本研究中模型组大鼠经过游泳力竭联合肾上腺素皮下注射造模后,血清中Na+-K+-ATP酶的活性较正常组显著降低,经不同剂量园参茎叶总皂苷和林下山参茎叶治疗后,Na+-K+-ATP酶的活性均有不同程度的升高。
气虚血瘀证与血管内皮损伤也具有密切的联系,血管内皮细胞通过释放自分泌和旁分泌物质,在维持血管稳态中起着关键作用。张颖智等[7-8]研究发现气虚血瘀模型大鼠表现为NO的表达显著降低,同时ET-1、TXB2的表达显著升高,ET-1/NO比值升高。这种不平衡会导致血管张力增加、炎症反应、氧化应激,最终导致血栓的形成。NO是最重要的血管扩张剂,维持基底血管平滑肌张力和抗动脉粥样硬化。另外,NO还能抑制内皮衍生收缩因子,如ET-1、血管紧张素A和活性氧。TXB2和6-酮-前列腺素F1α(6-keto-PGF1α)分别是血栓素A2(TXA2)和前列环素I2(PGI2)的稳定水解产物。TXA2是一种有效的血小板聚集和血管收缩的诱导剂,而PGI2是一种强大的血管扩张剂,可抑制血小板聚集[11]。花生四烯酸是PGI2和TXA2的前体,其中环氧合酶(COX)在花生四烯酸代谢途径中发挥重要作用,生成PGI2和TXA2[12]。以上研究结果提示气虚血瘀证候可表现为血管收缩和舒张功能的异常,导致血小板聚集、血液黏度增加、血管内皮细胞损伤,进一步引起血液流变学的改变。在此次研究中我们发现,模型组大鼠NO(45.04±9.56μmol/L)的平均值显著低于正常组,而ET-1(130.69±28.07 ng/L)、TXB2(144.38±34.88 ng/L)的平均值显著高于正常组,该结果表明气虚血瘀模型大鼠的成功建立;而园参茎叶总皂苷和林下山参茎叶总皂苷给药组大鼠的三个指标较模型组而言均存在不同程度的升高或降低,并且存在剂量依耐性。其中低剂量组(10 mg/kg)较模型组而言有升高或降低,但是没有显著性差异;而中剂量组(20 mg/kg)和高剂量组(40 mg/kg)较模型组有显著性升高或降低,其中高剂量组的作用优于中剂量组。然而园参茎叶总皂苷和林下山参茎叶总皂苷各等同剂量组比较未见统计学差异。
综上,就气虚血瘀证候而言,同等剂量园参茎叶总皂苷的改善作用与林下山参茎叶总皂苷相当。园参茎叶总皂苷和林下山参茎叶总皂苷均能改善气虚血瘀模型大鼠的血液黏度,其作用机制与保护心肌细胞、保证能量代谢、改善内皮功能等有关。后续我们将进一步对两种不同生境人参茎叶总皂苷进行药效物质基础研究,发掘出针对气虚血瘀证相关疾病的先导化合物,为不同生境人参茎叶资源的开发与利用提供更充分的依据。

