模拟酸雨对20钢腐蚀行为的影响
王战辉,张智芳,闫君芝,常丽娜
(1.榆林学院化学与化工学院,陕西 榆林 719000;2.陕西省低变质煤洁净利用重点实验室,陕西 榆林 719000)
20世纪以来,随着工业的迅速发展和社会经济的持续进步,金属材料已广泛应用于生产和生活的各个领域,在社会发展中起着举足轻重的作用[1]。金属材料与非金属材料相比,具有强度硬度等力学性能高、耐压能力强、耐高温能力强、切削加工能力强、导热导电性能好等优点,越来越受到制造者们的青睐[2]。但是金属材料在使用过程中,会受到自然环境的影响。在众多影响因素中,酸雨的危害性最大,不容忽视。它不仅影响生态系统,而且会对建筑物造成危害,加速材料的老化,特别是金属材料的腐蚀[3]。
酸雨是指pH值小于5.6的降雨或者降雪,是一种危害性极大的大气现象,一般发生在南方,如四川等地。酸雨是随着工业的发展、化石燃料的燃烧和汽车尾气的排放等,向大气中排放了大量的二氧化硫、二氧化碳、二氧化氮等酸性气体,这些酸性气体极易溶解于水,会与空气中的雨水或者雪结合后形成酸性物质沉降于地面,从而对森林树木植被造成大面积破坏。一般酸雨呈酸性,酸雨不仅破坏了生态环境,而且加剧了金属的腐蚀。1999年,全球酸雨腐蚀造成的经济损失达200亿美元,中国酸雨腐蚀造成的经济损失达30亿美元。因此,研究金属材料在酸雨环境中的腐蚀行为具有十分重要的意义[4-6]。
20钢由于其适中的强度硬度,良好的塑性、韧性和可焊性,在现代工业中应用极为广泛,对工业发展至关重要,但它又深受酸雨的影响。因此,研究20钢在酸雨环境中的腐蚀规律,探究腐蚀发生的原因并采取有效的防止腐蚀的措施,对于延长设备寿命、降低成本、提高劳动生产率无疑具有十分重要的意义[7-11]。国内外学者对腐蚀已进行了大量研究,但是对20钢在模拟酸雨中的研究较少。因此,以20钢为研究对象,借助CS系列电化学工作站,首先考察了其极化曲线特点;其次,通过改变模拟酸雨pH值、阴离子和浸泡时间,考察其对电化学腐蚀参数和腐蚀速率的影响,所得结论对20钢的腐蚀与防护具有重要意义。
1 实验过程
1.1 模拟酸雨的配制
模拟酸雨的组成成分如表1所列。根据表1配置模拟酸雨溶液,并用浓硫酸将配置好的溶液pH值调节至5,即为空白模拟酸雨溶液。

表1 模拟酸雨的组成成分Table 1 Composition of simulated acid rain mg/L
1.2 除锈液的配制
用去离子水、纯HCl和六次甲基四胺配制除锈液。取3.5 g六次甲基四胺放入烧杯中,然后依次加入500 mL HCl,500 mL水,搅拌均匀,即完成除锈液的配制。
1.3 工作电极
选用 20钢为工作电极材料,其含碳质量分数为0.2%,属于优质碳素结构钢。抗拉强度σb为410 MPa,屈服强度σs为245 MPa,20钢试件研究的电极面积为0.84 cm2。
2 实验结果与讨论
2.1 极化曲线
保持模拟酸雨浸泡时间为2 h,通过浓硫酸将模拟酸雨pH值调节为4,考察模拟酸雨中20钢极化曲线如图1所示。由图1可知,阴极极化率大于阳极极化率,属于阴极控制过程,腐蚀速率主要受阴极过程的影响。

图1 极化曲线Fig.1 Polarization curve
2.2 不同pH值对20钢腐蚀行为的影响
保持模拟酸雨浸泡时间为2 h,通过浓硫酸将模拟酸雨pH值分别调节为1、2、3、4、5,考察20钢在不同pH值模拟酸雨溶液腐蚀参数(见表2)下,酸雨pH值对20钢腐蚀速率的影响,如图2所示。由表2和图2可以看出,阴极极化率大于阳极极化率,属于阴极控制过程。腐蚀电流密度是表示腐蚀速率的重要参数,腐蚀电流密度越大,腐蚀速率越大。随着模拟酸雨pH值的增加,腐蚀电流密度逐渐减小,腐蚀速率呈减小的趋势,临界点pH值=3,即pH值<3时,腐蚀速率下降速度快;pH值>3时,腐蚀速率下降速度慢。这是由于一方面,20钢在模拟酸雨中的电化学行为为阴极控制过程,随着模拟酸雨pH值的增加,模拟酸雨中氢离子浓度减小,到达阴极的氢离子浓度减小,阴极去极化反应程度减小,腐蚀速率减小;另一方面,pH值对腐蚀产物硫化铁膜的组成部分以及溶解度均有重要影响,当pH值较低时,腐蚀产物是含硫量比较少的硫化铁Fe9S8为主要成分的膜,这种类型的膜对母材金属没有保护作用,因此,pH值较低时,腐蚀速率大;当pH值较高时,腐蚀产物是含硫量比较多的硫化铁FeS2为主要成分的膜,这种类型的膜对母材金属有很强的保护作用,能够使母材金属免受外界因素的影响。因此,pH值较低时,腐蚀速率小;pH值=3时,这2种膜均达到饱和状态,即当pH值<3时,腐蚀产物主要是含硫量比较少的硫化铁Fe9S8为主要成分的膜;当pH值>3时,腐蚀产物主要是含硫量比较多的硫化铁FeS2为主要成分的膜。
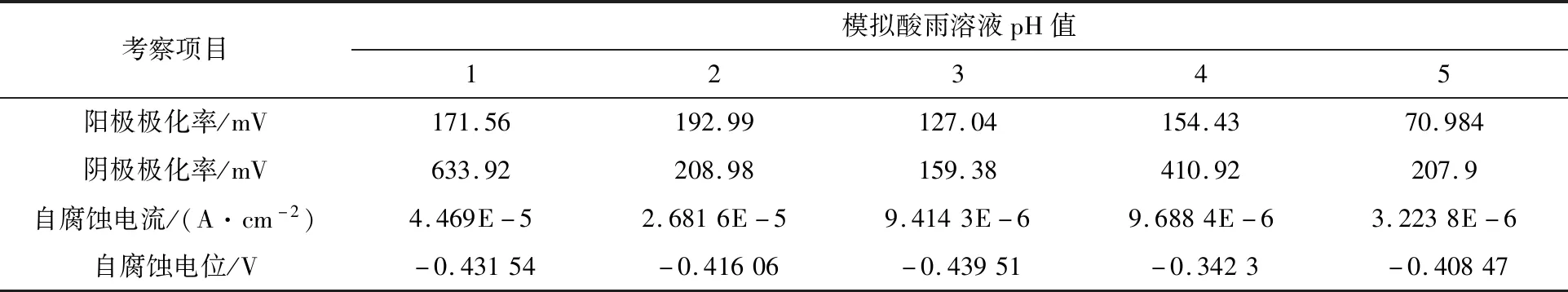
表2 不同pH值模拟酸雨溶液腐蚀参数Table 2 Corrosion parameters of simulated acid rain solution with different pH values
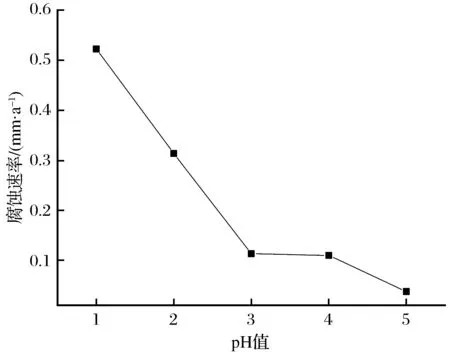
图2 不同pH值对20钢腐蚀速率的影响Fig.2 Effect of different pH value on corrosion velocity of 20 steel
2.3 不同阴离子对20钢腐蚀行为的影响

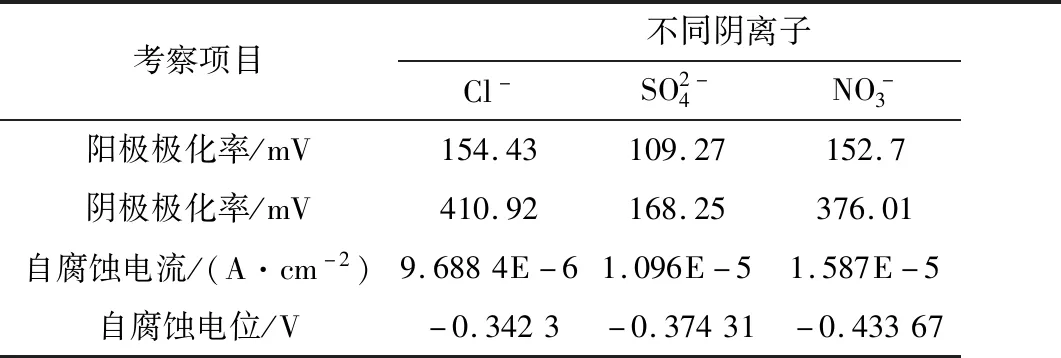
表3 不同阴离子模拟酸雨溶液腐蚀参数Table 3 Corrosion parameters of in simulated acid rain solution with different concentrations
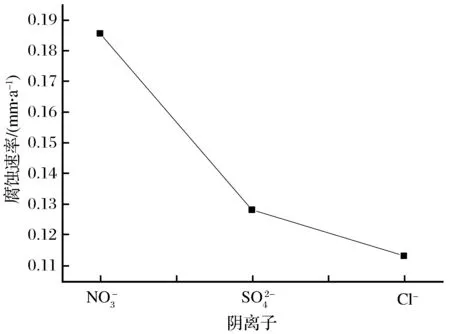
图3 不同阴离子对20钢腐蚀速率的影响Fig.3 Effect of different anion concentration on corrosion velocity of 20 steel
2.4 不同浸泡时间对20钢腐蚀行为的影响
保持模拟酸雨pH值=5,浸泡时间分别为2 h、4 h、6 h、8 h、10 h,考察20钢在模拟酸雨溶液中不同浸泡时长腐蚀参数(见表4)下,不同浸泡时间对20钢腐蚀速率的影响,如图4所示。由表4和图4可知,阴极极化率均大于阳极极化率,属于阴极控制过程,随着浸泡时间的增加,腐蚀电流密度逐渐减小,腐蚀速率呈减小的趋势,临界值为8 h,即当浸泡时间小于8 h时,腐蚀速率下降较快,当浸泡时间大于8 h时,腐蚀速率基本维持不变。这是由于一方面,当pH值=5时,腐蚀产物是含硫量比较多的硫化铁FeS2为主要成分的膜,浸泡时间越长,20钢表面生成的硫化铁FeS2腐蚀产物越多,硫化铁FeS2形成硫化铁膜越厚,对内部金属的保护作用越强,能更加有效地降低20钢内部金属的腐蚀速率。因此,随着浸泡时间的增加,腐蚀速率呈减小的趋势;当浸泡时间大于8 h后,含硫量比较少的硫化铁Fe9S8为主要成分的膜和含硫量比较多的硫化铁FeS2为主要成分的膜基本呈饱和状态,腐蚀速率维持不变。
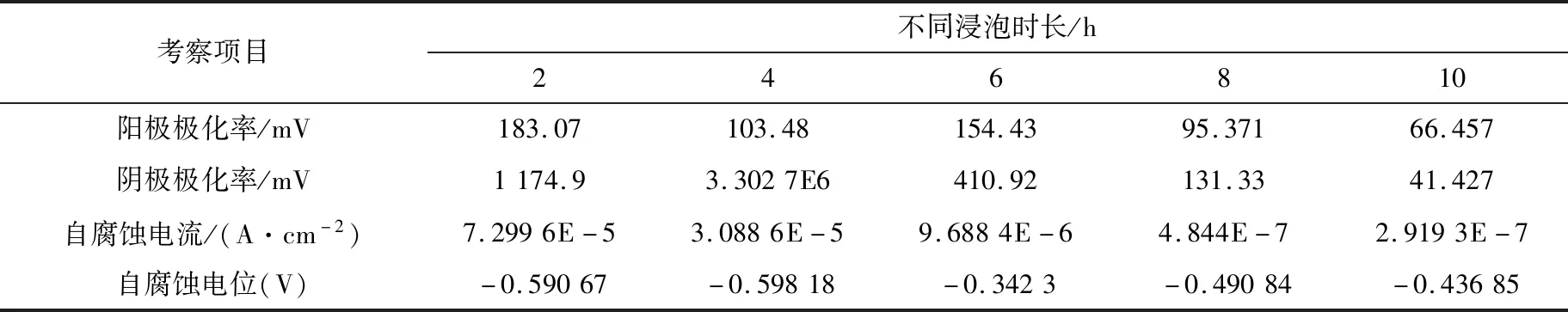
表4 模拟酸雨溶液中不同浸泡时长腐蚀参数Table 4 Different corrosion parameters of immersed in simulated acid rain solution

图4 不同浸泡时间对20钢腐蚀速率的影响Fig.4 Effect of different soaking time on corrosion velocity of 20 steel
3 结论
以20钢为研究对象,借助CS系列电化学工作站,首先考察了其极化曲线特点;其次通过改变模拟酸雨pH值、阴离子和浸泡时间,考察其对电化学腐蚀参数和腐蚀速率的影响,得到的规律如下:
(1) 阴极极化率大于阳极极化率,属于阴极控制过程,腐蚀速率主要受阴极过程的影响。
(2) 随着模拟酸雨pH值的增加,腐蚀电流密度逐渐减小,腐蚀速率呈减小的趋势,临界点pH值为3。

(4) 随着浸泡时间的增加,腐蚀电流密度逐渐减小,腐蚀速率呈减小的趋势,临界值为8 h。

