NaCl胁迫下不同耐盐型结缕草根系Ca2+和H+流动及Ca2+分布特征
叶 刚, 杨 静, 李晓慧, 郝东利, 沈泽宇, 郑荣佳, 陈静波, 郭海林,①
〔1. 江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014; 2. 南京林业大学, 江苏 南京 210037〕
结缕草属(ZoysiaWilld.)为禾本科(Poaceae)多年生草本植物,是世界公认的优良暖季型草坪草。该属植物具有双细胞盐腺,为泌盐植物,其中,大穗结缕草(Z.macrostachyaFranch. et Sav.)、结缕草(Z.japonicaSteud.)和沟叶结缕草〔Z.matrella(Linn.) Merr.〕被确定为盐生植物[1]。另外,结缕草属植物有非常发达的根状茎和匍匐茎,因而结缕草属植物抗逆性强,如抗寒、抗旱、耐盐碱和病虫害较少,在低水平养护下亦有不俗的表现,被广泛应用于观赏草坪、休憩草坪、运动草坪以及保土草坪。结缕草属植物作为盐碱地生态改良和园林绿化的备选草种之一,具有非常强的优越性,研究结缕草属植物的耐盐性对于加速耐盐草坪草的育种进程具有非常重要的意义。
Ca2+是植物生长发育所必需的营养元素之一,参与种子的萌发、生长分化、形态建成,以及花粉管的生长和伸长等开花结果的全过程[2]。同时作为第二信使,Ca2+在高等植物多种信号传递过程中也发挥着重要作用,可以传递外界刺激,引起下游信号物质的响应。研究结果[3]表明:Ca2+可以维持质膜结构的稳定进而提高植物的抗逆境能力。H+对植物来说同样不可或缺,可以维持质膜内正外负的膜电位稳态,而H+转运体是一种在膜上以多种形式存在的转运蛋白,如Na+/H+逆向转运体、Ca2+/H+逆向转运体和H+-ATP酶等[4]。细胞质膜的去极化与超极化均能激活Ca2+通道向胞内转运Ca2+,通过Ca2+-H+逆向转运体或Ca2+-ATPase向胞外转运Ca2+,使细胞内外产生Ca2+浓度差,启动Ca2+信号途径[5],进而触发下游的抗性反应[6]。NaCl胁迫下,大量的Na+和Cl-进入细胞,打破植物体内离子平衡,引起K、Ca和H等营养元素含量下降,细胞质中游离的Ca2+也急剧下降,从而引起Ca2+介导的钙调蛋白调节系统和磷酸肌醇调节系统失调,最终造成植物细胞代谢紊乱甚至死亡[7]。
鉴于Ca2+和H+在植物耐盐调控中的重要性,本研究利用非损伤微测技术(NMT)检测了不同耐盐型结缕草经200 mmol·L-1NaCl处理24 h后其根系不同根区的Ca2+和H+流变化,并运用X射线能谱仪检测根系横切面的Ca2+分布情况,判断这2个离子与其耐盐性是否存在关联,进而揭示NaCl胁迫下结缕草根系Ca2+和H+的调控机制,为结缕草属植物遗传改良和优质耐盐新品种的选育奠定基础。
1 材料和方法
1.1 材料
以耐盐结缕草(编号Z011和Z015)和敏盐结缕草(编号Z004和Z103)为试验材料,其中,Z011、Z015和Z004为1995年分别从浙江兰溪(东经119°30′、北纬29°13′)、浙江杭州(东经120°12′、北纬30°20′)和江西庐山(东经116°00′、北纬28°36′)采集的结缕草野生种质资源,Z103为1999年从河南信阳(东经114°08′、北纬31°52′)采集的结缕草野生种质资源。4个材料现种植于江苏省中国科学院植物研究所苗圃(东经118°28′、北纬32°02′,海拔30~40 m)。应用前期已建立的耐盐性鉴定方法,通过水培法对试验材料进行培养[8]。于2021年6月至8月,取供试4个材料的匍匐茎(含第2和第3节),用海绵包裹后扦插在打好孔的泡沫板上,将泡沫板放在黑色周转箱(长56.5 cm、宽36.5 cm、高11.0 cm)中,箱中加入1/2 Hogland营养液,置于塑料大棚内进行培养,培养期间不间断通气,每隔3 d换1次营养液。共6个周转箱,每个材料288份。
1.2 方法
1.2.1 根系Ca2+和H+流测定 用NMT100S-IM-YG非损伤微测系统(美国Younger公司)测定NaCl胁迫下不同耐盐型结缕草根系Ca2+和H+稳态离子流。
1.2.1.1 离子选择性微电极制备 在CX23显微镜(南京娇子藤科学器材有限公司)下,将相应的电解液(Ca2+电极:灌充液含100 mmol·L-1CaCl2;H+电极:灌充液含15 mmol·L-1NaCl和40 mmol·L-1KH2PO4,pH 7.0)灌充到微电极中,将液态离子交换剂XY-SJ-Ca和XY-SJ-H(美国Younger公司)灌充至电极的尖端,灌充约40~50 μm。
1.2.1.2 校正 在使用之前对离子选择性微电极进行校正。Ca2+校正液为0.5、1.0和5.0 mmol·L-1CaCl2;H+校正液为pH 5.0、pH 6.0和pH 7.0的蒸馏水(用MES和Tris溶液调pH值)。
1.2.1.3 测定 按照Newman[9]的方法测试Ca2+和H+流。材料培养10 d后,选取2箱长势基本一致的材料,一箱作为对照,另一箱以200 mmol·L-1NaCl进行处理,24 h后取根尖完整、长势基本一致的新鲜嫩根(3 cm),用测试液(0.1 mmol·L-1MgCl2、150 mmol·L-1NaCl、0.5 mmol·L-1KCl和0.1 mmol·L-1CaCl2, pH 5.7)冲洗4或5遍,然后在测试液中平衡10 min。将根尖用镊子夹起,放于直径50 mm透明培养皿中,用无菌滤纸和树脂块固定,加入10 mL测试液,之后进行离子流的测定。稳态离子流测定位点分别为根尖分生区(距根尖0.3~0.5 mm处)、伸长区(距根尖1.5~2.5 mm处)和成熟区(距根尖10.0~15.0 mm处),每个材料的不同处理至少检测6个嫩根。每个位点检测5~10 min,选其中3 min稳定有效的离子流速数据(净流速)用于分析,并基于Ca2+净流速和H+净流速计算平均Ca2+流速和平均H+流速。
1.2.2 根系横切面Ca2+分布测定 用GENESIS X射线能谱仪(美国EDAX公司)检测根系横切面的Ca2+分布情况。待全部材料长出成熟根系后(约2个月),选取长势基本一致的材料,以200 mmol·L-1NaCl进行处理,在处理的0(对照)、1、6和20 d时取其根系(距根尖3~4 cm的根段),切成长约0.5 cm的小段,用滤纸包裹后迅速投入液氮中固定,然后在BYK-FD2A冷冻真空干燥机(北京中西华大科技有限公司)中脱水。干燥样品粘在样品台上进行离子溅射镀金,再用Hitachi FE-SEM 5000扫描电子显微镜(日本Hitachi公司)联合X射线能谱仪对其横切面同时做点、线、面扫描,对其中Ca2+的分布进行分析。每个处理检测3个根段,做点扫描时将根段分为表皮、皮层和中柱3个区域,每个区域检测3或4个点。根据文献[10]中的方法计算Ca2+相对含量(Ca占全部检测元素Na、K、Ca和Cl的原子百分比)。
1.3 数据统计分析
用Mageflux软件(http:∥youngerusa.com)计算离子流速。负值表示离子内流,正值表示离子外排。用EXCEL 2019和SPSS 26.0软件剔除获得数据中的异常值,并用EXCEL 2019软件进行数据整理和作图,用SPSS 26.0软件进行单因素方差分析(one-way ANOVA,α=0.05)和差异显著性比较(Duncan法)。
2 结果和分析
2.1 NaCl胁迫下不同耐盐型结缕草不同根区的Ca2+流变化
NaCl胁迫下不同耐盐型结缕草3个根区的Ca2+流变化见图1,平均Ca2+流速见表1。结果显示:对照组,4个结缕草材料根尖分生区、伸长区和成熟区Ca2+均以外排为主,敏盐结缕草Z103 3个根区Ca2+有部分测试点显示为内流(图1-A1,B1,C1);同一材料根尖分生区平均Ca2+流速明显高于伸长区和成熟区,不同材料间在根尖伸长区和成熟区无明显差异,但在分生区,耐盐结缕草Z011和Z015的平均Ca2+流速(分别为79.85和63.79 pmol·cm-2·s-1)明显高于敏盐结缕草Z004和Z103(分别为24.42和28.43 pmol·cm-2·s-1)。200 mmol·L-1NaCl处理组,总体上看,耐盐结缕草Z011和Z015 3个根区Ca2+由外排变为内流,敏盐结缕草Z004和Z103根系成熟区的Ca2+由外排变为内流,而分生区和伸长区Ca2+外排减弱或变为内流(图1-A2,B2,C2);同一材料3个根区平均Ca2+流速无明显差异,但与对照组差异明显,且耐盐结缕草Z011和Z015 3个根区平均Ca2+流速与敏盐结缕草Z004和Z103无明显差异。
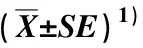
表1 NaCl胁迫下不同耐盐型结缕草3个根区的平均Ca2+流速
总体上看,NaCl胁迫下不同耐盐型结缕草的Ca2+由外排变为内流或外排减弱,耐盐结缕草较敏盐结缕草有更强的Ca2+调控能力,分生区为Ca2+参与NaCl胁迫下离子平衡的关键调控区域。
2.2 NaCl胁迫下不同耐盐型结缕草根系不同根区的H+流变化
NaCl胁迫下不同耐盐型结缕草3个根区的H+流变化见图2,平均H+流速见表2。结果显示:对照组,耐盐结缕草Z011根尖分生区、伸长区和成熟区的H+均为内流,其他3个材料3个根区的H+为微弱内流或外排(图2-A1,B1,C1),且这3个材料3个根区的平均H+流速与Z011差异明显。200 mmol·L-1NaCl处理组,耐盐结缕草Z011 3个根区H+内流均明显减弱,其他3个材料3个根区H+的内流或外排也有不同程度的减弱,但差异不明显(图2-A2,B2,C2);耐盐结缕草Z011 3个根区平均H+流速与对照组有明显差异,其他3个材料各根区平均H+流速与对照组无明显差异,且耐盐结缕草Z011和Z015 3个根区平均H+流速与敏盐结缕草Z004和Z103无明显差异。由此推断,耐盐结缕草Z011与其他3个材料可能具有不同的H+调控机制,但耐盐材料与敏盐材料在H+调控方面没有规律性差异。

: Z011; : Z015; : Z004; : Z103.
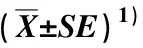
表2 NaCl胁迫下不同耐盐型结缕草3个根区的平均H+流速
2.3 NaCl胁迫下不同耐盐型结缕草根系不同组织中Ca2+分布
为了进一步了解不同耐盐型结缕草根系是否对Ca2+存在区隔作用,从点、线和面3个层次对NaCl胁迫下根系表皮、皮层和中柱中Ca2+的分布情况进行测定,点扫描结果见表3,线和面扫描结果见图3。
点扫描结果显示:总体上看,与对照(处理 0 d)相比,200 mmol·L-1NaCl处理后4个结缕草材料根系不同组织中Ca2+相对含量显著(P<0.05)降低,且随着处理时间的延长表现为先降低再升高的趋势;与其他3个材料相比,敏盐结缕草Z103中Ca2+相对含量较低,且在处理20 d时表皮和皮层中Ca2+相对含量恢复到与对照无显著差异,中柱中Ca2+相对含量显著高于对照。随着处理时间延长,耐盐结缕草Z015根系表皮中Ca2+相对含量在处理6 d达最高值(14.75%),而其皮层和中柱以及耐盐结缕草Z011和敏盐结缕草Z004根系不同组织中Ca2+相对含量在处理20 d较处理1和6 d略有升高。在处理0 d,耐盐材料Z015根系不同组织中Ca2+相对含量从表皮、皮层到中柱表现为逐渐升高的趋势,其他3个材料则表现为逐渐降低的趋势,根系皮层和中柱中Ca2+相对含量总体显著低于表皮,但在皮层和中柱间无显著差异;经200 mmol·L-1NaCl处理1和6 d,4个材料根系不同组织中Ca2+相对含量从表皮、皮层到中柱均表现为逐渐降低的趋势,根系皮层和中柱中Ca2+相对含量总体显著低于表皮,但在皮层和中柱间总体无显著差异;在处理20 d,不同材料根系表皮、皮层和中柱中Ca2+相对含量的变化趋势存在差异,但在皮层和中柱间无显著差异。在对照和NaCl胁迫下,4个结缕草材料不同组织中Ca2+相对含量未表现出与耐盐性有关的规律变化。
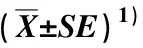
表3 NaCl胁迫下不同耐盐型结缕草根系表皮、皮层和中柱中Ca2+相对含量
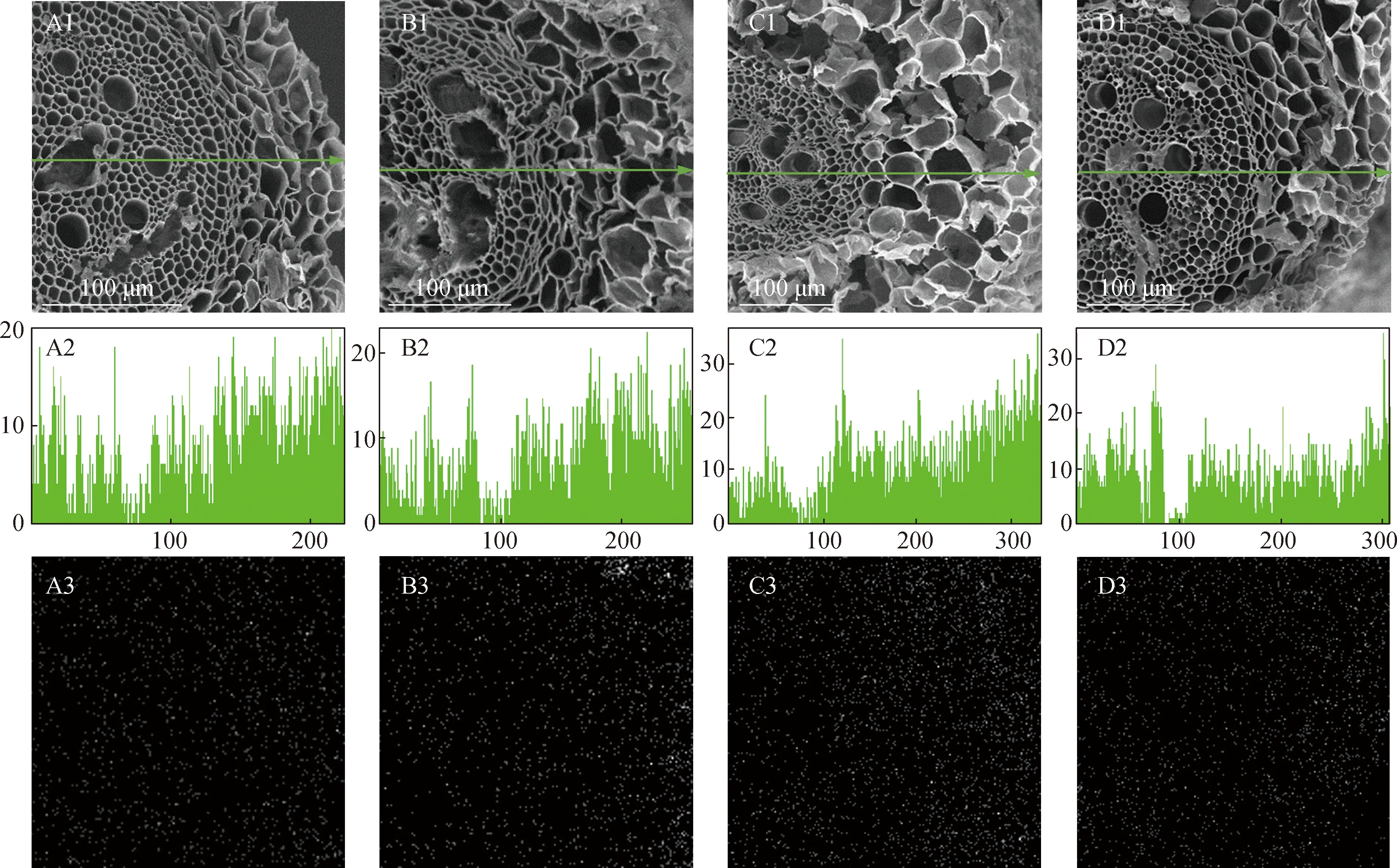
A,B,C,D: 分别为Z011、Z015、Z004和Z103的根系Roots of Z011, Z015, Z004 and Z103, respectively. 1: 根系横切面(箭头表示线扫描路径)Transection of root (arrow represents the line scanning path); 2: 根系横切面线扫描图,y轴表示探测器接收和处理的X射线数量(主要代表根细胞表面元素的强度),x轴表示对应上述箭头的扫描位置Line scanning picture of transection of root, y-axis indicates the number of X-rays received and processed by the detector (mainly representing the strength of element on the surface of root cell), and x-axis indicates the scanning location corresponding to the arrow above (μm); 3: 根系横切面面扫描图,越亮的区域说明Ca2+含量越高Plane scanning picture of transection of root, and the brighter the area, the higher Ca2+ content.
线和面扫描结果显示:Ca2+在结缕草根系表皮、皮层和中柱中的分布无明显差异,表明结缕草根系对Ca2+没有区隔作用或区隔不明显。
3 讨论和结论
植物叶片中Ca2+以果胶酸钙形式组成细胞壁的胞间层,对细胞壁和细胞膜的形成、细胞壁木质化、细胞壁的弹性等均有重要影响,对保持植物细胞膜的完整性和选择性也具有重要作用[11]。研究发现,胞内Ca2+水平作为植物信号传导中的第二信使,与脱落酸(ABA)和活性氧物质(ROS)等一起参与植物抗逆性的信号传递和表达,与植物的耐盐性能力有重要关联[12]。高盐环境下,植物最先感受到胁迫的部位是根系,而不同根系区域的离子交换存在空间变异性,即根系离子流在不同结构区域的变化较大:如木本植物沙枣(ElaeagnusangustifoliaLinn.)[13]、胡杨(PopuluseuphraticaOliv.)和群众杨(PopuluspopularisChon-Lin)[14]根尖分生区的K+、Na+、H+流速显著高于成熟区;盐胁迫下大豆〔Glycinemax(Linn.) Merr.〕根尖分生区的H+流速也显著高于其他区域[15];而甘蓝型油菜(BrassicanapusLinn.)根尖伸长区的Ca2+流速最高,成熟区最低[16];农作物大麦(HordeumvulgareLinn.)[17,18]和小麦(TriticumaestivumLinn.)[19]根尖成熟区的K+外排速率显著高于其他区域。由此可见,在盐胁迫下不同植物根系不同区域的离子流变化存在较大差异。
3.1 结缕草不同根区的Ca2+流变化
盐胁迫下,植物根系会吸收过多的Na+,而高浓度Na+会引起细胞内K+亏缺和K+/Na+失衡[20,21],导致细胞膜的结构和功能发生改变,同时也会破坏细胞内的Ca2+平衡。Na+和Ca2+具有相似的离子半径,因而细胞质和质外体中高浓度的Na+会将质膜、液泡膜和叶绿体膜等细胞膜上的Ca2+置换下来,破坏膜的结构,导致膜选择透性丧失,甚至发生细胞解体死亡[22]。并且,由于膜选择透性的丧失,细胞内离子的种类和浓度会发生变化,核酸和蛋白质的合成和分解也会受到破坏,继而影响植物的生长和发育。有研究表明:盐诱导的Ca2+可能来源于细胞壁[23,24]或被一些活跃的质膜Ca2+外排系统介导,而Ca2+可以帮助植物改变在盐胁迫下的K+/Na+比值,调节体内离子稳态[25]。本研究中,NaCl胁迫前供试4个结缕草材料3个根区(分生区、伸长区和成熟区)的Ca2+均以外排为主,NaCl胁迫后3个根区的Ca2+均变为内流或外排减弱。此外,NaCl胁迫前4个结缕草材料根尖分生区的Ca2+外排最活跃,伸长区和成熟区则较平缓,分生区的平均Ca2+流速约为伸长区和成熟区的10倍;NaCl胁迫后3个根区的平均Ca2+流速大致相同,但NaCl胁迫前后Ca2+流变化最大的区域为分生区,因此确定分生区为结缕草根系Ca2+流最佳测定区域,也是Ca2+参与NaCl胁迫下离子平衡的关键调控区域。这与拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕[26]和沙枣(ElaeagnusangustifoliaLinn.)[13]的相关研究结果一致。
本研究结果显示:在NaCl胁迫前,不同结缕草材料间的平均Ca2+流速在伸长区和成熟区无明显差异,但耐盐结缕草在分生区的平均Ca2+流速(Ca2+外排量)明显高于敏盐结缕草;而NaCl胁迫后,耐盐结缕草的平均Ca2+流速与敏盐结缕草在3个根区无明显差异。因此,在NaCl胁迫下,耐盐结缕草较敏盐结缕草有更多的Ca2+内流参与离子调控。同时(或非常短的时间)激活Ca2+外排和Ca2+内流系统可能会形成胞质Ca2+信号,赋予应激信号的特异性[27-30]。例如:氧化应激也通过大量Ca2+转运系统影响Ca2+稳态[31-33]。
3.2 结缕草不同根区的H+流变化
H+是质膜上多种离子交换通道的离子交换物质,对维持质膜内正外负的膜电位有重要作用。稳定的H+泵送是维持植物最佳生长的关键[34]。张瑞鑫等[35]发现,拟南芥中跨质膜H+流是识别里那醇刺激和启动抗虫防御反应的初始信号。并且,通过诱导质膜Na+/H+逆向转运蛋白表达,可提高一些物种耐盐性[36]。在NaCl胁迫下,NaCl诱导了质膜和液泡H+-ATPase的激活,这些酶在盐生植物和非盐生植物中均需恢复去极化[37,38]。本文中,NaCl胁迫前,耐盐结缕草Z011在3个根区的H+均为内流,而其他3个材料在3个根区的H+为微弱内流或外排,且与Z011差异明显;NaCl胁迫后,Z011在3个根区H+内流均明显减弱,其他3个材料在3个根区的内流或外排也减弱,但差异不明显。这可能是NaCl胁迫触发结缕草根系细胞产生H+外排,对细胞质膜系统上多种离子通道和离子泵的活性产生了影响,从而启动下游相关信号系统,使H+内流减弱。
本研究结果显示:NaCl胁迫后,耐盐结缕草与敏盐结缕草在3个根区的平均H+流速无明显差异。Z011与Z015同为耐盐结缕草,其在NaCl胁迫前后的Na+和K+相对含量变化、离子分布和离子流均大致相同(未发表数据),但Z015 3个根区的平均H+流速与Z011却差异明显。这可能是由于这2个材料虽然都具有极强的耐盐性,但不同材料具有不同的H+调控机制;且NaCl胁迫前Z011 H+内流明显可能与其他抗性机制或特性有关,关于Z011的H+调控机制有待进一步的深入研究。
3.3 结缕草根系横切面的Ca2+分布
众所周知,盐胁迫主要是由细胞内Na+引起的,高浓度的Na+会导致植物细胞膜和蛋白结构破坏,并对其基本生理过程如细胞的分裂和体积增加、光合作用、新陈代谢以及矿质营养的平衡等产生消极影响[39,40]。大量研究发现,盐胁迫下植物体内的Ca2+含量会降低,而在适度盐处理下,盐地碱蓬〔Suaedasalsa(Linn.) Pall.〕[41]、海马齿〔Sesuviumportulacastrum(Linn.) Linn.〕[42]和鹅耳枥(CarpinusturczaninowiiHance)[43]等植物在增加对Na+吸收的同时,没有影响甚至增加了对Ca2+的吸收和运输。本研究结果显示:经200 mmol·L-1NaCl处理后,耐盐结缕草和敏盐结缕草不同组织中Ca2+相对含量均显著降低,这与大豆[44]和橄榄〔Canariumalbum(Lour.) Rauesch.〕[45]的研究结果一致,也进一步验证了Ca2+流的测定结果,NaCl胁迫24 h后,供试材料根系中Ca2+相对含量降低,根系Ca2+流由外排变为内流。
Peng等[46]对禾本科盐生植物碱茅〔Puccinelliadistans(Linn.) Parl.〕的研究发现,其根系可以通过物理障碍凯氏带减少对Na+的吸收,从而减少叶片对Na+的积累并维持K+平衡。在陆地棉(GossypiumhirsutumLinn.)中也发现盐胁迫可以加速其幼苗凯氏带的形成,进而提高幼苗对盐胁迫环境的适应[47]。结缕草根系具有明显的离子区隔能力,特别是耐盐结缕草能将Na+区隔在中柱以外并将K+区隔在中柱以内,防止高浓度Na+进入根系产生毒害并防止K+流失以维持体内K+、Na+平衡(未发表数据),由此推测结缕草根系存在类似于凯氏带的结构,能够对K+、Na+产生区隔作用。而本研究中,较短时间(1和6 d)的NaCl胁迫,4个结缕草材料不同组织中Ca2+相对含量从表皮、皮层到中柱均表现为逐渐降低的趋势,在处理20 d,不同材料根系表皮、皮层和中柱间的Ca2+相对含量存在差异,但4个结缕草材料的Ca2+分布均没有表现出明显区隔,说明结缕草根系对Ca2+并无显著区隔作用。Choi等[48]对拟南芥的研究发现,盐胁迫诱导了Ca2+快速且长距离的从根系运输到茎,而本研究对结缕草Ca2+流的测定结果显示在NaCl胁迫下Ca2+由外排变为内流,同时能谱测定结果也显示结缕草根系对Ca2+无明显区隔作用,这2个方面均说明结缕草在NaCl胁迫下有助于Ca2+的吸收和运输。
综上所述,NaCl胁迫下不同耐盐型结缕草的Ca2+由外排变为内流或外排减弱,耐盐结缕草较敏盐结缕草有更强的Ca2+调控能力,分生区为Ca2+参与NaCl胁迫下离子平衡的关键调控区域;结缕草根系对Ca2+没有区隔作用或区隔不明显。NaCl胁迫下不同耐盐型结缕草的平均H+流速均减小,但没有表现出与耐盐性相关的H+调控机制,而耐盐结缕草Z011在对照条件下H+内流显著高于其他3个材料,可能具有不同于其他3个材料的H+调控机制。
