香格里拉地区规模化猪场猪瘟病毒抗体检测情况分析
余丽花,和彩云

摘要:为了了解香格里拉地区猪瘟病毒抗体水平,本文对香格里拉地区5个规模化猪场的不同日龄阶段的猪进行抗体水平检测,并进行情况分析。结果显示,5个规模化猪场的猪瘟抗体阳性率分别为72.72%、81.45%、66.86%、79.81%和82.29%,有4个规模化的场高于国家规定的水平(>70%);且5家规模化猪场的猪瘟抗体检测离散度均小于40%,说明这5家猪场的整体猪瘟疫苗免疫抗体水平整齐,疫苗的免疫效果良好;哺乳仔猪、保育猪、育肥猪、后备猪、经产母猪、种公猪的猪瘟抗体阳性率分别为28.85%、89.90%、85.45%、87.78%、78.46%和97.22%;各个阶段的猪只的离散度分别为45.76%、30.77%、29.23%、22.47%、30.24%和22.31%,可以看出哺乳仔猪的猪瘟抗体离散度>40%,说明该阶段猪瘟抗体水平一般,哺乳仔猪的猪瘟抗体主要是从母源抗体获得,所以其抗体水平间接反映了母猪群的抗体水平;保育猪、育肥猪、后备猪、经产母猪、种公猪猪瘟抗体水平离散度均较集中,猪瘟疫苗免疫效果良好。
关键词:香格里拉地区;猪瘟;抗体;情况分析
猪瘟是一种可以感染家猪和野猪的传染病,对社会经济具有重大影响[1]。猪瘟病毒属于黄病毒科、瘟病毒属,是我国一类动物传染病,各个阶段和各个品种的猪均易感,感染猪的潜伏期有长有短,最急性型的感染猪在48h后就会出现典型症状,急性型的潜伏期一般为2~4d,慢性感染猪在临床上5d以上才出现临床症状,更有甚者感染后20d才出现症状,该病隐蔽性较强,所以在日常生产中养户和一些卫生防疫部门很难及时发现,对猪瘟疫情造成忽视,给我国养猪业造成巨大的经济损失[2,3]。疫苗免疫目前是预防猪瘟病毒感染的重要措施[4]。评价疫苗免疫效果,最重要的手段就是抗体检测,对当地的猪场进行猪瘟血清学检测,可以了解当地猪群猪瘟的免疫水平[5]。所以本文采用血清学方法对香格里拉地区的5个规模化猪场进行猪瘟抗体检测,以期为该地区的猪瘟疫苗免疫情况提供参考。
1 材料与方法
1.1 样品
待检血液样品采集于香格里拉地区的5个规模化猪场,总共624份;按阶段分为哺乳仔猪104份、保育猪99份、育肥猪110份、后备猪135份、经产母猪104份、种公猪72份。
1.2 试剂和仪器设备
猪瘟病毒抗体检测试剂盒购于北京爱德士元亨生物科技有限公司;酶标仪Infinite F50(美国帝肯),自动洗板机(美国帝肯HydroFlex)。
1.3 试验方法
1)样品采集方法。血液样品按照5mL/头进行采集,采集部位选择待检猪的前腔静脉,通过采血管采集的血液在室温下静置30min后,吸出血清,放于1.5mL无菌的EP管中,同时在管上做号分组标记,最后用冷冻离心机3,000r/min进行离心10min,使血清中的红细胞充分分离,分离到的血清放于-20℃保存待用。
2)抗体检测。购买的抗体检测试剂盒,根据其说明书进行操作。首先按要求对抗原包被板进行回温处理,回温处理之后的包被板不做任何处理,在稀释板条上1:1稀释好的样品血清、阳性对照和阴性对照各取100μL加入包被板中,用微型振荡器混匀后置于恒温恒湿培养箱中孵育2h,孵育完后弃去板上的液体,然后用洗板机洗涤3次,后加入抗猪瘟病毒的辣根过氧化物标记物,在恒温箱中进行30min标记孵育,孵育完后再次洗涤3次,然后加入TMB底物避光显色10min,最后加入终止液,利用酶标仪在波长450nm测定各反应孔中的OD值。
3)结果判定。结果判定根据公式:样品阻断率(%)=100%*[阴性对照A(450)-样品A(450)]/阴性对照A(450)。试验成立的条件为阴性对照的OD450值>0.500,阳性对照的阻断率≥50%。待检样品的阻断率小于30%,该样品猪瘟抗体为阴性,体内无猪瘟抗体;若待检样品阻断率≥40%,该样品猪瘟抗体为阳性,表示有猪瘟抗体;若待检样品的阻断率在30%~40%,则为可疑,对其需要重新进行检测。
变异系数(CV)=(标准差/平均数)*100%。CV≤40%表示抗体水平整齐,猪瘟疫苗免疫效果良好;40%
2 结果
2.1 不同规模化猪场的整体抗体水平
由表1可以看出,5个规模化猪场的猪瘟抗体阳性率分别为72.72%、81.45%、66.86%、79.81%和82.29%,有4个规模化的场高于国家规定的水平(>70%);且5家规模化猪场的猪瘟抗体检测离散度均小于40%,说明这5家猪场的整体猪瘟疫苗免疫抗体水平整齐,疫苗的免疫效果良好;但是这5个场的整体阳性率为76.86%,阳性率不是很高。
2.2 不同階段猪群的猪瘟抗体水平
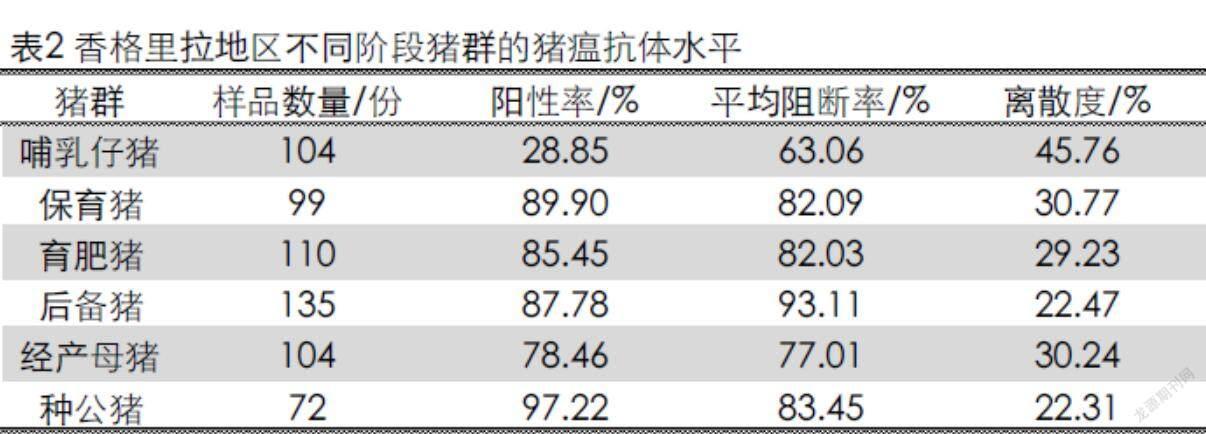
由表2可以看出哺乳仔猪、保育猪、育肥猪、后备猪、经产母猪、种公猪的猪瘟抗体阳性率分别为28.85%、89.90%、85.45%、87.78%、78.46%和97.22%;各个阶段的猪只的离散度分别为45.76%、30.77%、29.23%、22.47%、30.24%和22.31%,可以看出哺乳仔猪的猪瘟抗体离散度>40%,说明该阶段猪瘟抗体水平一般,哺乳仔猪的猪瘟抗体主要是从母源抗体获得,所以其抗体水平间接反映了母猪群的抗体水平;保育猪、育肥猪、后备猪、经产母猪、种公猪猪瘟抗体水平离散度均较集中,猪瘟疫苗免疫效果良好。
3 讨论
猪瘟病毒血清抗体的检测对于临床上诊断和免疫效果的评估、适宜免疫时机的选择都有很重要的指导意义。目前猪瘟病毒的抗体检测方法主要有正向间接血凝试验、间接ELISA、阻断ELISA、琼脂扩散试验、胶体金免疫层析试纸条等[6-8]。本文采用阻断ELISA方法对香格里拉地区规模化猪场猪瘟病毒抗体检测情况分析,发现5家规模化的猪场有一家猪瘟抗体阳性率低于国家的标准(<70%),造成该场猪瘟抗体水平较低的原因可以从多方面考虑,如猪场管理员免疫方法不当、饲养环境条件差等,所以猪场应结合自身的实际生产情况进行猪瘟疫苗免疫程序的调整[9]。有研究报道抗体水平低于40%,不仅代表猪场的整体疫苗的免疫效果较好,同时还表示该猪场散发猪瘟的危险度小[10];从香格里拉这5个规模化猪场的整体抗体离散度均低于40%,说明这5个规模化猪场的整体猪瘟疫苗免疫效果良好。
从不同阶段的猪瘟抗体检测情况来看,哺乳仔猪的抗体阳性率为28.85%,说明了哺乳仔猪的整体抗体水平偏低,对于哺乳仔猪的抗体是从母猪的母源抗体中获得,抗体水平偏低可能是不同仔猪受母源抗体影响程度不同所致,同时受母源抗体水平均匀度和整齐度及受母体和个体影响[11];经产母猪的猪瘟抗体阳性率为78.46%,说明香格里拉地区的这5个规模化猪场的整体母猪群的猪瘟疫苗免疫情况还是比较不理想,需要调整为更合适自身本场的免疫程序[12]。保育猪、育肥猪、后备猪、种公猪的猪瘟抗体阳性率分别为89.90%、85.45%、87.78%和97.22%,表明這些阶段的猪瘟疫苗免疫效果较好。
综上所述,目前规模化猪场对于猪瘟的防控主要还是要靠疫苗免疫,对疫苗整体的免疫水平进行监测是规模化猪场完善自身免疫程序的一种重要手段;规模化猪场可以根据本场猪瘟抗体水平的波动来合理的安排和调整疫苗,从而提高疫苗的免疫效果,避免造成疫苗及人力的浪费,所以是一种可以广泛应用于养猪产业的监测方法[13]。
参考文献:
[1] Chen Shu-cheng, Li Su, Sun Hu-min, et al. Expression andcharacterization of a recombinant porcinized antibody against theE2protein of classical swine fever virus [J]. Appl Microbiol Biotechnol, 2018, 102(2):961-970.
[2] 万桂梅.猪瘟的临床诊断与防治措施[J].畜禽业,2020,31(7):93.
[3] 李永光,李有山,杨良存,等.猪瘟疫病流行的新特点及其综合防制探讨[J].山东畜牧兽医,2018(1):30-35.
[4] Barbara ES, Jeffery JZ, Sylvie DA,等.猪病学[M].第9版.赵德明,张仲秋,沈建忠,主译.北京:中国农业大学出版社,2009.
[5] 祖立闯,李娇,高鹏,等.抗体检测在猪病防控中的应用[J].猪业科学,2015,32(8):138-140.
[6] 董浩,李菲,王鑫,等.猪瘟病毒野毒株与疫苗株酶切检测方法的建立、优化及应用[J].中国畜牧兽医,2011,38(9):187-189.
[7] Peng W P, Qiang H, Xia Z H, et al. Identification of a conserved linear B-cell epitope at the N-terminus of the E2 glycoprotein of Classical swine fever virus by phage-displayed random peptide library[J]. Virus Research, 2008, 135(2):267-272.
[8] Xu X G, Liu H J. Baculo virus surface display of E2 envelope glycoprotein of classical swine fever virus and immunogenicity of the displayed proteins in a mouse model[J]. Vaccine, 2008, 26(43):5455-5460.
[9] Zanetti M R, Petricelli C D, Alexandre S M, et al. Determination of acutof value for pelvic floor distensibility using the Epi-no baloon to predictperinea lintegrity in vaginal delivery:ROC curveanalysis,Prospective observational single cohort study[J]. Sao Paulo Med J, 2016, 134(2):97-102.
[10] Li Y C, Chiou M T, Lin C N. Serodynamic analysis of the piglets born from sows vaccinated with modified live vaccine or E2 subunit vaccine for classical swine fever[J]. Pathogens, 2020, 9(6):427.
[11] 覃绍敏,龙爱淑,吴健敏,等.规模猪场种猪猪瘟群体免疫合格率与抗体离散度监测及免疫效果分析[J].中国兽医杂志,2011,47(11):3-5.
[12] Kuma R R, Kuma R V, Kekungu P, et al. Evaluation of surface glycoproteins of classical swine fever virus as immunogens and reagents for serological diagnosis of infection in pigs:a recombinant Newcastle diseas evirusapproach[J]. Arch Viro, 2019, 164(12):3007-3017.
[13] 马振乾,王辉之,王宗升,等.云南省某规模化猪场三种主要病毒抗体检测与分析[J].家畜生态学报,2021,3(42):70-74.

