氰化物水样保存的影响因素探究
林仰锋 黄桂愉 陈 瑶 刘松欢 罗丹纯
(揭阳粤海水务有限公司,广东揭阳 522000)
前言
氰化物属于剧毒、高毒物质,对人、畜危害极大。氰化物能够附着在人体内的高铁细胞素氧化酶上,产生新的氰化高铁细胞素氧化酶,而这一新产生的酶失去原有酶的传氧功能,使体内组织发生缺氧甚至窒息死亡[1]。氰化物在工业中被广泛使用,主要污染源来自于冶炼、电镀、油漆、染料、橡胶、化肥等工业排放的污水[2]。氰化物在水体中有多种存在形式,一种是毒性很强、易溶于水的简单氰化物,如氰化氢、氰化钾、氰化钠等;还有一种是毒性稍小,但能分解出简单氰化物的络合氰化物。因此,水中氰化物的测定是一项重要的毒理学指标。当水中氰化物浓度≥0.01mg/L 时,该水源不宜直接饮用。氰化物的检测方法有很多,如滴定法、比色法、电极法、流动注射法等。
氰化物性质不稳定,在水样中容易发生分解,本文对氰化物水样的保存影响因素进行探究,选取最适宜的水样保存条件,改善了氰化物加标回收率以及稳定性,从而提高了氰化物检测结果的准确性。
1.实验仪器及参数设置
1.1 实验仪器
全自动流动注射分析仪:宝德BDFIA-8000(氰化物)
pH 计:雷磁PHS-3E
电子天平:赛多利斯BSA224S
超纯水制备装置:密理博 MilLi-Q Reference(18.2MΩ·cm)
冰箱:穗凌SL373
生化培养箱:科力 PYX-280S-A
离心机:RONG TAI 80-2
隔膜抽滤装置:津腾GM-0.33A
1.2 仪器参数
流动注射仪仪器参数见表1。
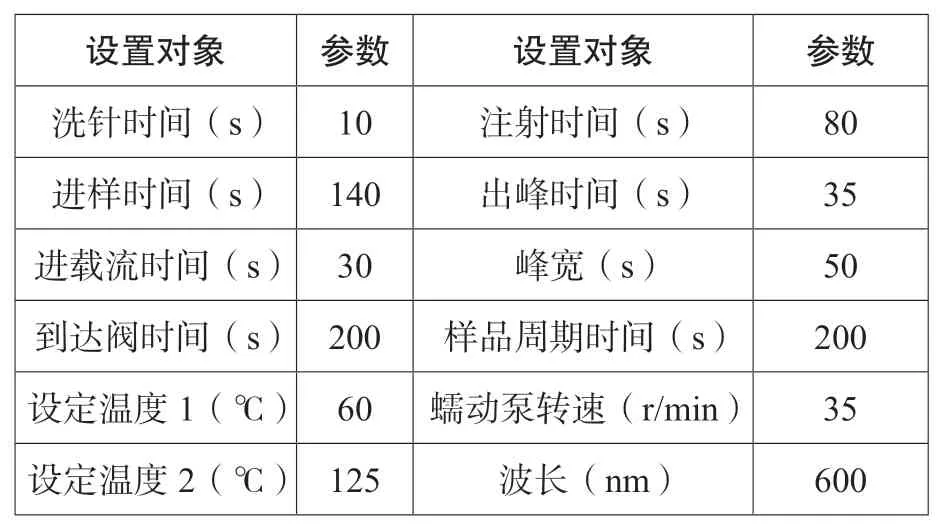
表1 仪器参数设置
2.实验试剂及标准溶液
2.1 实验试剂
氢氧化钠,AR 500g;磷酸二氢钾,GR 500g;氯胺-T,AR 500g;
异烟酸,AR 100g;1,3-二甲基-巴比妥酸,AR 25g;
磷酸,GR 500mL;超纯水。
2.2 标准溶液
2.2.1 标准物质
氰化物标准溶液(中国计量院GSB07-3170-2014-202262),50mg/L。
2.2.2 标准中间液
氰化物标准中间液(2.0mg/L):吸取2.00mL 氰化物标准溶液(50mg/L)于50mL容量瓶中,用氢氧化钠溶液(1g/L)稀释并定容至刻度,摇匀。
2.2.3 标准使用液
将氰化物标准中间液(2.0mg/L)用氢氧化钠溶液(1g/L)稀释为100、10.0、1.0μg/L 的浓度,分别标记为氰化物标准使用液①、②、③。
3.实验部分
3.1 标准曲线
分别将氰化物标准使用液①、②、③装入样品管中,设置稀释倍数,进样后绘制标准曲线。实验结果见表2 及图1。

表2 标准系列浓度及峰面积

图1 标准系列线性
3.2 最低检测质量浓度
选取浓度1.0μg/L 的标准样品重复测定9次,测得对应标准偏差S 为0.0208μg/L。根据检出限MDL=S*t,t=2.896(n=9),计算出氰化物MDL 为0.0602μg/L。
最低检测质量浓度即测定下限对应浓度,根据测定下限=4*MDL,计算得本方法氰化物最低检测质量浓度为0.3μg/L,低于标准文件CJ/T 141-2018(5.2.2)[3]的2.0μg/L 浓度,符合检测要求。
3.3 水样保存的影响因素
3.3.1 除氯试剂的选择
实验中我们发现,水样中存在的余氯(游离余氯)及二氧化氯与氰化物发生反应,从而使水样的氰化物浓度降低。其中,余氯水解生成次氯酸盐,利用次氯酸根的氧化性,将氰化物氧化为氰酸盐,氰酸盐继而被氧化成无毒的碳酸盐和氮气,反应如下:①CN-→2HCO3-+N2 ↑+3Cl-[4];二氧化氯则能将氰化物彻底氧化成氮气及二氧化碳,2CN-对氰化物的测定也能形成一定的干扰[5],故在分析之前,我们一般会加入除氯试剂进行除氯处理。
实验室常见的除氯试剂一般有抗坏血酸、硫代硫酸钠、盐酸羟胺及亚硫酸钠,本实验对这四种试剂的除氯后的加标回收率进行研究及测定。我们在21 个200mL 棕色容量瓶中,加入水样(出厂水,余氯含量为0.5mg/L)并定容至刻度。将20 个水样分为4 组,每组5 个。第1、2、3、4 组单独加进抗坏血酸、硫代硫酸钠、盐酸羟胺、亚硫酸钠,各组试剂质量浓度分别为50、100、200、500、1000mg/L;最后一个容量瓶只加水样,不加任何除氯试剂,作为对照组。见表3。

表3 除氯试剂浓度表
在各组水样中加入氰化物标准中间液,加标浓度均为10.0μg/L。首先我们测得对照组的氰化物加标回收率为75.8%,其次再对其他组样品进行测定并统计加标回收率,见图2。由结果我们看到,加入抗坏血酸后,氰化物回收率均>95%,其中试剂浓度为100mg/L时回收率达到99.2%;加进硫代硫酸钠后,氰化物的加标回收率也较为理想,回收率在86%~94%范围内,其中试剂浓度200mg/L 时回收率为93.9%;加入盐酸羟胺后,氰化物回收率约为82~97%,在试剂浓度为1000mg/L时加标率数值达到最大,为96.4%;相比起前面三种除氯试剂,亚硫酸钠的除氯效果不太明显,经处理后氰化物回收率约为79~86%,当试剂浓度500mg/L 时,回收率为85.7%。

图2 除氯试剂浓度与氰化物加标回收率关系图
综上所述,除氯试剂有助于提高氰化物加标回收率。当出厂水余氯含量不大于0.5mg/L时,在相同试剂浓度下,抗坏血酸的除氯效果最为显著,氰化物加标回收率最高。考虑到试剂成本等问题,我们选取抗坏血酸作为实验除氯试剂,试剂浓度为100mg/L。
3.3.2 pH 值调节
pH 值是保存氰化物水样的一个重要因素。在弱酸性条件下,水中的氰化合物容易释放出氰化氢气体,从而影响氰化物的结果测定。《生活饮用水标准检验方法水样的采集与保存》[6]规定,氰化物水样需用氢氧化钠调节至pH 值≥12,本实验就pH 值对氰化物水样保存的影响做了相关研究。
实验选取8 个加标浓度为10.0μg/L 的出厂水(抗坏血酸100mg/L),测得水样pH值为5.5,再用280g/L 的氢氧化钠溶液将其中7 个水样分别调节pH 值至7.0、9.0、11.0、12.0、12.5、13.0、13.5,测定氰化物加标回收率,如图3。我们看到,pH 值在5.5~12.5 的范围内,氰化物的加标回收率呈现递增趋势,其中pH 值12.5 时加标回收率最大,为98.6%;pH>12.5 时,回收率逐渐减小。实验表明,碱性条件下,氰化物回收率较高,能得到更好的保存。当pH 值为12.5 时,水样保存效果最好。

图3 pH 值与氰化物加标回收率关系图
3.3.3 保存温度
温度对氰化物水样的稳定性有一定的影响。本文就保存温度与氰化物浓度的关系做了以下探究。实验选取地表水、出厂水、管网水三种水样各1000mL(抗坏血酸100mg/L),加入氰化物标准中间液至浓度为5.0μg/L。将每种水样分为四组,分别置于4℃、10℃、20℃、30℃密闭环境中(其中4、10℃为冰箱环境,20、30℃为生化培养箱环境),24h 后测定水样氰化物浓度,见图4。

图4 保存温度与氰化物浓度关系图
我们发现,保存温度为4℃时,水样的氰化物稳定性良好,浓度均>4.5μg/L。随着温度的升高,三种水样氰化物的浓度都有所降低,温度数值与氰化物浓度呈反比。在温度达到30℃时,氰化物浓度降至最低,此时地表水中氰化物降浓度低趋势比出厂水及管网水更加明显。王丽萍[7]发现,温度较低时,微生物繁殖缓慢,氰化物不容易分解,从而减少了保存过程中样品组分的损失。通过本实验,我们可以验证以及延伸这一论据。地表水由于未经投氯消毒,微生物及细菌总数比出厂水及管网水多很多,故地表水氰化物浓度受温度的影响大于其他两种水样。实验结果证明,保存温度越低,氰化物水样保存效果越好,其中,4℃为保存氰化物水样的最合适温度。
3.3.4 保存时间
氰化物在水体中稳定性较差,容易分解导致浓度偏低,不适宜长期存放,因此保存时间也是氰化物水样保存的重要因素之一。
我们将出厂水分为4 组,加入抗坏血酸及调节pH 值后,再分别加氰化物标准中间液至氰化物浓度为2.0、5.0、10.0、25.0μg/L。将样品组于4 ℃冰箱中放置0、1、2、4、10、24、48h,每个时间点测定氰化物浓度,见图5。实验发现,低浓度组水样(2.0μg/L)在4h 内基本保持稳定,保存时间越长,浓度下降幅度越大,24h 后浓度仅为原浓度的55%,48h 后则降低至原浓度的40%;高浓度组水样(5.0~25.0μg/L)在24h 之内基本能保持较高的氰化物浓度(>原浓度的90%),但在48h 过后,氰化物浓度均有大幅度下降。

图5 放置时间与氰化物浓度关系图
众所周知,投加余氯在短期间内能杀灭水中大部分细菌,但剩余微生物及细菌仍会不断繁殖增长,时间越长数量越多。在24h 之内,细菌繁殖较慢,对水样中的氰化物干扰相对较低,故氰化物仍可维持稳定状态;24~48h 后,细菌繁殖速度加快,大量的氰化物被分解,结果偏差增大。通过本次实验,我们能够得出结论,水样采集后必须及时冷藏保存,并于24h内完成测定,否则会造成氰化物测定结果偏低。如果水样氰化物浓度较低,则应在采集后4h 内测定。
3.3.5 浑浊度处理
流动注射仪管路复杂,而且管径较小,在分析浑浊度较大的水样时,容易被水样中的细小颗粒堵塞样品管及其他管路,这种情况既影响实验结果,也可能损坏实验耗材。一般来说,浑浊度越大,颗粒物越多,因此我们一般会对地表水等水样进行降低浊度的前处理操作。
实验取3 份地表水各1000mL,调节pH值后加入氰化物标准中间液至浓度为5.0、10.0、20.0μg/L。将样品各自分成3 组,分别进行直接静置、离心后取上清液、抽滤后取滤液3 种处理,置于4℃保存24h(静置法于测定前取上清液),测定结果并统计数据,见表4。
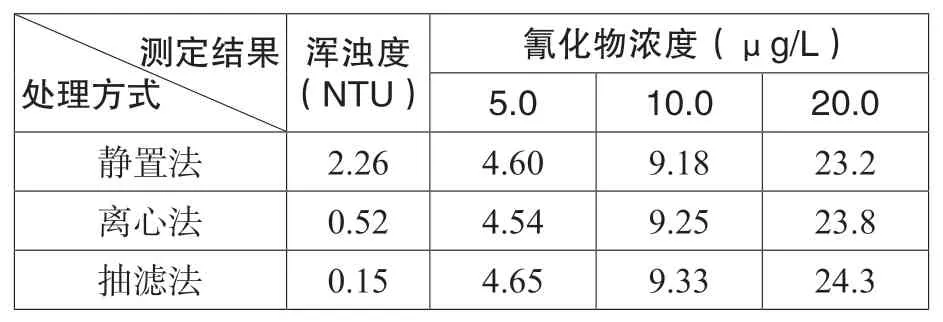
表4 浑浊度处理与氰化物浓度关系表
由结果可见,浑浊度处理效果为抽滤法>离心法>静置法,氰化物浓度则是三种方法相差不大。本研究暂未发现颗粒物会对氰化物测定结果产生明显影响。相比较三种方法,静置法省时简单,但未能很好解决浑浊度问题,仍存在颗粒物堵塞管路的风险;抽滤法高效简便,降低浊度的效果最好,但不同批次的滤膜质量不同,滤膜中的某些组分可能会对水样中的氰化物造成正向干扰;离心法既节约成本,又能较好地降低浑浊度,延长耗材寿命,因此,本实验选用离心法作为浑浊度处理的第一方法。
4.实验结论
本文探究了影响氰化物水样保存的除氯试剂、pH 值、保存温度、保存时间、浑浊度处理几个因素,对余氯不大于0.5mg/L 的水样,加入抗坏血酸至试剂浓度为100mg/L,同时调节水样pH 值至12.5,用离心法处理后取上清液,于4℃环境中保存并在24h 内尽快测定,氰化物的加标回收率以及稳定性均能得到保障。

