二神丸对溃疡性结肠炎大鼠炎性反应及血小板的影响※
韩森福 李 清 刘 姣 张晓艳 李佩娥 杨 洋 于 博 张正威 赵 静
(1.河北医科大学中西医结合学院2017级本科生,河北 石家庄 050017;2.河北中医学院中药药理教研室,河北 石家庄 050200;3.河北省中医院脾胃病三科,河北 石家庄 050011;4.河北医科大学中西医结合学院2018级本科生,河北 石家庄 050017;5.河北医科大学中西医结合学院中药与中药药理教研室,河北 石家庄 050017)
溃疡性结肠炎(ulcerativecolitis,UC)是一种以反复发作腹痛、腹泻、黏液脓血便及溃疡为特点的肠道非特异性炎性疾病,其发病机制尚不十分明确,可进展为结肠癌,对患者的生活质量和生命健康造成严重影响[1]。目前,临床上常将美沙拉秦作为治疗UC的一线药物,但部分患者长期使用美沙拉秦可产生耐药性,其疗效随时间发展而逐渐减低,并可出现恶心、呕吐、腹痛等不良反应[2]。中医药在治疗UC方面具有可靠的疗效,根据UC的临床表现将其归属于“久痢”“肠澼”“泄泻”“痢疾”等范畴。二神丸出自宋·许叔微的《普济本事方》,由补骨脂、肉豆蔻配伍组成,具有温脾暖胃、补肾固肠之功,是临床治疗久痢、泄泻的经典古方。有研究报道认为,除肠道的炎性反应外,血小板(PLT)在UC的发病中也起着重要作用[3]。本研究采用2,4,6-三硝基苯磺酸钠(TNBS)-乙醇诱导法建立UC大鼠模型,观察二神丸对UC模型大鼠炎性反应和PLT的影响,探讨二神丸治疗UC的可能作用机制。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级雄性SD大鼠70只,体质量(180±20) g,适应性饲养7 d,室温(22±2)℃,相对湿度50%~60%,自由摄食、饮水,均购自河北省实验动物中心,实验动物生产许可证号SCXK(冀)2018-004。
1.2 实验药物 肉豆蔻、补骨脂(国药河北乐仁堂医药连锁有限公司);美沙拉秦缓释颗粒(上海爱的发制药有限公司,国药准字H20143164,批号190114)。
1.3 实验主要试剂及仪器
1.3.1 主要试剂 TNBS(美国Sigma公司);一氧化氮(NO)测定试剂盒(南京建成生物工程研究所有限公司);P选择素(P-selectin)酶联免疫吸附(ELISA)法检测试剂盒、白细胞介素1β(IL-1β)ELISA检测试剂盒、肿瘤坏死因子α(TNF-α)检测试剂盒(化学发光法)(上海森雄科技实业有限公司)。
1.3.2 主要仪器 SpectraMax190型全自动酶标仪(美国MD公司);BC-30Vet型全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司);REM-710型切片机(日本大和光机工业株式会社);AxioVert A1型倒置显微镜(德国Carl Zeiss公司)。
1.4 实验方法
1.4.1 二神丸药物配制
1.4.1.1 二神丸给药剂量的设计 二神丸出自《普济本事方》,原方由补骨脂(炒,四两)、肉豆蔻(二两)组成,其配伍比例为2∶1。《中华人民共和国药典》中推荐的补骨脂临床用量为6~10 g,肉豆蔻用量为3~10 g。综合二者,确定补骨脂人的用量为10 g,肉豆蔻人的用量为5 g,总用量为15 g。再根据人与大鼠间体表面积折算的等效剂量比值表计算,设定大鼠等效剂量1.575 g/kg为低剂量给药,其4倍剂量为高剂量给药。
1.4.1.2 二神丸水煎液的制备 按照传统中药的煎煮方法,补骨脂168 g,肉豆蔻84 g,加入8倍量(1000 mL)纯净水中混合浸泡30 min后煎煮,煮沸后保持水沸状态1 h,过滤,将滤液倒入烧杯中备用,往滤渣中再加6倍量(750 mL)纯净水,煎煮方法同上,将2次所得滤液合并,将滤液继续煎煮,浓缩至所需浓度(0.63 g生药/mL),冷却,冷藏保存。
1.4.2 美沙拉秦缓释颗粒混悬液的制备 取适量美沙拉秦缓释颗粒,用研钵碾碎,将研磨好的药物粉末与羧甲基纤维素钠(CMC-NA)溶液按1∶10比例混合,搅拌配制成质量浓度为0.05 g/mL的美沙拉秦缓释颗粒混悬液,冷藏保存。
1.4.3 分组、造模 随机取10只大鼠作为正常对照组,其余60大鼠均采用TNBS法建立UC模型[4]。所有大鼠禁食不禁水24 h,以10%水合氯醛(4.0 mL/kg)腹腔注射麻醉,造模组将5%TNBS和75%乙醇(1∶1,V/V)混合液(100 mg/kg)用石蜡油润滑直径0.4 mm的胶管一次性注入大鼠直肠7~8 cm深的肠腔内,正常对照组给予等容积0.9%氯化钠注射液灌注,并将大鼠倒置5 min,使药液充分渗入肠腔。然后将大鼠放平,使其自然苏醒,给予正常饮食。随机处死2只造模大鼠,解剖结肠组织,肉眼可见溃疡面,周围黏膜充血、水肿,病理检查确认有慢性炎症细胞浸润、典型溃疡形成等UC病理改变,说明造模成功[5]。在造模给药过程中共有20只大鼠死亡。
1.4.4 给药 将造模成功的大鼠随机分为模型组(10只)、阳性药物组(8只)、二神丸低剂量组(10只)、二神丸高剂量组(10只)。根据成人常规剂量按人与大鼠系数折算[6],阳性药物组予美沙拉秦缓释颗粒混悬液0.5 g/(kg·d)灌胃,二神丸低剂量组予二神丸水煎液1.575 g/(kg·d)灌胃,二神丸高剂量组予二神丸水煎液6.3 g/(kg·d)灌胃,正常对照组和模型组予等容积10 mL/(kg·d)蒸馏水灌胃,各组连续灌胃14 d。
1.5 观察指标及方法
1.5.1 一般情况 每日观察并记录大鼠的精神状态、行为改变、皮毛光泽度及大便的性状、便血、隐血情况,同时记录大鼠每日的体质量变化情况。
1.5.2 全血PLT、平均血小板体积(MPV)测定 各组大鼠给药14 d后禁食不禁水12 h,再用10%水合氯醛3.5 g/kg进行腹腔注射麻醉,麻醉后剖开腹腔,使用乙二胺四乙酸二钾(EDTA-K2)抗凝管吸取腹主动脉血,再采用全自动血液细胞分析仪检测PLT、MPV水平情况。
1.5.3 血清P-selectin、NO测定 使用无添加剂的真空采血管取腹主动脉血,在4 ℃下以3000 r/min离心10 min,取上清液,P-selectin采用ELISA法进行检测,NO采用硝酸还原法进行检测,相关操作均严格按照试剂盒说明书进行。
1.5.4 结肠病理组织学观察 各组大鼠取血后,剪取距肛门8 cm处的结肠组织4~5 cm,置于4%多聚甲醛液中固定48 h后进行脱水、透明、浸蜡、包埋、切片,常规制作成石蜡病理切片,再行苏木素-伊红(HE)染色,显微镜下观察结肠病理组织学情况。
1.5.5 结肠组织TNF-α、IL-1β测定 各组大鼠取同一位置同一大小结肠段,迅速置于液氮中,-80 ℃超低温冰箱保存,进行结肠组织TNF-α、IL-1β水平检测。IL-1β采用ELISA法进行检测,TNF-α采用化学发光法检测,相关操作均严格按照试剂盒说明书进行。
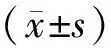
2 结果
2.1 各组大鼠一般情况比较 正常对照组大鼠毛发光滑有光泽,精神状态好,体质量平稳增加,大便形状正常。模型组大鼠毛发无光泽,拱背扎堆蜷卧,粪便稀,肛周和尾巴底部覆盖有稀便,并伴有恶臭,体质量增加出现明显减缓。阳性药物组和二神丸低、高剂量组大鼠一般情况均较模型组有改善,阳性药物组改善明显,毛发有光泽,精神状态较好,拱背扎堆蜷卧现象减少,肛门污秽随时间延长而减少,体质量增加较模型组略有增加。各组大鼠灌胃期间体质量变化曲线见图1。
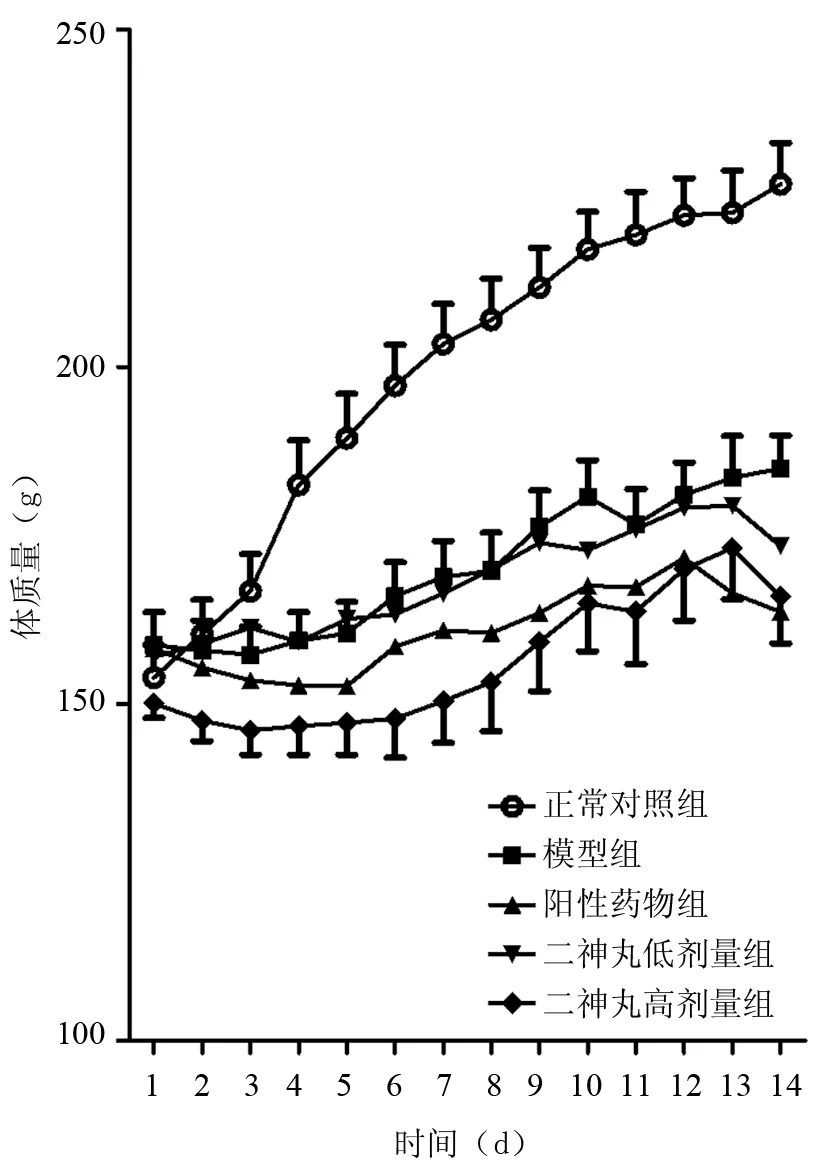
图1 各组大鼠灌胃期间体质量变化曲线
2.2 各组大鼠灌胃后全血PLT、MPV比较 与正常对照组比较,模型组大鼠灌胃后全血PLT增加(P<0.05),MPV降低(P<0.05)。与模型组比较,二神丸低、高剂量组大鼠全血PLT均降低(P<0.05),二神丸低剂量组大鼠MPV增加(P<0.05),阳性药物组大鼠全血PLT、MPV和二神丸高剂量MPV与模型组比较差异均无统计学意义(P>0.05)。二神丸低、高剂量组大鼠全血PLT、MPV组间略有高低,但比较差异均无统计学意义(P>0.05)。见表1。
表1 各组大鼠灌胃后全血PLT、MPV比较
2.3 各组大鼠灌胃后血清P-selectin、NO水平比较 与正常对照组比较,模型组血清P-selectin、NO水平均升高(P<0.05)。与模型组比较,阳性药物组、二神丸低剂量组、二神丸高剂量组血清NO水平和二神丸高剂量组P-selectin水平均降低(P<0.05),阳性药物组和二神丸低剂量组P-selectin水平虽也有降低趋势,但比较差异无统计学意义(P>0.05)。二神丸高剂量组大鼠血清P-selectin、NO水平虽略低于二神丸低剂量组,但组间比较差异均无统计学意义(P>0.05)。见表2。
表2 各组大鼠灌胃后血清P-selectin、NO水平比较
2.4 各组大鼠结肠组织IL-1β、TNF-α水平比较 与正常对照组比较,模型组大鼠结肠组织IL-1β、TNF-α水平均升高(P<0.05)。与模型组比较,阳性药物组、二神丸低剂量组、二神丸高剂量组大鼠结肠组织IL-1β、TNF-α水平均降低(P<0.05)。二神丸高剂量组大鼠结肠组织IL-1β、TNF-α水平虽略低于二神丸低剂量组,但组间比较差异均无统计学意义(P>0.05)。见表3。
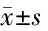
表3 各组大鼠结肠组织IL-1β、TNF-α水平比较
2.5 各组大鼠灌胃后结肠组织病理形态情况 正常对照组大鼠结肠黏膜完整,腺体排列规则,肌层结构正常。模型组大鼠结肠腺体结构异常,黏膜和黏膜下层大量炎症细胞,并有溃疡形成。阳性药物组和二神丸低、高剂量组大鼠结肠黏膜部分缺损,结肠黏膜炎性浸润、腺体受损较模型组明显减轻。见图2。
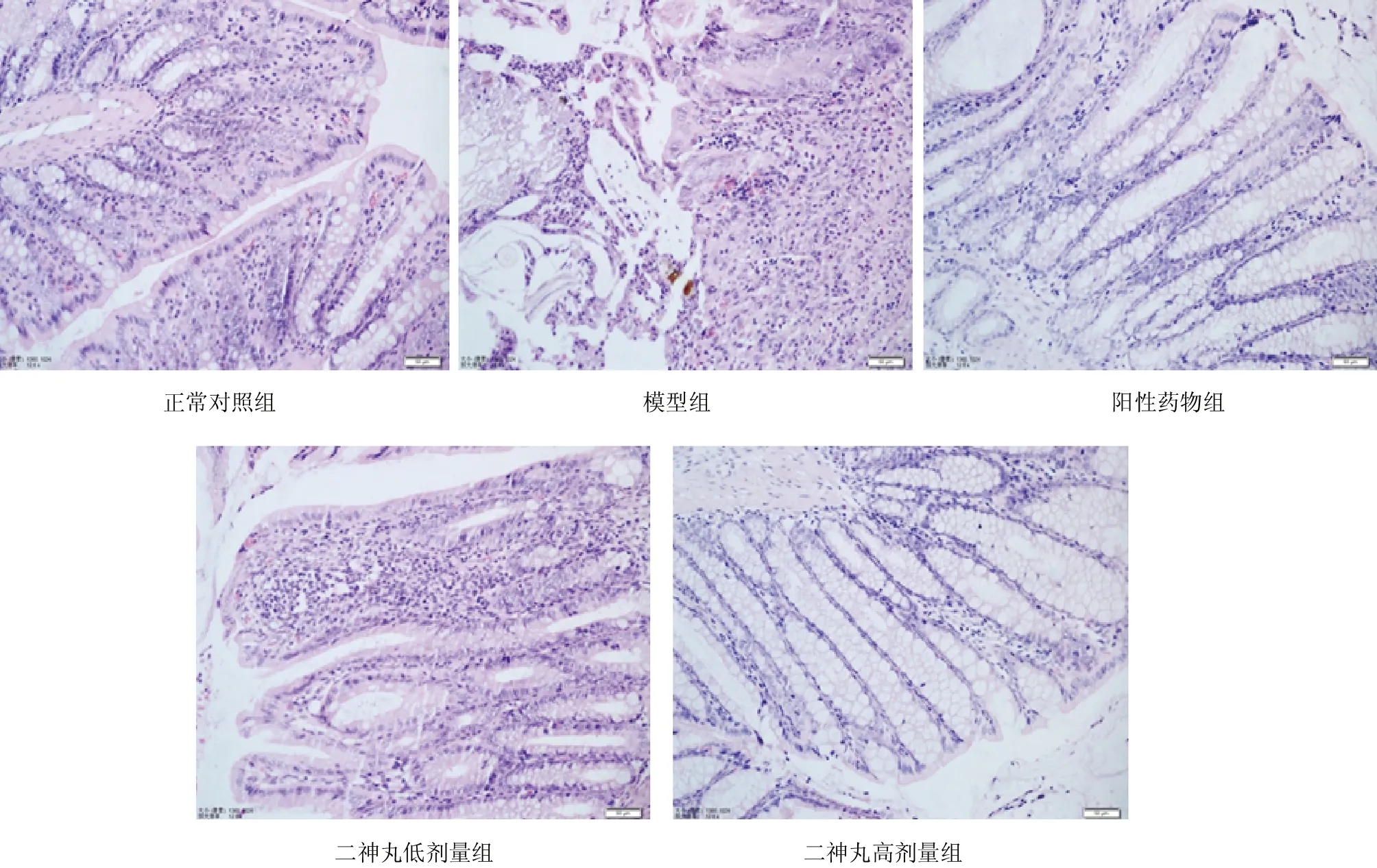
图2 各组大鼠灌胃后结肠组织病理形态情况(HE,×200)
3 讨论
UC发病主要是由于外邪侵袭、五志失调、摄食失宜等,致使机体气血虚弱,正气不足,气血流通不畅,进而使大肠传导失司,血不归经,离经之血溢于脉外,脂膜血络受损而发病。UC的病机关键为脾肾两脏虚损,《素问·阴阳应象大论》曰:“湿盛则濡泻。”指出泄泻的病机为脾虚湿盛,但UC的病机不全在于脾虚。《景岳全书·泄泻》中指出:“肾为胃关,开窍于二阴,所以二便之开闭,皆肾脏之所主,今肾中阳气不足,则命门火衰……阴气盛极之时,则令人洞泄不止。”肾为先天之本,脾为后天之本,脾阳有赖于肾阳的温煦,若肾阳亏虚,则脾失温煦,运化失司,发为泄泻;同时因后天之精不能充养先天之精,影响机体代谢,故大肠湿浊之邪滞留,气血双亏,虚实夹杂。二神丸为治疗脾肾虚寒泄泻的传统古方,并且其组成补骨脂、肉豆蔻也是常用的温补脾肾药对,在临床上作为基础方随症加减,应用广泛。方中补骨脂能补命门之火,具有温肾助阳、固精缩尿、温脾止泻的作用;肉豆蔻具有温中行气、涩肠止泻之效。二药相合具有温脾暖胃、补肾固肠之功效。
UC的发病机制尚不明确,一般认为主要与遗传、炎症、免疫等因素有关[7],其中炎性反应是UC发病和恶化的最主要因素,肠道中细胞炎症因子与肠道黏膜功能状态密切相关[8]。TNF-α是由活化的单核细胞分泌的细胞因子,具有多种生物活性作用,不仅能够对抗肿瘤,同时能够介导机体的急、慢性炎性反应,能够聚集中性粒细胞,释放炎症介质,促进多种IL的合成,诱导炎症因子浸润于肠道组织内,加速肠上皮细胞的坏死[9-11]。IL-1β为促炎因子,由单核细胞、巨噬细胞产生,正常情况下体内IL-1β含量极低,当组织受到感染或损伤时,IL-1β水平明显升高,并可分泌到细胞外与相应受体结合,促进白细胞募集并释放更多的炎症介质,产生级联效应,发挥促炎作用[12-13]。IL-1β目前已成为治疗全身和局部炎症性疾病的重要靶标,可通过降低IL-1β活性,抑制炎性反应,从而达到治疗UC的效果[14]。本研究结果显示,模型组大鼠结肠组织中TNF-α、IL-1β水平较正常对照组升高(P<0.05),病理观察也显示黏膜和黏膜下层大量炎症细胞,提示UC大鼠结肠组织中炎性反应活跃;阳性药物组、二神丸低剂量组、二神丸高剂量组大鼠经相应干预治疗后结肠组织IL-1β、TNF-α水平均降低(P<0.05),提示结肠肠道炎性反应得到缓解。
近年来多项研究显示,PLT在UC的发病机制中起重要作用,患者病情活动时PLT会明显升高[15-16]。PLT是血液中最小的无核细胞,起源于骨髓巨核细胞,其在止血、炎症及损伤组织修复过程中起重要作用。多数UC患者血液处于高凝状态,甚至出现血栓形成等肠外表现,而PLT在机体的凝血功能和肠道炎症的发生过程中扮演着关键角色,当凝血功能发生异常时,血流速度减缓,可导致肠黏膜缺血坏死,部分有溃疡发生,因此血液高凝状态会加重溃疡[17-19]。清·王清任《医林改错》言:“泻肚日久,百方不效,是总提瘀血过多。”认为瘀血是导致UC发病及病情迁延难愈的原因,又是发展的结果,贯穿疾病始终。PLT也能反映UC的炎性反应情况,UC患者由于肠系膜血管内皮损伤,继而暴露基底膜胶原诱发PLT激活,一方面PLT参与炎性反应过程,其参与炎性反应需要IL-1β信号和核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎性小体活化,静息状态下PLT可表达NLRP3、接头分子,在活化状态PLT中两者共定位组装成功能性NLRP3炎症小体,形成半胱氨酸天冬氨酸蛋白酶1(caspase-1),产生IL-1β等炎症因子,促进炎症过程[20-22];另一方面多种炎症因子也可使PLT数量、形状、功能发生改变,释放大量生物活性物质及促凝分子和微粒,导致高凝状态,甚至血栓形成,高凝状态与炎症发生互为因果[23-24]。目前,PLT异常在UC中的作用已引起了广大研究人员的关注,PLT的升高和MPV下降等已作为UC活动性的观察指标之一,也可作为评测UC患者肠镜下完全或部分黏膜愈合的预测指标[25]。本研究结果显示,与正常对照组比较,模型组大鼠全血PLT升高(P<0.05),MPV下降(P<0.05),这也与前文提到的研究结果一致;二神丸低、高剂量组经相应干预后全血PLT、MPV均较模型组有不同程度改善,其中二神丸低、高剂量组PLT和二神丸低剂量组MPV改善最明显(P<0.05),而阳性药物组全血PLT、MPV较模型组均无明显变化(P>0.05),提示二神丸通过影响UC大鼠PLT、MPV,既可改善机体的高凝状态,防止血栓形成,同时又避免高凝状态下炎性反应的加重,从而发挥治疗作用。
为进一步验证PLT与UC的关系,我们又对与PLT活化密切相关的P-selectin和NO做了观察研究。P-selectin是一种依赖PLT活化的颗粒外膜蛋白,它是选择素家族的成员之一,是一种细胞黏附分子受体,在未被活化的PLT细胞膜表面P-selectin呈低表达或不表达。当PLT活化可引起α颗粒释放,α颗粒膜与PLT细胞膜融合,从而使P-selectin表达于血小板表面膜上。当组织受损或炎症侵袭时,IL等炎性介质诱导内皮细胞和PLT表面P-selectin表达升高,可促使炎症细胞与肠黏膜毛细血管内皮细胞形成粘连,在介导炎症细胞渗出至肠黏膜组织中起重要作用[26]。P-selectin表达水平也是PLT活化程度的标志,PLT活化可释放多种炎症因子,参与局部炎性反应,并导致白细胞向局部炎症累及部位趋化聚集,呈持续恶性循环[27-28]。有研究报道显示,活动期UC患者P-selectin水平明显高于健康人及缓解期患者,与疾病发展关系密切[29]。NO是具有多种生理和病理功能的自由基,在炎性反应发展过程中诱导型一氧化氮合酶(iNOS)可催化产生大量NO,NO与受体结合后引起肠道黏膜毛细血管舒张、血流淤积,引发微循环紊乱,PLT活化,导致和加重炎性反应,且UC病变黏膜中iNOS活性和NO浓度的增加与炎症程度呈平行关系[30]。有研究报道显示,活动性UC患者NO水平与PLT呈正相关,这提示NO与血小板聚集、血栓形成存在关联,NO参与了UC的病理生理过程,可作为临床判断UC患者病变严重程度的指标之一[31]。本研究结果显示,模型组大鼠血清P-selectin、NO水平较正常对照组均升高(P<0.05),提示PLT活化增强;阳性药物组、二神丸低剂量组、二神丸高剂量组经相应干预后血清P-selectin、NO水平较模型组均有下降趋势,其中阳性药物组、二神丸低剂量组、二神丸高剂量组血清NO水平和二神丸高剂量组P-selectin水平降低显著(P<0.05),提示二神丸能够降低血清P-selectin、NO水平,抑制PLT活化。
综上所述,二神丸对UC大鼠具有确切的保护和修复作用,其作用机制可能是通过减少炎症因子表达,降低局部炎性反应,降低PLT并抑制PLT活化,改善血液的高凝状态,从而改善结肠黏膜组织的炎性损伤,而起到治疗作用。但同时我们还应注意到,本研究中二神丸低、高剂量组对各指标的改善作用并没有呈现明显的剂量关系,分析其原因中药复方作用机制复杂,不同的药物浓度可能具有不同的疗效,有关二神丸治疗UC的最佳药物浓度和其他可能的作用机制仍有待进一步研究。

