四种天然有机添加物对印度梨形孢形态及生长的影响
陈明花,刘焕焕,陈丽娟,熊 翔,何 勇,田志宏
(长江大学生命科学学院/湿地生态与农业利用教育部工程研究中心/涝渍灾害与湿地农业湖北省重点实验室,湖北荆州 434025)
1998 年,印度梨形孢(Piriformospora indica)在印度沙漠土壤中首次被分离出[1],因孢子结构形似梨形,故称作印度梨形孢。印度梨形孢培养早期时为薄壁孢子,成熟后呈现为黄色、双膜厚壁孢子,细胞质内充满颗粒状的物质,一般含有8~25 个细胞核。除区别于丛枝菌根真菌(Arbuscular mycorrhizal fungi)的优势是可以用人工培养基纯培养[2-3]外,印度梨形孢在形态和功能上与丛枝菌根真菌均相似。印度梨形孢在早期与植物建立共生关系,具有显著改善宿主营养吸收的能力、促进植物生长等多种作用[4],效果显著、持续时间长,对环境非常安全[5]。印度梨形孢能促进水稻的生长发育[6],显著提高铁皮石斛的叶绿素含量和药用多糖含量[7]。李佳欢等探究了培养基种类、温度、pH 值、碳源、氮源和无机盐对印度梨形孢的影响,筛选出了一种比原MMN 培养基继代时间缩短近2 倍的人工合成培养基,平均生长速率达到1.808 3 cm·d-1[8]。观察微生物的形态和结构通常借助显微技术,陈安良等[9]和吴方丽等[10]利用扫描电镜和透射电镜技术观察到番茄灰霉病菌形态和超微结构有显著差异,El-Ganiny等[11]通过扫描电镜观察到烟曲霉菌各菌株的菌丝宽度、生长速度、菌丝分支情况和分生孢子数量不同。目前,关于印度梨形孢最佳培养基的研究有较多报道,但稀有利用天然有机添加物进行印度梨形孢的固体与液体培养,通过形态观察研究印度梨形孢的报道。本研究利用固体和液体两种培养方式,观察四种天然有机添加物对印度梨形孢形态和生长速度的影响,旨在筛选出适合印度梨形孢培养生长的天然有机添加物。
1 材料与方法
1.1 试验材料
天然有机添加物(芹菜、白菜、椰子、香蕉)均为从湖北荆州的菜市场购买,印度梨形孢为本实验室保存。
1.2 试验方法
1.2.1 培养基制备
固体培养基:以1/2 MS 为基本培养基,称取100 g·L-1天然有机添加物(芹菜、白菜、去皮香蕉切小段,椰子取椰子水),分别煮制20 min,冷却至室温,用8 层纱布过滤,加入1/2 MS 基本培养基中,用1 mol·L-1KOH 调节pH 值至5.8,加入8 g·L-1琼脂,于121 ℃、20 min条件下高压灭菌。
液体培养基:方法同固体培养基,不加琼脂。
1.2.2 在不同固体培养基中印度梨形孢的形态和生长速度
将印度梨形孢活化后,用直径5 mm 的打孔器打孔,获得均匀一致的含有印度梨形孢的菌饼。每个直径90 mm的平板培养基接入一个直径5 mm的菌饼,于28 ℃避光培养,分别观察印度梨形孢的菌斑、气生菌丝、菌丝体和孢子形态。借助正置显微镜观察并拍摄气生菌丝和孢子形态,测定接种后4、6、7、8、10 d的菌斑直径大小,用“生长速度=菌斑直径/培养时间”计算印度梨形孢菌斑生长速度,生长速度、菌斑直径、培养时间单位分别为cm·d-1、cm、d。
1.2.3 在不同液体培养基中印度梨形孢的形态和生长速度
将印度梨形孢活化后,用直径5 mm的打孔器打孔,获得均匀一致的含有印度梨形孢的菌饼。在盛装50 mL液体培养基的150 mL三角瓶内接入2个直径5 mm的菌饼,于28 ℃,200 r·min-1避光培养。分别从宏观和微观层面观察接种后7 d 印度梨形孢菌丝的菌落和孢子形态,借助正置显微镜观察和进行微观拍摄;产孢量采用血球计数板计数;离心去上清液,取沉淀物(菌丝体)称量鲜重,烘干(60 ℃、72 h)称量干重,测定用天平为万分之一精确天平。
1.3 数据分析
数据重复测定3 次。采用Excel 2019 收集并处理数据,用SPSS 26.0 进行方差分析,用Duncan 新复极差法分析不同组之间的差异显著性(显著性水平P<0.05),用Adobe Photoshop 2020处理图片。
2 结果与分析
2.1 不同添加物固体培养基对印度梨形孢形态和生长速度的影响
印度梨形孢在不同天然有机添加物的固体培养基中培养,菌斑和气生菌丝均有差异,无添加物和添加芹菜的培养基上可见稀疏透明的菌斑,而添加白菜、椰子水和香蕉的培养基上可见粘附性强的菌斑(见图1a)。
在正置显微镜下观察,相比于无添加物的培养基中的印度梨形孢气生菌丝,添加椰子水、香蕉和白菜的培养基中印度梨形孢气生菌丝分支最多、菌丝最密集,其中添加椰子水和白菜培养基中的气生菌丝比添加香蕉的细长,有部分气生菌丝弯曲现象,添加香蕉的培养基中气生菌丝最短小、粗壮、挺直。无添加物和添加芹菜的培养基中印度梨形孢气生菌丝细长且稀疏,均有部分气生菌丝弯曲现象,无添加物的培养基中的气生菌丝弯曲程度大于添加芹菜培养基(见图1a)。
不同添加物均能不同程度地促进印度梨形孢菌斑的生长(见图2a),培养7 d 时,相比于其他添加物,添加白菜和椰子水的培养基中印度梨形孢菌斑生长速度最高,分别为0.77、0.75 cm·d-1。
用接种后4、6、8、10 d 的菌斑直径绘制生长速度曲线(见图2b),可见在添加了不同有机物后,印度梨形孢生长速度有不同程度的提高,随培养时间增加,菌斑的生长速度有差异,其中以添加椰子水的培养基中印度梨形孢菌斑在不同时间内生长速度均为最高。总体而言,印度梨形孢菌斑的生长速度为添加椰子水>白菜>香蕉>芹菜>无添加物,椰子水、白菜及香蕉是比较适合印度梨形孢生长的添加物,印度梨形孢最适合在添加椰子水的固体培养基中培养。
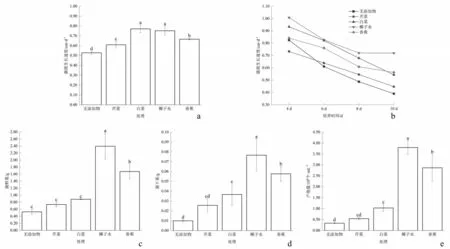
图2 印度梨形孢的生长指标
2.2 不同添加物液体培养基对印度梨形孢形态和生长速度的影响
印度梨形孢在不同添加物的液体培养基中培养,菌丝体和孢子均有差异(见图1b)。取接种后7 d液体培养基中的印度梨形孢观察菌丝体,发现无添加物和添加椰子水培养基中的菌丝体均呈现白色,其他添加物的培养基中菌丝体为褐色。相较于无添加物,在添加芹菜的培养基中印度梨形孢菌丝球大小不一,呈现海胆放射状;在添加椰子水的培养基中印度梨形孢菌丝体呈现圆而紧密的球状菌丝球,并且数量最多;添加白菜和香蕉的培养基中菌丝体介于海胆状和球状之间,菌丝球数量添加香蕉培养基中的比添加白菜培养基中的多,且多呈条状。取液体培养基培养的印度梨形孢观察孢子的形态,其中添加椰子水和香蕉培养基中的印度梨形孢的孢子形态分布情况是孢子在液体培养基原浓度下稀释10倍获得的,其他培养基的孢子分布情况不经过稀释。观察发现,五种培养基均含有印度梨形孢成熟的厚垣孢子。添加椰子水、白菜、香蕉培养基中的孢子圆润,大小均匀一致,添加椰子水的培养基中孢子数量最多;添加芹菜的培养基含有少量典型特征的梨形孢子;无添加物的培养基中的孢子大小不一,含有大量小孢子。

图1 在固体培养基和液体培养基上印度梨形孢的形态
不同添加物均能不同程度地促进印度梨形孢的生长。印度梨形孢的菌鲜重在添加椰子水的培养基中最大,为2.396 g,添加香蕉的培养基其次,为1.673 g,添加白菜、芹菜、无添加物的培养基最小且之间没有差异(见图2c);干重在添加椰子水培养基中最大,为0.077 g,添加香蕉的培养基其次,为0.058 g,添加白菜、芹菜的培养基较小且之间没有差异,无添加物的培养基最小(见图2d);产孢量在添加椰子水的培养基中最大,为3.8×106个·mL-1,添加香蕉的培养基其次,为2.87×106个·mL-1,添加白菜、芹菜的培养基较小且之间没有差异,无添加物的培养基最小(见图2e),表明印度梨形孢最适合在添加椰子水的培养液中生长。
3 讨论与结论
由于天然有机添加物富含氨基酸、生长调节剂、酶和其他有机物,影响印度梨形孢培养的生长速度,而天然有机添加物获取方便、价格便宜,因此通过筛选适宜的天然有机添加物来促进印度梨形孢的培养成为可能。本试验结果,添加白菜,在固体培养基中印度梨形孢的生长速度大于添加香蕉培养基,但在液体培养基中印度梨形孢的菌鲜重、产孢量、菌干重均小于添加香蕉培养基,原因不明,这或许是由于印度梨形孢在固体培养基上产生菌丝速率不同[12]。Lu 等认为多个凝聚的孢子只能形成一个菌丝球,一方面降低了成球率,另一方面由于其直径较大的菌丝球中心形成致密区,隔绝了液体培养基中的营养物质和氧气的接触和有效转化,最终降低了菌体的转化速率[13]。金赛等通过在液体培养基中添加有机颗粒玉米粒和振荡分散两种方法显著减低黑曲霉菌丝球聚集,调控了形态均一性,同时研究发现,无论种子培养基中是否含有颗粒物,分散的发芽孢子均能形成大量的小菌丝球,进而提高成球率和产柠檬酸速率[14]。在本研究中,只有添加香蕉培养基发酵液呈稀释的果冻状,这个差异可能起到了分散孢子间的聚集作用,最终导致添加香蕉培养基中存在大量的小菌落和较大的干重、鲜重和孢子数。本试验采用的去皮香蕉,对促进印度梨形孢生长的效果仅次于椰子水,表明去皮香蕉是促进印度梨形孢生长的备选天然物。
在固体培养基中,添加椰子水的印度梨形孢菌丝密集、细长、分叉多,菌斑生长速度最快,表明椰子水最适合印度梨形孢的生长;在液体培养基中,添加椰子水的印度梨形孢菌落圆润、紧密,形成大小一致的菌丝球,鲜重、干重、产孢量最大,分别为2.396 g、0.077 g、3.8×106个·mL-1。微生物利用单糖和二糖,桂青等研究表明,椰子水在椰子中含糖量最高,其中主要为蔗糖、果糖和葡萄糖[15],这可能是本试验的印度梨形孢在添加椰子水的培养基中比在其余四种培养基中生长更好的原因,另外值得一提的是,椰花序汁含有蔗糖,椰肉含有不同糖类,也可能成为印度梨形孢培养基的备选天然有机添加物。El-Ganiny 等研究发现,缺陷型烟曲霉菌菌株的分生孢子不能在作为唯一碳源的半乳糖上形成菌落,种类多样的糖类可能有利于微生物糖类的利用,而椰子含有的丰富糖类或许是印度梨形孢最佳培养基的候选天然有机添加物[11],这或将有利于提高椰子的利用价值。该研究观察到菌丝和孢子的差异,但未观察超微结构的差距,有待借助扫描电镜进一步观察菌丝宽度、细胞长度等的差异,借助透射电镜观察细胞核、线粒体、内质网等细胞器结构和细胞壁厚度。潘越等检测到斑玉蕈随培养时间的延长,发酵液的pH 值和电导率均升高,还原糖含量降低[16],这表明蔗糖被利用了。本试验使用的四种天然添加物成分复杂,例如添加物中的糖类种类及其含量的差异可能在培养过程中被印度梨形孢利用的程度会有差异,进而影响发酵液的pH、电导率和还原糖等,是否会间接反作用印度梨形孢的生长,有待进一步验证。
印度梨形孢菌斑的生长速度依次为添加椰子水>白菜>香蕉>芹菜>无添加物,鲜重、干重、产孢量均为椰子水>香蕉>白菜>芹菜>无添加物,说明菌斑生长速度和其鲜重、干重、产孢量大小基本一致。本研究结合菌落直径与鲜重、干重、产孢量生长指标,全面地反映了印度梨形孢的生长情况,也回答了菌落直径与其生物量和产孢量相关的问题[8]。
综合固体培养基和液体培养基,添加椰子水对印度梨形孢的形态和生长影响显著,椰子水是在五种培养基中最适合印度梨形孢生长的添加物,本结论可为天然有机添加物对印度梨形孢生长的影响提供理论依据。

