土壤酸度及铝胁迫对接种AMF茶苗活性氧代谢的影响
胡方洁 翟秀明 邓敏 杨海滨 盛忠雷

摘 要 为了研究接种丛枝菌根真菌(Arbuscular mycorrhiza fungi,AMF)摩西球囊霉(Glomus mosseae)的茶苗在土壤酸度及铝复合胁迫下,茶苗叶片超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性的变化特征,探索不同梯度酸铝胁迫下AMF对茶树的保护机制,以1年生盆栽茶苗为试验材料,向盆土中接种丛枝菌根真菌,通过不同浓度配比的酸、铝复合条件对其进行胁迫,测定其在胁迫下的叶绿素荧光参数,以评估其对酸铝胁迫的耐受能力。结果表明:1)在各种水平的酸铝胁迫下,接种AMF茶苗叶片的SOD、POD活性均高于空白处理;2)酸、铝这两种胁迫因子分别对接种AMF茶苗叶片POD活性都有明显影响,其中当土壤铝浓度达到0.48 g·kg-1时,影响达到极大(P<0.05);3)土壤铝含量高低显著影响了茶苗叶片的CAT活性;4)铝胁迫显著影响了茶叶的SOD活性(P<0.05),茶苗叶片SOD活性随着铝浓度增高呈现增大的趋势;5)在T1铝浓度处理下不同土壤酸性茶苗茶叶SOD、POD、CAT活性变化趋势相同,呈现先降低再升高的趋势;6)酸铝胁迫环境下,AMF能够促进茶苗抗氧化酶保护系统的SOD、CAT和POD酶活性不同程度地提高,加强体内活性氧代谢,调节生理活性,提高茶苗的耐酸和耐铝能力。
关键词 丛枝菌根真菌(AMF);摩西球囊霉;茶苗;酸铝胁迫;抗氧化酶保护系统
中图分类号:S571.1;S19 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2022.09.004
收稿日期:2022-02-21
基金项目:财政部和农业农村部国家现代农业产业技术体系;重庆市现代山地特色高效农业茶叶产业技术体系创新团队(2021);重庆市自然科学基金项目(cstc2019jcyj-msxmX0547);重庆市永川区自然科学基金计划(Ycstc,2019nb0104)。
作者简介:胡方洁(1989—),女,四川泸县人,硕士,助理研究员,主要从事茶园生态栽培研究。E-mail: 574762949@qq.com。
*为通信作者,E-mail: mindeng111@she163.com。
茶树[Camellia sinensis (Linn.) O. Kuntze],多年生经济作物,具有一定耐铝聚酸的特性。当前,酸雨影响及化肥施用不合理等原因导致茶园土壤酸化问题日益严重,西南茶区在不同pH值区段内土壤酸化特征明显,并呈现日趋严峻态势。土壤过度酸化和活性铝富集过量,会加速土壤营养元素流失,降低土壤的盐基饱和度、阳离子交换量,减少茶树根际有益微生物种群数量,抑制土壤中微生物的活性,影响植物根系发育和对养分的吸收。而我国南方红黄壤具有脱硅富铝化成土过程,Al2O3含量高,交换性Al3+占阳离子交换量的20%~80%,pH值4.5~6.0[1]。酸雨和铝毒被认为是南方地区农作物减产的重要原因之一。目前,学界关于铝胁迫对茶树的影响研究主要集中在茶叶的生长发育、养分变化、铝含量、叶绿素荧光等方面[2-3],抗氧化酶保护系统的酶活性研究有少量报道[4-5],而对于酸铝复合胁迫下茶苗的活性氧代谢研究鲜有报道。
丛枝菌根真菌(Arbuscular mycorrhiza fungi,AMF),可提高植物在酸化、盐碱、洪涝、干旱等胁迫下的抗性,提高植物在逆境下的生存能力[6-7]。摩西球囊霉(Glomus mosseae)是目前國内外研究中采用较多的一种模式菌株。摩西球囊霉提高了拂子矛属红丁香(Calamagrostis villosa)和曲芒发草(Deschampsia flexuosa)耐酸性[8-9]。接种AMF能活化难溶态磷,提高土壤有效磷的含量,改善紫花苜蓿在酸性土壤中的生存环境[10]。AMF能够提高植物抗逆性的研究已得到证实,但接种AMF茶树的抗氧化酶保护系统对酸铝胁迫的响应机制尚不清楚。因此,研究酸铝胁迫对接种AMF茶苗抗氧化酶系统的影响,探究AMF摩西球囊霉在茶树酸铝胁迫过程中发挥的作用,以及AMF摩西球囊霉提高茶植株耐酸铝胁迫的保护机制,可为缓解茶树酸铝胁迫寻找方法,对改善西南茶园土壤酸化问题有重要的理论和现实意义。
1 材料与方法
1.1 试验地点
试验地位于重庆市农业科学院茶叶研究所试验基地(永川区茶山竹海),东经105°53′、北纬29°23′,海拔610 m,气压94 500 Pa,年平均气温17.9 ℃,降雨量1 034.9 mm。
1.2 试验材料
1)供试植株选取生长健壮、长势一致的1年生无性系茶苗,品种为“福鼎大白”。2)AMF摩西球囊霉,由北京市农林科学院植物营养与资源研究所“丛枝菌根真菌种质资源库”提供。3)盆栽容器为塑料盆,上口内径41 cm、下口内径27 cm、盆深31 cm,基质为6∶4的泥炭土和茶园原土,重量16 kg·盆-1。
1.3 试验方法
1.3.1 酸、铝胁迫试验设置
采取盆栽法,将复合肥和AlCl3·6H2O混匀拌入基质并装入盆中,设4个土壤酸度胁迫:pH3.5、pH4.0、pH4.5、pH5.0,土壤pH值调节参考陈雪娇等[11]的方法。每种土壤酸度下再设置5个铝浓度梯度(T1、T2、T3、T4、T5),土壤铝的含量分别为:0、0.06、0.12、0.24、0.48 g·kg-1;空白设置1个处理:不接种丛枝菌根真菌、不设置酸铝胁迫。共计21个处理,每个处理设置3个重复,每个重复1盆,每盆栽种长势一致的茶苗5株,共计63盆。
1.3.2 茶苗叶片抗性指标活性测定
试验于2020年10月进行,定植1个月后在盆栽土壤中接种扩繁的摩西球囊霉,之后1周开始胁迫试验。试验期间,每隔10 d施加对应的处理液以保持相应酸铝浓度。分别在胁迫后的120 d时,每盆固定选取当年生芽下第3片健康成熟叶片进行测定。所有指标测定均重复3次。
过氧化物酶(POD)采用酶标法测定[12-13],每克组织(鲜重)在每毫升反应体系中每分钟A470变化0.05为1个酶活力单位。
过氧化氢酶(CAT)采用钼酸铵比色法测定[14],以每克组织(鲜重)每分钟催化1 μmol H2O2降解定义为1个酶活力单位。
超氧化物歧化酶(SOD)采用酶标法测定[15],以每克组织(鲜重)在黄嘌呤氧化酶偶联反应体系中抑制百分率为50%时的SOD酶活力定义为1个酶活力单位。
1.4 数据处理
试验数据采用Microsoft Excel 2013软件进行数据统计并作图,利用SPSS 22.0软件进行单因素方差分析(One-way ANOVA),用LSD法进行多重比较。
2 结果与分析
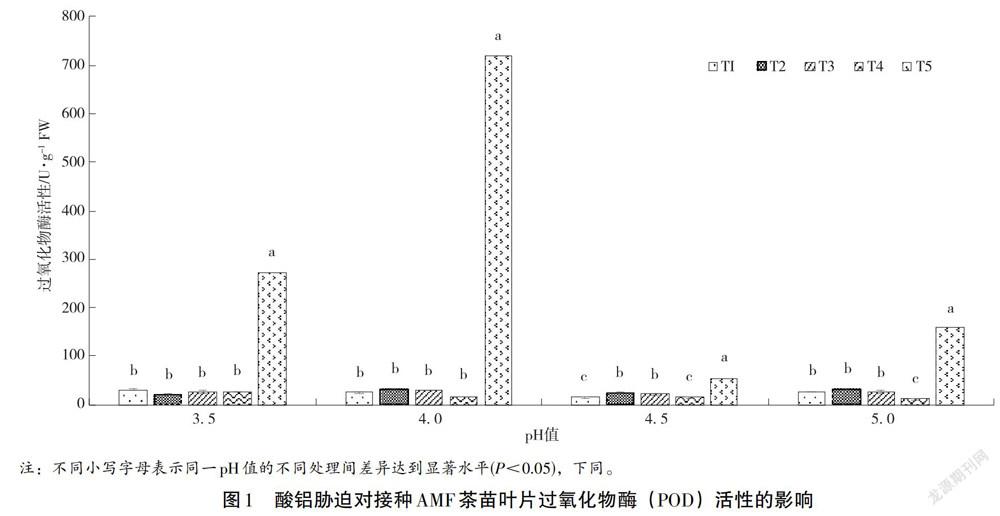
2.1 酸铝胁迫对茶苗POD活性的影响
POD作为植物抗逆境保护体系中一种适应性酶,在防御细胞膜过氧化、降低细胞受伤害程度中发挥重要作用。在酸铝胁迫下,茶苗叶片中POD活性存在较大差异。本研究中,空白处理下的茶叶POD活性为11.06 U·g-1FW,接种过AMF的茶苗叶片POD活性均高于空白组。从图1可以看到随着土壤pH值从3.5升高5.0时,在相同的铝浓度T1处理下,茶苗叶片中POD活性呈现出先下降再升高的趋势,其中在pH值为4.5时,此时POD活性显著低于其余三种pH处理(P<0.05);在铝浓度T2处理下,POD活性在土壤pH值为3.5时最低;在铝浓度T3处理下,POD活性在土壤pH值为4.5时最低;在铝浓度T4处理下,POD活性在土壤pH值为5时最低;在铝浓度T5处理下,POD活性随着土壤酸性降低呈现先增大后减小,其中在土壤pH值为4.5时最低。而在相同土壤酸度条件下,POD活性受铝胁迫的程度差异较大。在T1、T2、T3、T4处理下,POD活性均远远小于T5水平,差异显著(P<0.05)。除T1处理外,T2、T3、T4、T5处理下POD活性随着土壤酸性下降均呈现出先略有升高再降低最后大幅升高的趋势。由此说明,酸、铝这两种胁迫因子分别对茶苗叶片POD活性都有明显影响,其中当土壤铝浓度达到0.48 g·kg-1时,影响达到极大(P<0.05);而酸胁迫在3.5~4.0的范围时对茶苗叶片POD活性影响最大。
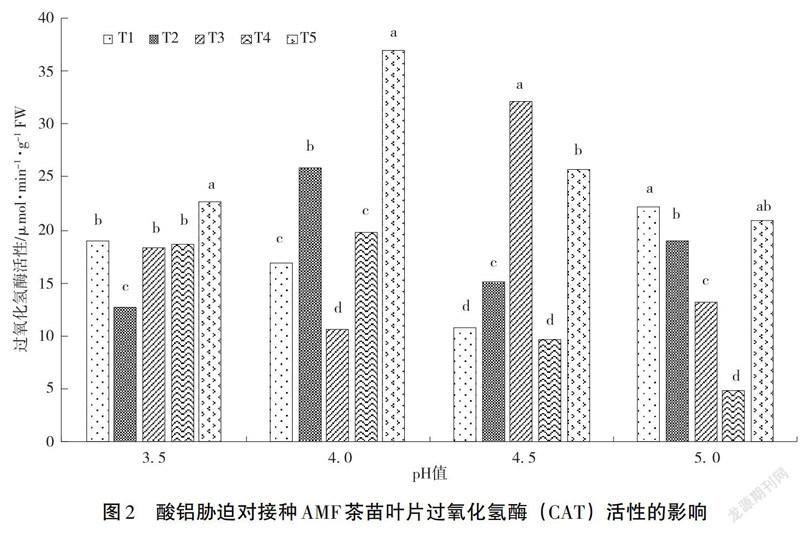
2.2 酸铝胁迫对茶苗CAT活性的影响
CAT是植物体内的一种抗逆境胁迫的氧化还原酶,能维持活性氧代谢的平衡状态。本研究中,空白处理的茶苗叶片的CAT活性为16.12 μmol·min-1·g-1FW。从图2看出接种AMF后,随着土壤酸性和铝含量的增加,茶苗叶片的CAT活性发生了明显的变化。其中,在T1和T4处理下,当土壤pH值逐步增大时,CAT活性表现出逐步降低然后再升高的趋势;而T2和T3处理下,CAT活性表现的规律呈现相反的趋势;而在T5处理下,CAT活性则呈现先升高后降低的趋势。从图2得出,pH值在3.5和4.0时,在最高浓度的铝胁迫下CAT活性达到最大,显著高于其余的4个处理(P<0.05);pH值在4.5时,T3处理下的CAT活性达到最大,显著高于另外4个处理(P<0.05);pH值在5.0时,T1处理下的CAT活性达到最大。从图2还可以得知,当土壤pH值在4.0且土壤铝含量在0.48 g·kg-1时,CAT活性最大,显著高于其余处理(P<0.05);而在当土壤pH值在5.0且土壤铝含量在0.24 g·kg-1时,CAT活性最小,显著低于其余处理(P<0.05)。综上可见,在土壤酸性较强的情况下,土壤铝含量高低显著影响了茶苗叶片的CAT活性,表现为高浓度的铝胁迫显著提高了茶苗叶片的CAT活性;在土壤酸性较弱的情况下,高浓度的铝胁迫对茶苗叶片的CAT活性影响程度低于低浓度铝胁迫。
2.3 酸铝胁迫对茶苗SOD活性的影响
逆境中,SOD可以清除植物受胁迫产生的多余O2·-,并将活性氧歧化反应成H2O和O2来维持细胞体正常的生理[16]。本研究中空白处理茶叶SOD活性值为151.13 U·g-1FW,均低于接种AMF处理。从图3得知接种AMF后,土壤的pH值和铝含量对茶苗茶叶的SOD活性有着十分重要的影响。在T1和T2处理下,SOD活性随着土壤酸性的降低呈现先下降再逐步升高的趋势;在T3处理下,SOD活性在土壤pH值为4.0时达到最大;在T4处理下,SOD活性在土壤pH值为4.5时达到最大;在T5处理下,SOD活性在土壤pH值為3.5时达到最大。而在不同土壤pH值影响下,SOD活性均随着土壤铝浓度的增加呈现增大趋势,其中pH值为3.5、4.0、5.0时,SOD活性均在最高浓度铝胁迫下达到最大,显著高于另外4个处理(P<0.05)。综上可见,铝胁迫显著影响了茶叶的SOD活性(P<0.05),随着土壤铝浓度增高茶苗叶片SOD活性随之增大的趋势;而酸胁迫对茶叶的SOD活性有一定程度的影响,但影响趋势规律不明显。
3 结论与讨论
抗氧化酶保护系统由SOD、CAT和POD等抗氧化酶组成[17]。在逆境下,植物会通过调动抗氧化酶保护系统来对抗胁迫,它们在植物体内协同作用下清除体内的超氧阴离子自由基、羟自由基和过氧化氢来减少活性氧累积,防止膜质过氧化,减轻细胞膜的损伤,降低了细胞内膜系统的破坏程度,其活性的高低可以衡量植物对胁迫的耐受程度[18-20]。相关研究表明,植物SOD在抵御单一金属胁迫时能起到一定的保护作用,表现出随着金属浓度的提高,SOD活性呈先升后降趋势[21-22]。本研究中,pH值为4.5时,茶苗叶片SOD活性随着土壤铝含量的增加呈先升后降趋势,这与曹林等[16]、李西等[23]研究趋势相似。当pH值为3.5、4.0、5.0时,此时茶苗叶片SOD活性随着土壤铝含量的增加几乎呈一直增大趋势,出现这种趋势的原因可能是本研究中的铝胁迫浓度还远未达到茶苗的最大耐受性。罗亮等[4]研究发现低浓度的铝处理(10 mg·L-1)促进茶树POD、CAT活性增加,而高浓度的铝处理(100 mg·L-1)降低POD、CAT活性。本研究中,不同pH值下茶苗POD活性均在土壤铝含量为0.48 g·kg-1时达到最大值,原因可能是丛枝菌根真菌减弱了茶苗受到酸铝2个因子胁迫的程度,进而导致POD活性得到进一步提升,在同一水平的酸胁迫下茶苗叶片POD活性随铝浓度增大呈现先降低再升高再降低的趋势,这与叶锦培等[5]的研究结果十分相似;Cakmak等发现,大豆根中的CAT活性在铝胁迫下呈下降趋势[17],而叶锦培等发现随铝浓度增大,茶苗叶片CAT活性表现为先降低再升高再降低再升高[5]。本研究中,在pH值为3.5和4.0较强酸性的胁迫下,茶苗叶片CAT活性在铝胁迫增大下呈先增大的趋势,而且效果明显;在pH值为4.5时,茶苗叶片CAT活性在铝胁迫下的变化趋势与叶锦培等的研究结果一致。丛枝菌根真菌与部分植物构成互惠共生体系,促进了宿主植物在逆境中的存活与生长,提高了植物的抗胁迫能力。覃圣峰等的研究结果显示,AMF能促进玉米在酸性土壤中生长,增强玉米耐铝性[24]。张爽等认为在一定的铝胁迫条件下,接种丛枝菌根真菌能提高植物的抗铝毒能力,还能缓解和改善过酸对植物的毒害,这可能是丛枝菌根真菌利用菌根侵染结构丰度的改变忍耐酸铝毒害[25]。李信茹等的研究发现,接种丛枝菌根真菌后,水稻叶片SOD、POD、CAT活性均升高[26]。沈亚琴等[27]的研究结果也证实,丛枝菌根真菌能有效增加水稻叶片SOD、POD、CAT的活性,进而提高植物抗氧化酶系活性来缓解重金属毒害作用,增强植物抗逆性。从本研究的结果来看,在茶苗接种AMF后,茶苗叶片抗氧化酶保护系统的SOD和POD活性相比对照得到不同程度的提高;多数处理中,CAT活性也较对照有明显提高,在较强酸胁迫时茶苗叶片SOD、CAT和POD活性比较弱酸胁迫时高,在较高浓度或高浓度铝胁迫时茶苗叶片的SOD、CAT和POD活性也比低浓度时高,这表明接种AMF后在一定程度上能提高茶苗的酸、铝耐受性。
接种AMF后茶苗对逆境胁迫的耐受性有一定提高。本文仅对抗氧化酶保护系统的部分酶活性进行研究分析,下一步将对接种AMF茶苗的生长特征如株高、地径、叶面积、生物量、叶绿素荧光及光合作用等方面进行分析,以期更深刻、更全面地阐述AMF提高茶苗耐受酸铝胁迫的机制。
参考文献:
[1] 李庆逵.中国红壤[M].北京:科学出版社,1983.
[2] 李海生,张志权.不同铝水平下茶对铝及矿质养分的吸收与累积[J].生态环境,2007(1):186-190.
[3] 钟秋生,林郑和,郝志龙,等.氟铝互作对茶树叶片叶绿素荧光特性的影响[J].茶叶科学,2019,39(5):537-546.
[4] 罗亮,谢忠雷,刘鹏,等.茶树对铝毒生理响应的研究[J].农业环境科学学报,2006(2):305-308.
[5] 叶锦培,李晓丽,唐世斌,等.铝处理对六堡茶苗抗性生理和DNA甲基化水平的影响[J].山东农业科学,2020,52(4):112-116.
[6] 夏庭君,文雅.不同丛枝菌根真菌(AMF)对茶树生长及耐盐性的影响探究[J].南方农业,2017,11(26):71,75.
[7] 李娇娇,曾明.丛枝菌根对植物根际逆境的生态学意义[J].应用生态学报,2020,31(9):3216-3226.
[8] 孙吉庆,刘润进,李敏.丛枝菌根真菌提高植物抗逆性的效应及其机制研究进展[J].植物生理学报,2012,48(9):845-852.
[9] 邱雅静.酸性胁迫下接种AM真菌对榉树生理和生长的影响[D].杭州:浙江农林大学,2020.
[10] 和玉吉.丛枝菌根真菌提高紫花苜蓿耐铝性机理研究[D].重庆:西南大学,2016.
[11] 陈雪娇,韩航,侯晓龙,等.水土保持植物类芦对土壤酸胁迫的形态生理响应[J].草业学报,2017,26(4):143-149.
[12] Reuveni R, Shimoni M, Karchi Z, et al. Peroxidase Activity as a Biochemical Marker for Resistance of Muskmelon (Cucumis melo) to Pseudoperonospora cubensis[J].Phytopathology,1992,82(7):749-753.
[13] Doerge D R, Divi R L, Churchwell M I. Identification of the Colored Guaiacol Oxidation Product Produced by Peroxidases[J].Analytical Biochemistry,1997,250(1):10-17.
[14] 彭建,王丹英,徐春梅,等.钼酸铵法测定水稻过氧化氢酶活性[J].中国农学通报,2009,25(16):61-64.
[15] Ukeda H, Kawana D, Maeda S, et al. Spectrophotometric Assay for Superoxide Dismutase Based on the Reduction of Highly Water-soluble Tetrazolium Salts by Xanthine-Xanthine Oxidase[J]. Journal of the Agricultural Chemical Society of Japan,1999,63(3):485-488.
[16] 曹林,马丽,吴玉环,等.菊芋对酸铝复合胁迫的生理响应[J].生态环境学报,2016,25(2):233-240.
[17] CAKMAK I, HORST W J. Effect of aluminum on lipid peroxidation, superoxide dismutase, catalase, and peroxidase activities in root tips of soybean (Glycine max)[J].Physiologia Plantarum,1991,83(3):463-468.
[18] Li Z, Zhou H, Peng Y, et al. Exogenously applied sper-midine improves drought tolerance in creeping bentgrass as-sociated with changes in antioxidant defense, endogenous polyamines and phytohormones[J].Plant Growth Regulation,2015,76(1):71-82.
[19] Fazeli F, Ghorbanli M, Niknam V. Effect of drought on biomass, protein content, lipid peroxidation and antioxidant enzymes in two sesame cultivars[J].Biology Plantarum, 2007(1):98-103.
[20] 朱诗苗,宋杭霖,张丽,等.铅胁迫对烟草生长及生理生化指标的影响[J].植物生理学报,2018,54(3):465-472.
[21] 黄亚萍,俎丽红,沈广爽,等.铅胁迫对蜀葵重金属积累及抗氧化酶活性的影响[J].农业环境科学学报,2017,36(9):1746-1752.
[22] 秦仕华,宋晓慧,陆引罡.镉胁迫对烤烟抗氧化酶系统的影响[J].现代农业科技,2017(16):25-26,34.
[23] 李西,吴亚娇,孙凌霞.铅胁迫对三种暖季型草坪草生长和生理特性的影响[J].草业学报,2014,23(4):171-180.
[24] 覃圣峰,杨怡森,马俊卿,等.酸性土壤条件下接种丛枝菌根真菌缓解铝对玉米生长抑制作用的研究[J].江苏农业科学,2022,50(2):59-66.
[25] 张爽,廖红,王秀荣.不同叢枝菌根真菌对大豆耐酸、铝能力的影响[J].中国油料作物学报,2014,36(5):616-622.
[26] 李信茹,苏海磊,周民,等.丛枝菌根真菌对汞胁迫下水稻叶片生理和光合特性的影响[J].环境科学研究,2021,34(8):1918-1927.
[27] 沈亚琴,魏源,陈志鹏,等.锑胁迫下丛枝菌根真菌对玉米生长与锑吸收及抗氧化酶的影响[J].环境科学研究,2017,30(5):712-719.
(责任编辑:敬廷桃)

