水榆花楸中3种活性物质的提取工艺优化
姚远 李占君 贾凯慧 杨逢建


摘 要:为探究水榆花楸中绿原酸、芦丁、金丝桃苷3种活性物质的最佳提取工艺,为其他化学成分提取提供参考依据,以水榆花楸叶片为原料,以表面活性剂十二烷基硫酸钠水溶液为溶剂,采用超声辅助提取法提取绿原酸、芦丁、金丝桃苷3种活性物质,对超声功率、超声时间、超声温度、液料比和提取溶剂质量分数进行单因素试验,根据试验结果设计Box-Behnken响应面法优化提取工艺并进行验证。结果表明,最佳提取工艺为超声功率405 W、超声时间 40 min、超声温度60 ℃、液料比20∶1(mL/g)、提取溶剂质量分数2%,该条件下绿原酸、芦丁、金丝桃苷3种活性物质得率分别为2.13%±0.06%、0.54%±0.02%、0.19%±0.02%,与理论预测值2.14%、0.54%、0.19%一致。相比索氏提取法,超声辅助法提取水榆花楸中3种活性物质得率略有提高,优化所得提取工艺具有高稳定性、高得率等特点,应用前景较好。
关键词:水榆花楸;活性物质;十二烷基硫酸钠;超声辅助提取;响应面法
中图分类号:TQ645.1 文献标识码:A 文章编号:1006-8023(2022)03-0087-08
Optimization of Extraction Process of Three Active Substances
from Sorbus alnifolia
YAO Yuan1, LI Zhanjun2, JIA Kaihui1, YANG Fengjian1*
(1.Key Laboratory of Forest Plant Ecology, Ministry of Education, Northeast Forestry University, Harbin 150040, China;
2.Yichun Branch of Heilongjiang Academy of Forestry, Yichun 153000, China)
Abstract:In order to study the extraction technology of chlorogenic acid, rutin and hyperin from the leaves of Sorbus alnifolia, and provide reference for the extraction of other chemical components, the leaves of Sorbus alnifolia were used as raw materials, and the surfactant sodium dodecyl sulfate aqueous solution was used as solvent to extract three active substances, chlorogenic acid, rutin and hyperin by ultrasonic assisted method. Based on five single factor experiments of ultrasonic power, ultrasonic time, ultrasonic temperature, liquid-material ratio and mass fraction of extraction solvent, the Box-Behnken response surface method was designed to optimize the extraction process and verified. Results showed that: the optimum process parameters were determined as follows: ultrasonic power 405 W, ultrasonic time 40 min, ultrasonic temperature 60 ℃, liquid-solid ratio 20∶1(mL/g), extraction solvent mass fraction 2%. The yields of chlorogenic acid, rutin and hyperin were 2.13%±0.06%, 0.54%±0.02% and 0.19%±0.02%, which was consistent with the theoretical predicted values of 2.14%, 0.54% and 0.19%. Compared with Soxhlet extraction, the yield of three active substances in Sorbus alnifolia was slightly improved. The optimized extraction process has the characteristics of high stability and high yield, and has a good application prospect.
Keywords:Sorbus alnifolia; active substance; sodium dodecyl sulfate; ultrasonic assisted extraction; response surface method
0 引言
水榆花楸(Sorbus alnifolia),別名黄山榆、花楸、枫榆、千筋树和黏枣子等,为蔷薇科(Rosaceae)花楸属(Sorbus)落叶乔木,主要分布在我国长江流域、黄河流域和东北中南部,生长于环境湿润的山坡、山沟或山顶混交林或灌木丛中。水榆花楸树干通直,高可达20 m;小枝圆柱形,冬芽卵形,先端急尖,外具数枚暗红褐色无毛鳞片;叶片呈卵形或椭圆卵形,先端短渐尖,侧脉直达叶边齿尖;叶柄无毛或微具稀疏柔毛;树冠圆锥形,秋季叶片转变成猩红色,为美丽观赏树。因其形态高大且具观赏价值,常被种植用来美化环境[1]。17589BAA-E2B5-40FB-90F3-838AB5FB2438
近年来,花楸属植物的药用价值逐步受到关注[2],主要是因为其枝叶、花、果实种子含有较丰富的黄酮类化合物及多种活性物质,其中绿原酸、芦丁和金丝桃苷等活性物质具有清热解毒、消炎、降低胆固醇、抗肿瘤和抗氧化等功效,在药物研发方面有重要价值[3-7]。现阶段,对花楸属植物的研究主要是从黑果腺肋花楸(Aronia melanocarpa)和百华花楸(Sorbus pohuashanensis)果实中提取黄酮类物质,关于水榆花楸的活性物质提取分离、结构鉴定等鲜见报道。
超声辅助提取是在溶剂萃取法基础上发展起来的一种新兴萃取工艺,其克服了蒸气蒸馏法、索式提取法和回流提取法等传统提取方法工序繁杂、耗时长和损失大[8]等不足,具有成本低、操作简便和得率高等特点[9-10],绿原酸、芦丁和金丝桃苷等活性物质在植物或药物中主要采用有机溶剂直接提取或超声辅助提取[11-14]。表面活性剂是近年来兴起的提取溶剂,其能够降低液体表面张力且具有特殊的两亲分子结构,相比有机溶剂可更大程度使提取物质溶解在溶液中,有效提高提取效率[15-18]。鉴于此,本研究以水榆花楸叶片为原料,以表面活性剂十二烷基硫酸钠(Sodium Dodecyl Sulfate,SDS)水溶液为溶剂,采用超声辅助法提取绿原酸、芦丁和金丝桃苷3种活性物质,对超声功率、超声时间、超声温度、液料比和提取溶剂质量分数进行单因素试验,根据试验结果设计Box-Behnken响应面法优化提取工艺并进行验证,旨在探究水榆花楸中绿原酸、芦丁和金丝桃苷3种活性物质的最佳提取工艺,为其他化学成分提取提供参考依据。
1 材料与仪器
1.1 材料与试剂
水榆花楸叶片采自东北林业大学校园内并经专家鉴定;绿原酸、芦丁、金丝桃苷标准品,纯度大于等于90%,上海源叶生物科技有限公司;超纯水,实验室自制;磷酸分析纯,天津天力化学试剂有限公司;色谱级乙腈和甲醇,SK公司;十二烷基硫酸钠(SDS),天津百伦斯生物技术有限公司。
1.2 仪器
高效液相色谱仪,型号1260,美国安捷伦公司;电子分析天平,型号UH620H,日本SHIMADZU岛津;医用离心机,型号H1650,长沙市高新技术产业开发区湘仪离心机器有限公司;数控超声清洗机,型号JP-100ST,深圳市洁盟清洗设备有限公司;电热恒温鼓风干燥箱,型号DHG-9145A,上海一恒科技有限公司;80目标准筛。
2 试验方法
2.1 供试品溶液制备
水榆花楸叶片置于50 ℃干燥箱内干燥24 h,粉碎获得80目粉末备用。精确称取1.0 g粉末于50 mL离心管中,加入20 mL,2%十二烷基硫酸钠水溶液,在不同超声功率、超声时间和超声温度条件下制备提取液并冷却至室温,10 000 r/min高速离心10 min,取0.25 mL上清液加入0.75 mL甲醇稀释4倍后即为供试品溶液。
2.2 液相色谱条件
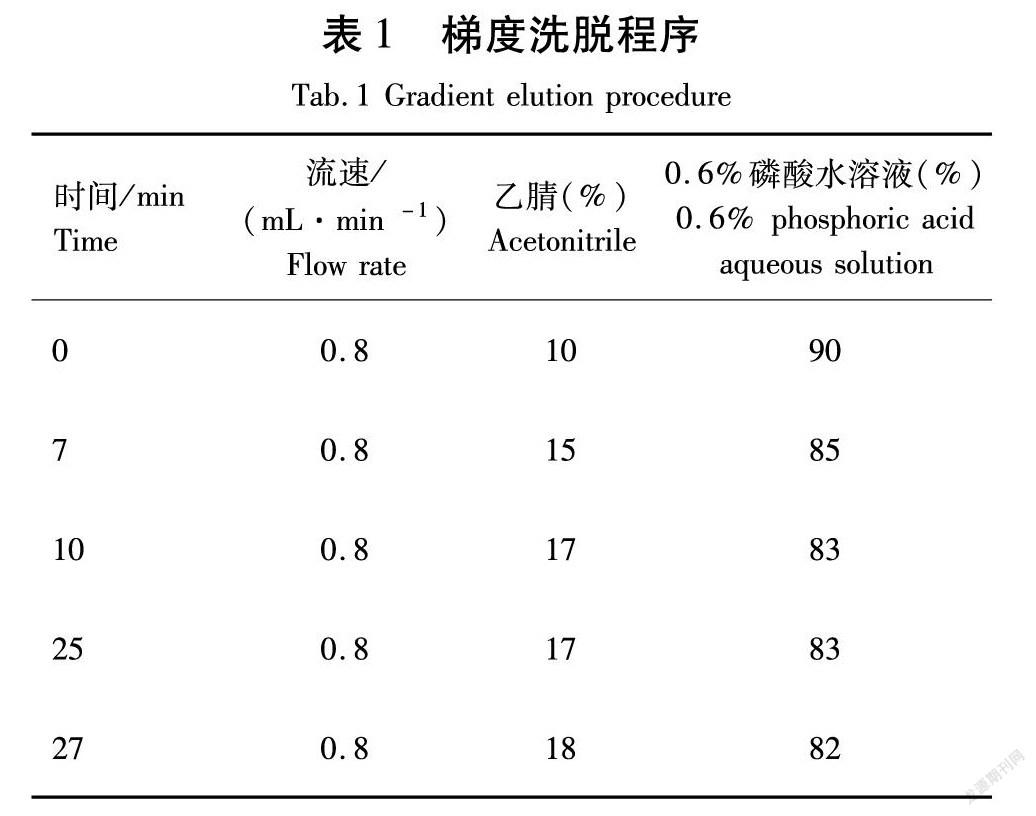
Diamonsil-C18色谱柱(4.6 mm×250 mm×5SymbolmA@m)。绿原酸、芦丁、金丝桃苷检测条件:流动相A为乙腈,流动相B为0.6%磷酸水溶液,柱温30 ℃,检测波长360 nm;流速0.8 mL/min;进样量20 μL;梯度洗脱,洗脱程序见表1[19]。
2.3 标准曲线建立
将绿原酸、芦丁、金丝桃苷标准品分别溶于甲醇中,得到质量浓度为1 mg/mL的标准母液,用甲醇将母液依次稀释成6.25、12.5、25、50、100、200 μg/mL标准溶液。应用高效液相色谱法测定,以标准品质量浓度为横坐标、以峰面积为纵坐标绘制标准曲线,并进行回归分析,最终得到绿原酸的回归方程为y=3 726.9x+21.567(R2=0.999 1),线性范围6.25~200 μg/mL;芦丁的回归方程为y=4 484.8x-74.247(R2=0.999 5),线性范围6.25~200 μg/mL;金丝桃苷的回归方程为y=5 937.6x-131.68(R2=0.999 0),线性范围6.25~200 μg/mL。标准品及样品色谱如图1所示。
2.4 供试品得率测定
将供试品溶液测得峰面积代入标准曲线,分别计算水榆花楸叶片中绿原酸、芦丁、金丝桃苷3种活性物质得率,公式为
Y=(M1/M2)×100%。
式中:Y为活性物质得率(%);M1为提取活性物质质量算术平均值,g;M2为水榆花楸叶片粉末质量,g。
2.5 数据统计与处理
采用Origin 2018和Design Expert 10软件进行数据统计与处理。
2.6 单因素试验
称取干燥水榆花楸叶片粉末1 g,2%十二烷基硫酸钠水溶液为提取溶剂,超声时间30 min,超声温度40 ℃,液料比20∶1(mL/g),研究超声功率200、300 、400 、500 、600 W对得率的影响。称取干燥水榆花楸叶片粉末1 g,2%十二烷基硫酸钠水溶液为提取溶剂,超声功率400 W,超聲温度40 ℃,液料比20∶1 (mL/g),研究超声时间10、20、30、40、50 min对得率的影响。称取干燥水榆花楸叶片粉末1 g,2%十二烷基硫酸钠水溶液为提取溶剂,超声功率400 W,超声时间30 min,液料比20∶1 (mL/g),研究超声温度30、40、50、60、70 ℃对得率的影响。称取干燥水榆花楸叶片粉末1 g,2%十二烷基硫酸钠水溶液为提取溶剂,超声功率400 W,超声时间30 min,超声温度40 ℃,研究液料比10∶1、15∶1、20∶1、25∶1、30∶1 (mL/g)对得率的影响。称取干燥水榆花楸叶片粉末1 g,超声功率400 W,超声时间30 min,超声温度40 ℃,液料比20∶1 (mL/g),研究十二烷基硫酸钠水溶液质量分数1.2%、1.6%、2%、2.4%、2.8%对得率的影响。17589BAA-E2B5-40FB-90F3-838AB5FB2438
2.7 响应面法优化提取工艺
根据单因素试验结果,选取超声功率、超声时间、超声温度3个自变量,设计三因素三水平Box-Behnken Design优化试验,以得率为响应值,响应面因素水平见表2。
2.8 对比试验
采用索氏提取法进行对比,称取水榆花楸粉末5.0 g,提取溶剂为70%乙醇溶液,液料比20∶1(mL/g),提取时间4 h,10 000 r/min离心10 min后取上清液作为待测溶液。
3 结果与分析
3.1 单因素试验结果分析
图2为不同因素对水榆花楸3种活性物质得率的影响分析图。
3.1.1 超声功率对得率的影响
由图2(a)可知,超声功率从200 W升至600 W,绿原酸、芦丁和金丝桃苷3种活性物质得率呈先升高后下降的趋势,当超声功率为400 W时,得率均达最大值,超过400 W后得率开始下降。这是因为随着超声波机械震荡作用逐渐加强,提取溶剂可加速进入植物细胞中,同时超声波的空化效应促进叶片组织完全分解破裂,使细胞内容物完全释放溶出,且强烈的超声波热效应产生更高热量,使细胞内溶质的溶解度增大[20];随着超声功率继续增大,大部分杂质溶解,影响提取物质溶解度,导致得率下降。综合考虑,选取300~500 W 超声功率进行后续优化。
3.1.2 超声时间对得率的影响
由图2(b)可知,绿原酸活性物质得率在超声时间10~20 min先下降,20~40 min再升高,40~50 min再下降;超声时间从10 min 升至50 min,芦丁和金丝桃苷2种活性物质得率呈先升高后下降的趋势,当超声时间为40 min时,得率均达最大值,超过40 min后得率开始下降。这是因为超声时间过短,提取溶剂与叶片粉末未达到完全浸润[21],细胞破碎程度小,活性成分无法扩散到提取溶剂中;随着超声时间继续延长,活性物质被部分氧化和分解,导致得率下降[22]。综合考虑,选取30~50 min超声时间进行后续优化。
3.1.3 超声温度对得率的影响
由图2(c)可知,超声温度从30 ℃升至70 ℃,绿原酸、芦丁和金丝桃苷3种活性物质得率呈先升高后下降的趋势,当超声温度为60 ℃时,得率均达最大值,超过60 ℃后得率开始下降。这是因为超声温度升高,可加快分子扩散速率,促进活性物质析出[23];随着超声温度继续升高,溶剂部分挥发,导致得率下降。综合考虑,选取50~70 ℃超声温度进行后续优化。
3.1.4 液料比对得率的影响
由图2(d)可知,液料比从10∶1(mL/g)升至30∶1(mL/g),绿原酸、芦丁和金丝桃苷3种活性物质得率呈先升高后缓慢下降的趋势。这是因为液料比较小,提取溶剂不能完全浸润材料,活性物质无法完全提取出来 [21];当液料比达20∶1(mL/g)时,叶片粉末与提取溶剂的接触面积增大,促进活性物质析出;液料比进一步增大,溶质全部溶解,其他物质溶出[24],导致得率下降。综合考虑,选取20∶1 (mL/g)液料比进行后续优化。
3.1.5 提取溶剂质量分数对得率的影响
由图2(e)可知,提取溶剂质量分数从1.2%升至2.8%,绿原酸、芦丁和金丝桃苷3种活性物质得率呈先升高后下降的趋势,当提取溶剂质量分数为2%时,得率均达最大值。这是因为绿原酸等活性物质极性较弱,适当增加表面活性剂质量分数可降低溶剂极性,有利于活性物质溶出;但随着表面活性剂质量分数继续增大,对活性物质的增溶作用不再增强,溶液中形成的胶束处于饱和状态,活性物质进入胶束溶出受到阻碍[25],导致得率下降后趋于平缓。综合考虑,选取质量分数2%的十二烷基硫酸钠水溶液进行后续优化。
3.2 响应面优化提取工艺
3.2.1 模型建立与显著性检验
根据单因素试验结果设计三因素三水平Box-Behnken Design优化试验,见表3,对表3试验数据进行多元回归拟合,可得:
绿原酸得率回归方程为Y1(%)=2.14-0.02A+4.43×10-3B+5.90×10-3C+1.61×10-3AB+0.01AC+1.69×10-3BC-0.11A2-0.09B2-0.08C2;
芦丁得率回归方程为Y2(%)=0.54+0.01A+4.87×10-3B+0.01C+5.35×10-3AB-2.10×10-3AC+6.36×10-4BC-0.04A2-0.09B2-0.06C2;
金丝桃苷得率回归方程为Y3(%)=0.19+2.40×10-3A+1.21×10-3B+1.87×10-3C+1.52×10-3AB+4.55×10-4AC+5.05×10-5BC-5.64×10-3A2-0.01B2-0.01C2。
对回归方程进行方差分析,由表4可知,3个模型F分别为48.51、39.03、27.71,P均小于0.01,说明模型差异极显著,其中A2、B2、C2对绿原酸、芦丁和金丝桃苷3种活性物质得率影响极显著,A对3种活性物质得率影响显著,C对芦丁得率影响显著,其他因素二者之间的交互作用均不显著。失拟项P分别为0.05、0.05、0.06,表明差异不显著,模型计算所得得率与试验值无明显差异。對多项式进行回归分析,决定系数(R2)分别为0.984 2、0.980 5、0.972 7,校正系数(Adj. R2)分别为0.963 9、0.955 3、0.937 6,均大于 0.90,见表5,表明模型拟合度良好,响应面适合后续优化。
3.2.2 因素交互影响及等高线分析
由图3可知,各因素之间交互作用对水榆花楸中绿原酸、芦丁、金丝桃苷3种活性物质影响的响应面均为向下曲面,曲面越陡,表明交互作用越明显,随着各因素参数值增大,得率呈先增大后减小的趋势。响应面底部为等高线投影,图3(a)、图3(b)等高线为椭圆形,图3(c)等高线近乎圆形,表明绿原酸AB、AC的交互作用比BC的交互作用显著;图3(d)等高线椭圆形扁平程度最大,表明芦丁AB的交互作用最显著;图3(g)等高线为椭圆形,表明金丝桃苷AB的交互作用最显著,与表4方差分析结果一致。17589BAA-E2B5-40FB-90F3-838AB5FB2438
3.2.3 优化提取参数和验证试验
通过回归模型分析可知,最佳提取工艺参数为超声功率405.64 W、超声时间40.35 min、超声温度60.78 ℃,该条件下绿原酸得率为2.14%、芦丁得率为0.54%、金丝桃苷得率为0.19%。考虑到试验可操作性以及仪器精密度,调整参数为超声功率405 W、超声时间40 min、超声温度60 ℃。利用调整后的最佳提取工艺进行重复性试验,绿原酸得率为2.13%±0.06%、芦丁得率为0.54%±0.02%、金丝桃苷得率为0.19%±0.02%,与理论预测值吻合度较高,表明优化后的条件切实可行。
3.2.4 对比试验
对比表6中2组数据可知,相比较索氏提取法,表面活性剂结合超声辅助提取法优化的提取工艺3种活性物质得率均有提高,且具有操作简单、提取时间短、耗能少的优势。
4 结论与讨论
本研究将表面活性剂与超声辅助提取方法相结合,以水榆花楸叶片为原料,在单因素试验基础上,采用响应面法进行优化分析,确定最佳提取工艺参数为超声功率405 W、提取时间40 min、超声温度60 ℃、液料比为20∶1(mL/g)、提取溶剂质量分数2%,该条件下绿原酸、芦丁和金丝桃苷3种活性物质得率分别为2.13%±0.06%、0.54%±0.02%、0.19%±0.02%,与理论预测值2.14%、0.54%、0.19%一致,远高于孟令锴等[1]测定百华花楸果实中的金丝桃苷和芦丁得率,金丝桃苷得率是其10倍,芦丁得率是其5倍。相比索氏提取法,超声辅助法提取水榆花楸中3种活性物质得率略有提高,优化所得提取工艺具有高稳定性、高得率等特点,应用前景较好。
【参 考 文 献】
[1]孟令锴,张朝立,高长久,等.高效液相色谱法同时测定百华花楸果实中金丝桃苷和芦丁的含量[J].中国医药导报,2016,13(4):32-35,40.
MENG L K, ZHANG C L, GAO C J, et al. HPLC determination of content of hyperoside and rutin in fruit of Srobus pohuashanensis[J]. China Medical Herald, 2016, 13(4): 32-35,40.
[2]柴军红,宛春雷,郝经纬,等.百花花楸活性成分季节变化研究[J].中国林副特产,2015(2):4-6,9.
CHAI J H, WAN C L, HAO J W, et al. Study on active component of Sorbus pohuashanensis in different seasons[J]. Forest By-Product and Speciality in China, 2015(2): 4-6,9.
[3]纪晓花.荷叶紫云英苷的超声辅助提取及其抑菌活性研究[J].食品工业,2014,35(10):112-114.
JI X H. Study on extraction of astragalin from Lotus leaves and antimicrobial activities[J]. The Food Industry, 2014, 35(10): 112-114.
[4]王忠玲,唐文哲,林芳榮.金丝桃苷对宫颈癌Hela细胞凋亡及抗氧化能力的影响[J].中国煤炭工业医学杂志,2019,22(4):402-407.
WANG Z L, TANG W Z, LIN F R. Effects of hyperoside on apoptosis and antioxidative capacity of cervical cancer Hela cells[J]. Chinese Journal of Coal Industry Medicine, 2019, 22(4): 402-407.
[5]李玉山.芦丁的资源、药理及主要剂型研究进展[J].氨基酸和生物资源,2013,35(3):13-16.
LI Y S. Progress on resources, pharmacological effect and major forms of rutin[J]. Amino Acids & Biotic Resources, 2013, 35(3): 13-16.
[6]张希,许旭东,田瑜,等.绿原酸衍生物的合成及体外抗肿瘤活性研究[J].中草药,2020,51(4):937-942.
ZHANG X, XU X D, TIAN Y, et al. Synthesis and in vitro antitumor activity evaluation of chlorogenic acid derivatives[J]. Chinese Traditional and Herbal Drugs, 2020, 51(4): 937-942.
[7]王庆华,杜婷婷,张智慧,等.绿原酸的药理作用及机制研究进展[J].药学学报,2020,55(10):2273-2280.
WANG Q H, DU T T, ZHANG Z H, et al. Advances in research on the pharmacological effects and mechanism of action of chlorogenic acid[J]. Acta Pharmaceutica Sinica, 2020, 55(10): 2273-2280.
[8]MA X B, LIN H L, HE Y H, et al. Magnetic molecularly imprinted polymers doped with graphene oxide for the selective recognition and extraction of four flavonoids from Rhododendron species[J]. Journal of Chromatography A, 2019, 1598: 39-48.17589BAA-E2B5-40FB-90F3-838AB5FB2438
[9]李占君,刘运伟,马珂,等.响应面优化紫苏籽油超声提取工艺研究[J].森林工程,2020,36(2):67-72.
LI Z J, LIU Y W, MA K, et al. Research on ultrasonic extraction technology of Perilla seed oil by response surface[J]. Forest Engineering, 2020, 36(2): 67-72.
[10]李占君,高金辉,郭兴,等.紫苏籽油超声提取工艺及其理化性质的研究[J].森林工程,2019,35(4):76-81,88.
LI Z J, GAO J H, GUO X, et al. Research on the utrasonic extraction process and physicochemical properties of Perilla seed oil full text replacement[J]. Forest Engineering, 2019, 35(4): 76-81,88.
[11]王鹏,王玉,梅菊,等.黄蜀葵花中金丝桃苷的提取工艺研究[J].食品与发酵科技,2021,57(3):76-80,89.
WANG P, WANG Y, MEI J, et al. Study on extraction technology of hyperin from Abelmoschus manihot(L)[J]. Food and Fermentation Sciences & Technology, 2021, 57(3): 76-80,89.
[12]付鹏,余晓玲,袁小淋,等.复方臭灵丹合剂提取工艺的优化及质量评价[J].中成药,2021,43(6):1393-1399.
FU P, YU X L, YUAN X L, et al. Extraction process optimization and quality evaluation of compound choulingdan mixture[J]. Chinese Traditional Patent Medicine, 2021, 43(6): 1393-1399.
[13]朱俊豪,贾红倩,张彩梅,等.HPLC法同时测定黄蜀葵花冠中芦丁、金丝桃苷和槲皮素的含量[J].生物化工,2021,7(2):1-4.
ZHU J H, JIA H Q, ZHANG C M, et al. Simultaneous determination of rutin, hyperoside and quercetin from the corolla of Abelmoschus manihot (L.) by HPLC[J]. Biological Chemical Engineering, 2021, 7(2): 1-4.
[14]張爱荣,侯拥铓,孙晶,等.超微粉碎对疏花蔷薇果中芦丁和金丝桃苷溶出量的影响研究[J].新疆医科大学学报,2020,43(8):1094-1097.
ZHANG A R, HOU Y M, SUN J, et al. Effects of ultrafine pulverization technology on the dissolution contents of rutin and hyperin from Rosa laxa R. fruits[J]. Journal of Xinjiang Medical University, 2020, 43(8): 1094-1097.
[15]王崑仑,李家磊,谢学军,等.纤维素酶辅助超声法提取葛根多糖及其DPPH自由基清除能力[J].食品工业科技,2019,40(20):174-179,187.
WANG K L, LI J L, XIE X J, et al. Cellulase assisted ultrasound extraction of Pueraria polysaccharides and its DPPH free radical scavenging ability[J]. Science and Technology of Food Industry, 2019, 40(20): 174-179, 187.
[16]HAMED Y S, ABDIN M, AKHTAR H M S, et al. Extraction, purification by macrospores resin and in vitro antioxidant activity of flavonoids from Moringa oliefera leaves[J]. South African Journal of Botany, 2019, 124: 270-279.
[17] MANSUR A R, SONG N E, JANG H W, et al. Optimizing the ultrasound-assisted deep eutectic solvent extraction of flavonoids in common buckwheat sprouts[J]. Food Chemistry, 2019, 293: 438-445.
[18]项飞.胡柚皮膳食黄酮的提取[D].武汉:武汉工程大学,2016.
XIANG F. Extraction of dietary flavonoids from Huyou peels[D]. Wuhan: Wuhan Institute of Technology, 2016.17589BAA-E2B5-40FB-90F3-838AB5FB2438
[19]李灵玉.东北茶藨子叶中主要黄酮类成分的提取、富集及其生物活性研究[D].哈尔滨:东北林业大学,2018.
LI L Y. Study on extraction, purification and biological activities of main flavonoids from Ribes mandshuricum(Maxim.) Kom.leaves[D]. Harbin: Northeast Forestry University, 2018.
[20]陈靜,崔玉梅.超声提取中草药成分研究进展[J].西部中医药,2016,29(12):141-142.
CHEN J, CUI Y M. Research progress of ultrasonic extraction of Chinese herbal medicine ingredients[J]. Western Journal of Traditional Chinese Medicine, 2016, 29(12): 141-142.
[21]刘冰雪,王玲玲,张晓雪,等.万寿菊中叶黄素的超高压提取工艺优化[J].森林工程,2021,37(4):71-78.
LIU B X, WANG L L, ZHANG X X, et al. Optimization of ultra-high pressure extraction process for lutein from marigold[J]. Forest Engineering, 2021, 37(4): 71-78.
[22]于雅静,单虹宇,孔露,等.响应面法优化玫瑰花色苷超声辅助提取工艺[J].食品工业科技,2018,39(13):173-179.
YU Y J, SHAN H Y, KONG L, et al. Optimization of ultrasonic-assisted extraction process for anthocyanins from Rosa rugosa by response surface methodology[J]. Science and Technology of Food Industry, 2018, 39(13): 173-179.
[23]千春录,侯顺超,殷健东,等.响应面试验优化水芹黄酮超声波辅助提取工艺及其抗氧化性[J].食品科学,2016,37(10):76-81.
QIAN C L, HOU S C, YIN J D, et al. Optimization of ultrasonic-assisted extraction of flavonoids from Oenanthe javanica and their antioxidant activity[J]. Food Science, 2016, 37(10): 76-81.
[24]李盼盼,杨胜祥,吕尊富,等.表面活性剂十二烷基硫酸钠协助超声波提取甘薯叶总黄酮[J].食品安全质量检测学报,2021,12(19):7688-7695.
LI P P, YANG S X, LYU Z F, et al. Extraction of total flavonoids from sweet potato leaves by ultrasonic assisted with surfactant sodium dodecyl sulfate[J]. Journal of Food Safety & Quality, 2021, 12(19): 7688-7695.
[25]姜文倩,郑丹婷,韩伟.吐温60协同微波提取甘草黄酮的优化[J].南京工业大学学报(自然科学版),2020,42(5):671-676.
JIANG W Q, ZHENG D T, HAN W. Optimization of Tween 60 assisted microwave extraction of glycyrrhizic flavonoids[J]. Journal of Nanjing Tech University (Natural Science Edition), 2020, 42(5): 671-676.17589BAA-E2B5-40FB-90F3-838AB5FB2438

