丹参酮ⅡA-甘草酸自组装纳米胶束的制备及体外抗脑胶质瘤评价
梁启凡,崔季维,张新茹,郭雨苗,王若宁,狄留庆
(1.南京中医药大学药学院,江苏 南京 210023;2.江苏省中药高效给药系统工程技术研究中心,江苏 南京 210023)
丹参酮ⅡA(Tanshinone ⅡA,TanⅡA)为中药丹参中提取的脂溶性菲醌类化合物,是传统中药丹参的主要有效成分。《本草纲目》中即有记载丹参用于“活血,通心包络,治疝痛”[1],现已广泛应用于临床心血管疾病治疗和辅助治疗[2]。最新研究表明,TanⅡA具有明显的抗肿瘤活性,可通过抑制肿瘤细胞增殖与分化、诱导肿瘤细胞凋亡、抵抗新生血管生成抑制实体瘤生长[3-4]。研究发现,TanⅡA能够通过上调ADPRTL1和CYP1A1的表达,诱导人脑胶质瘤细胞生长周期停滞于G0/G1期,同时上调Notch-1表达并抑制p-c-Myc、p-MMP-9以及p-Bcl-2表达,诱导细胞发生氧化损伤并促进细胞凋亡,从而达到抑制肿瘤细胞生长的目的[4-5]。此外, 通过激活IL-15信号传导,Tan ⅡA能够显著增加T-bet、GATA-3、Id2以及ETS-1的表达,激活JAK激酶并同时促进转录激活因子STAT5的磷酸化和活化,增加丝裂原活化蛋白激酶p38磷酸化以改善胶质瘤免疫抑制微环境,促进自然杀伤细胞分化[6]。然而,TanⅡA溶解度低、口服生物利用度差等性质限制了其临床使用。通过磺酸化修饰对TanⅡA进行化学结构改造能够提高TanⅡA水溶性。但是,单一的治疗模式难以应对复杂的肿瘤微环境;此外,多重生物屏障,例如血脑屏障(Blood brain barrier,BBB)的存在严重阻碍了药物在病变部位的累积,削弱了治疗效果。因此,如何高效递送TanⅡA至胶质瘤部位已成为该领域的研究重点。
中药化学成分来源广泛,结构独特,极易发生分子间相互作用而产生聚集或自组装形成聚集体或自组装颗粒[7]。如甾体、三萜类成分的刚性骨架、柔性的烷基侧链和多手性中心的结构特点使其容易因疏水作用、氢键作用以及π-π堆积作用中的一种或多种共同影响而自组装形成自组装纳米粒。甘草酸(Glycyrrhizic acid,GL)源于中药甘草的根部皂苷,是一种两亲性分子,亲水部分由葡萄糖醛酸残基构成,疏水部分是甘草酸残基,能够在水中聚集形成自组装胶束,可以作为药物载体用于改善药物吸收[8]。GL不仅具有人工合成纳米材料一样的药物包封能力,还具有优于人工合成纳米材料的生物可降解性、生物相容性和安全性。GL通过半胱天冬酶依赖性和独立性途径、内质网应激和线粒体依赖性途径诱导细胞凋亡,通过减少活性氧的产生和激活内皮细胞中的ERK途径来降低肿瘤细胞活性,通过抑制活性亚基p65进而抑制NF-κB来抑制增殖和诱导细胞凋亡[9]。调节性T细胞(Regulatory cells,Tregs)和骨髓衍生抑制细胞(Myeloid-derived suppressor cells,MDSCs)可以通过Cox2/PGE2通路促进肿瘤免疫抑制微环境的形成。GL可以通过抑制pSTAT3诱导Tregs和MDSC下调,改善肿瘤免疫抑制的微环境,实现肿瘤的有效治疗[10]。胶质瘤微环境中同样存在大量的Tregs和MDSCs,为GL与TanⅡA联用以及多途径协同治疗胶质瘤提供了理论基础。
基于此,本研究利用了GL能够自组装形成胶束的特性,采用薄膜分散法将TanⅡA包封在胶束内制备制剂TGM。本研究从载丹参酮ⅡA-甘草酸自组装胶束的制备与表征、体外跨BBB能力评价及体外抗脑胶质瘤活性评价等方面考察其特性。
1 材料
Nano-ZS90激光粒度分析仪,英国Malvern仪器有限公司;JY92-ⅡN超声波细胞破碎仪,宁波新芝生物科技有限公司;HT9800透射电子显微镜(Transmission electron microscope,TEM),日本日立公司;Gallios流式细胞仪,美国贝克曼库尔特公司;倒置荧光显微镜,Zeiss公司;酶标仪,PerkinElmer公司。
丹参酮ⅡA,大连美仑生物技术有限公司;甘草酸,北京百灵威科技有限公司;香豆素6,碧云天有限公司;荧光染料DiI,苏州宇恒生物科技有限公司;四水合氯化锰、四甲基偶氮唑盐(MTT),美国Sigma公司;Annexin V-FITC/PI凋亡试剂盒,南京建成有限公司;DMEM培养液、0.25%胰蛋白酶、青-链霉素溶液、磷酸缓冲盐溶液,美国Hyclone公司;胎牛血清,美国Gibco公司。
鼠源性脑胶质瘤GL261细胞,南京贝佳生物公司;鼠源性脑微血管内皮细胞bEnd.3细胞,中科院上海细胞库。
2 方法和结果
2.1 TGM的制备
分别采用乳化蒸发法、超声分散法和薄膜分散法制备制剂。乳化蒸发法制备TGM:精密称取一定量TanⅡA用氯仿配制成2 mg·mL-1溶液,分别取5、15、25 mg GL用4.5 mL超纯水溶解。吸取500 μL TanⅡA的氯仿溶液于GL水溶液中,超声处理15 min(200 W、2 s开/1 s关),使体系充分乳化呈白色乳液状,转移至100 mL茄型瓶中,30 ℃减压旋转蒸发除尽氯仿,用0.8 μm滤膜过滤得到TGM。
超声分散法制备TGM:精密称取一定量TanⅡA用无水乙醇配制成1 mg·mL-1溶液,分别取5、15、25 mg GL用9 mL超纯水溶解。取TanⅡA的乙醇溶液1 mL逐渐滴入GL的水溶液中,密封搅拌2.5 h,随后在冰浴条件下进行超声处理,超声处理15 min(200 W、2 s开/1 s关),用0.8 μm滤膜过滤得到TGM。
薄膜分散法制备TGM:精密称取一定量TanⅡA用无水乙醇配制成1 mg·mL-1溶液,分别取5、15、25 mg GL,转移至100 mL茄型瓶中,于45 ℃减压旋转蒸发除去无水乙醇,瓶壁上形成均匀薄膜,随后加入5 mL超纯水,轻微振荡使药物薄膜完全溶解于水中。随后将溶液转至20 mL西林瓶中,在冰浴条件下超声破碎5 min(200 W、2 s开/1 s关),用0.8 μm滤膜过滤得到TGM溶液。
使用动态光散射激光粒度仪对多种制备方法下TGM的粒径、PDI和Zeta电位进行测定,如表1~3所示,通过乳化蒸发法和超声分散法制备的3种投料比的TGM,粒径和PDI过大,制剂参数变化范围大,TGM无法通过EPR效应聚集至胶质瘤部位发挥相应疗效。如图1所示,薄膜分散法制备的TGM相比之下粒径和PDI稳定且均较小,投料比为1∶15和1∶25的制剂溶液清澈无浑浊,出现明显丁达尔效应。则薄膜分散法确定为最终制备方法。

图1 薄膜分散法制备不同比例TGM制剂拍摄图
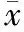
表1 乳化蒸发法制备TGM的粒径、PDI和Zeta电位(±s,n=3)
表2 超声分散法制备TGM的粒径、PDI和Zeta电位(±s,n=3)
表3 薄膜分散法制备TGM的粒径、PDI和Zeta电位(±s,n=3)
2.2 TGM的表征
2.2.1 TEM扫描 取适量的TGM以PBS缓冲液稀释,滴加至超薄碳支持膜铜网上,静置后滤纸吸去液体。滴加2%的磷钨酸溶液进行染色,滤纸吸去液体,进行TEM扫描。
TGM呈现大小均一的圆球状,粒径为150 nm左右,与粒径测量结果基本吻合(图2)。
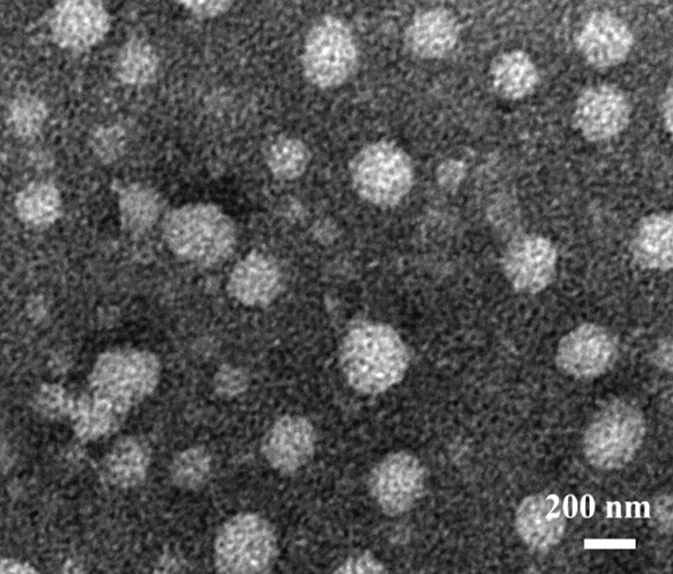
图2 TGM的TEM图
2.2.2 包封率测定 通过高效液相色谱法测定TGM中TanⅡA和GL的包封率(Entrapment efficiency,EE)。其中,TanⅡA的色谱方法:色谱柱为Thermo BDS HYPERSIL C18(250 mm×4.6 mm,5 μm),流动相为甲醇∶水=90∶10,检测波长为269 nm,流速为1.0 mL·min-1,柱温为30 ℃,进样量为10 μL;GL的色谱方法:色谱柱为Thermo BDS HYPERSIL C18(250 mm×4.6 mm,5 μm),流动相为甲醇∶0.1%磷酸水溶液=70∶30,检测波长为250 nm,流速为1.0 mL·min-1,柱温为30 ℃,进样量为10 μL。取适量TGM于离心管中,加入10倍体积色谱级甲醇,水浴超声10 min,12 000 r·min-1,离心10 min取上清,按照上述液相条件测定TanⅡA和GL含量计算EE。EE(%)=(药物测得质量/药物实际投入质量)×100%。
如表4所示,后续通过HPLC测定3种投料比制备TGM的药物包封率,结果表明,当投料比为1∶25时,通过薄膜分散法制备TGM,粒径和PDI分别为(121.87±5.85)nm、0.227±0.033,Zeta电位稳定为(-22.3±1.2)mV,TanⅡA包封率最高为(88.54±14.27)%。因此,最终的制备工艺为上述薄膜分散法。

表4 HPLC测定TGM的TanⅡA包封率
2.2.3 药物释放 吸取2 mL TGM加入处理好的透析袋(截留分子量为8 000~14 000)中。释放介质分别为含2%吐温-80的PBS缓冲液(0.1 mol·L-1,pH 7.4),漏槽条件。置于恒温摇床内(37 ℃, 150 r·min-1)。分别在0.5、1、2、4、6、8、10、12、24 h时收集透析袋外的释放介质,并立即补充等体积的新鲜相应释放介质。释放的药物通过HPLC法进行测定,计算累计药物释放率,并绘制药物累计释放曲线。
结果如图3所示,经自组装胶束包载后的2种药物在4~6 h左右才释放其中大部分包载药物,制剂的制备有效减缓药物的释放。
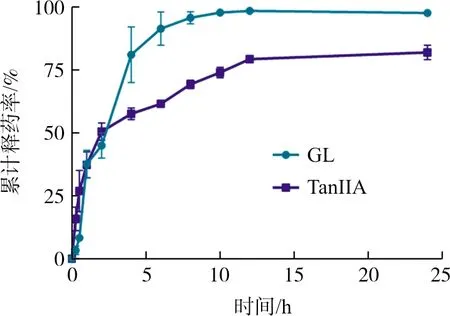
图3 TGM药物累计释放考察
2.3 TGM跨BBB考察
将Transwell小室放入24孔板中,然后将bEnd.3细胞以每孔6×104的密度接种在Transwell小室中,上室300 μL细胞液,下室加入800 μL完全培养基,每2 d更换1次培养基。通过显微镜观察细胞的形态并测量跨膜电阻来监测bEnd.3单层的紧密度。当bEnd.3单层的细胞与下腔室跨膜电阻高于200 Ω·cm2时即可进行实验,在下室将GL261细胞以每孔5×104的密度接种。使用亲脂性染料香豆素6(Coumarin6,C6)取代了TanⅡA,制备了C6-GL胶束C6-GL/M,用单培配置成含药培养基,在上室加入300 μL含药培养基,于12 h后利用倒置荧光显微镜拍摄上室和下室细胞。
TGM跨BBB效率结果见图4。与bEnd.3细胞在上室共孵育后,通过倒置荧光显微镜观察上室与下室的带荧光标记制剂的分布情况。结果如图4所示,在下室可以观察到C6-GL/M的分布,表明GL自组装胶束具有很好的跨BBB能力。

图4 倒置荧光显微镜观察香豆素6标记载体跨bEnd.3细胞后的分布情况
2.4 细胞摄取机制考察
将GL261细胞以每孔1.0×104的密度接种在96孔板上,待细胞贴壁后分别加入相应抑制剂在以下条件孵育细胞:①5 mmol·L-1氯丙嗪以抑制网格蛋白介导的胞吞作用;②10 mmol·L-1甲基β-环糊精以抑制小窝蛋白介导的胞吞作用;③5 mmol·L-1阿米洛利以抑制巨胞饮作用;④不加抑制剂的无血清培养基作为空白对照。用抑制剂预处理贴壁肿瘤细胞1 h,使用荧光染料DiI取代TanⅡA,制备DiI-GL/M,用单培配置成含药培养基,加入含药培养基,孵育1 h。弃去上层的培养基,加入100 μL DMSO溶解细胞以释放DiI并用酶标仪进行检测(DiI:λEx/λEm=549/565 nm)。
结果如图5所示,通过使用3种不同摄取机制的抑制剂,DiI-GL/M被GL261细胞摄取受到氯丙嗪抑制,相对摄取率减少至(80.26±0.03)%,表明TGM可以通过网格蛋白介导的细胞内吞途径进入GL261细胞内,从而增强TanⅡA内化到肿瘤细胞的能力。

注:与无抑制剂组比较,
2.5 MTT法考察TGM细胞毒性
取对数生长期的GL261细胞以完全培养基重悬(5×104mL-1),接种于96孔板中,每孔100 μL细胞液,置于37 ℃,5%CO2培养过夜。待细胞贴壁后,吸除培养基,空白对照孔加入无血清培养基100 μL,给药孔分别加入含有不同浓度游离TanⅡA、游离GL及TGM。培养24 h,加入MTT(5 mg·mL-1,PBS溶解)10 μL,37 ℃,5%CO2孵育4 h。吸除每孔溶液,加入DMSO 150 μL,37 ℃恒温摇床中振荡10 min,酶标仪测定其在490 nm波长下的吸光度(A),计算细胞存活率(%),并计算半数抑制浓度(IC50)值。
取对数生长期的bEnd.3细胞以完全培养基重悬(5×104mL-1),接种于96孔板中,每孔100 μL细胞液,置于37 ℃,5%CO2培养过夜。待细胞贴壁后,吸除培养基,空白对照孔加入无血清培养基100 μL,给药孔分别加入含有不同浓度TanⅡA的TGM。培养24 h,加入MTT(5 mg·mL-1,PBS溶解)10 μL,37 ℃,5%CO2孵育4 h。吸除每孔溶液,加入DMSO 150 μL,37 ℃恒温摇床中振荡10 min,酶标仪测定其在490 nm波长下的吸光度(A),计算细胞存活率(%)。细胞存活率(%)=(A给药-A空白)/(A对照-A空白)。
结果如图6所示,单独给药TanⅡA和GL时,两种药物分别都对GL261细胞产生浓度依赖性细胞毒性作用,药物的IC50值分别为2.95 μg·mL-1和5.15 μg·mL-1。但两种药物联合使用时显著提高了抗肿瘤疗效,当TGM中TanⅡA的药物浓度为4 μg·mL-1时,细胞活力已降低至(34.09±6.58)%,两药联合的IC50值为2.15 μg·mL-1,说明两种药物联合使用具有更高效的抗肿瘤作用。

图6 游离TanⅡA、游离GL和TGM对GL261细胞的细胞毒性考察
结果如图7所示,TGM对小鼠脑微血管内皮细胞的细胞毒性明显弱于小鼠脑胶质瘤细胞,两药联合的IC50值为7.99 μg·mL-1。在制剂给药的浓度下,正常细胞的存活率为(72.04±7.36)%,表明该制剂对正常脑细胞系的细胞毒性弱。

图7 TGM对bEnd.3细胞的细胞毒性考察
2.6 Annexin V-FITC/PI法考察TGM促细胞凋亡能力
取对数生长期的GL261细胞以完全培养基重悬(2×105mL-1),接种于12孔板中,每孔1 mL,置于37 ℃,5%CO2培养过夜。待细胞贴壁后,吸除培养基,加入以无血清培养基配制稀释的游离Tan ⅡA、游离GL及TGM的含药培养基,不加药物处理的细胞作为空白对照。培养24 h后,收集细胞沉淀,加入结合缓冲液0.5 mL重悬细胞,300目尼龙筛网过滤除去细胞团块,加入5 μL Annexin V-FITC染液和10 μL PI染液轻轻混合均匀,室温避光孵育10 min,置于流式管中,流式细胞仪进行凋亡检测。
细胞凋亡结果如图8所示,分别将游离TanⅡA、游离GL和TGM作用于GL261细胞,3组药物均表现出对GL261明显的促凋亡作用。与Free TanⅡA、Free GL组相比,TGM的促细胞凋亡率分别由12.28%、13.32%上升至31.16%,其中晚期细胞凋亡比例明显上升。表明TanⅡA与GL通过自组装形成胶束后,更有利于被脑胶质瘤细胞所摄取,TanⅡA与GL协同作用能发挥出更强的抗脑胶质瘤疗效。

图8 游离TanⅡA、游离GL和TGM对GL261细胞的促凋亡作用考察
3 讨论
TanⅡA具有明显的抗脑胶质瘤效果,可以有效抑制肿瘤细胞增殖、诱导分化和凋亡、抑制新生血管形成及肿瘤转移[11-14]。然而,TanⅡA水溶性差和口服生物利用度低限制了其临床应用[15]。利用纳米技术将中药活性成分负载于纳米载体中,可以有效改善溶解度和生物利用度,增强药物的稳定性以及对病灶部位的靶向性。目前,研究人员尝试了多种方法,如用薄膜水合法和探针超声处理,将TanⅡA包载进脂质体内部[16],将TanⅡA制备成纳米乳液,改善TanⅡA在大鼠小肠中的吸收[17],将TanⅡA包载进聚乙二醇制备的纳米颗粒中,有效延长在人体内的循环[18]。本研究采用GL自组装胶束,通过薄膜分散法包载TanⅡA制备得到TGM最终制剂。TGM制剂溶液均一稳定且澄清,可明显观察到丁达尔效应,TanⅡA包封率高,4~6 h稳定释药;在GL自组装纳米胶束的包载下将TanⅡA运输通过脑微血管内皮细胞,被脑胶质瘤细胞所摄取从而发挥GL与TanⅡA的抗肿瘤疗效,TGM相较于游离TanⅡA和游离GL对GL261细胞显示出更强的细胞毒性以及促进细胞凋亡的能力。
中药丹参活性成分TanⅡA因抗肿瘤、促进血液循环、消除血瘀的功效,近年来已被广泛应用于乳腺癌[19]、肾纤维化[20]等疾病的治疗。但不易通过生物屏障、口服生物利用度低、水溶性差和渗透性低等特性使得TanⅡA难以用于脑胶质瘤的治疗[21]。本研究构建的GL自组装胶束,可有效装载TanⅡA跨越BBB达到治疗区域,两药的抗脑胶质瘤疗效协同作用,发挥有效的细胞毒性与促进脑胶质瘤细胞凋亡,有效克服TanⅡA难以通过生物屏障、口服生物利用度低、水溶性差等缺点,为TanⅡA一类水溶性差、半衰期短且生物利用度低的抗肿瘤中药活性成分的递送系统设计提供了参考。

