一株禽腺病毒4 型Fiber2 蛋白单克隆抗体的制备
谢 明,李国攀,胡基雄,张志翔,艾笑扬,陈帝斯,李 杨,尹俊翔,荣 俊
(长江大学生命科学学院,湖北 荆州 434020)
腺病毒根据宿主范围可分为哺乳动物腺病毒属和禽腺病毒属,禽腺病毒根据抗原性可分为3 个亚群(Ⅰ、Ⅱ、Ⅲ亚群),Ⅰ群已经鉴定了5 个禽腺病毒种(A 种-E 种),根据交叉中和试验分为12 个血清型(1-7 和8a、8b、9-11)[1]。禽腺病毒血清4 型(Fowl Adenovirus serotype 4,FAdV-4)属于Ⅰ群C 种血清型4[2]。流行病学研究表明,鸡群主要FAdV 流行毒株之一为高致病性血清4 型禽腺病毒(Fowl adenovirus serotype 4,FAdV-4),该病主要发生于3~5 周龄雏鸡,以肝炎-心包积液综合征(HHS)为主,并伴随着包涵体肝炎等临床症状[3],不仅能通过垂直传播传给下一代,也可通过呼吸道消化道黏膜排出的分泌物在鸡群间水平传播[4],死亡率30%~80%[5],给养禽业造成巨大的经济损失[6]。
FAdV 是二十面体无囊膜的双链DNA 病毒,衣壳蛋白由Penton、Hexon 和Fiber 3 种主要蛋白构成[7]。研究表明,Fiber 蛋白的羧基端头部区域是特异性受体结合位点,也是病毒早期吸附宿主细胞的必需位点,具有抗原性,可影响病毒毒力[8];此外FAdV-4 的两条Fiber 蛋白(Fiber-1 和Fiber-2)长度差异显著,表明重组Fiber-2 蛋白不仅比Fiber-1 蛋白活性更好,对FAdV-4 的保护作用更强[9],而且Fiber2 蛋白还具有型和亚群特异性抗原决定簇[10],可诱导机体产生主要的型特异性中和抗体[11]。因此Fiber-2 蛋白是目前被公认为FAdV-4 的一种重要保护性抗原,能够诱导中和抗体,是疫苗研制和疾病防控的主要研究方向之一。
目前,国内还未有批准上市的亚单位疫苗,对该病的防控主要采用禽腺病毒灭活疫苗较多[12],但全病毒灭活苗需要借助鸡胚或细胞繁殖病毒,生产成本较高,且活毒操作存在一定的生物安全隐患,重组亚单位疫苗因其具有安全、高效等特点,从而具有更加良好的开发和应用前景[13]。而评价疫苗免疫效果的有效方法一般是监测其抗体水平[14],建立能够反映疫苗免疫后鸡群抗体水平变化趋势的监测手段对该病的防控具有重要意义[15]。目前常用的禽腺病毒诊断技术有病毒分离、中和试验、琼脂扩散试验、PCR 和ELISA 等[16],而ELISA 相比于其他检测方法具有灵敏度高、特异性强、样本处理简单和通量大等优点,是目前最受青睐的检测技术之一[17]。其中单克隆抗体由于其特异性强、交叉反应少等优点被广泛运用于检测抗原抗体的ELISA 试剂盒中[18]。
本研究利用原核系统表达重组FAdV-4 Fiber2蛋白,免疫小鼠并制备针对Fiber2 蛋白的单克隆抗体,旨在为禽腺病毒4 型的早期诊断和疫苗的评估提供参考,为检测试剂盒的商品化研制奠定基础。
1 材料与方法
1.1 试验材料
FAdV-4C Fiber2 的原核表达载体为课题组前期构建、保存;Ni-NTA 树脂亲合层析柱购自上海七海复泰生物科技有限公司;6×His Tag Mouse Monoclonal antibody 购自美国Proteintech 公司;HRP 标记的羊抗小鼠IgG 购自美国Jackson 公司;ECL 化学发光超敏显色试剂盒购自翌圣生物科技(上海)股份有限公司;高结合力酶标板购自无锡耐思生命科技股份有限公司;SPF 级BALB/c 小鼠由实验室引种自繁;弗氏完全佐剂与弗氏不完全佐剂购自北京博奥龙免疫技术有限公司;淋巴细胞分离液购自北京达科为生物技术有限公司;PEG-1450 购自北京博奥龙免疫技术有限公司;RPMI 1640、HAT(次黄嘌呤钠、氨基蝶呤和胸苷混合液)、HT(次黄嘌呤钠和胸苷混合液)、FBS(胎牛血清)等细胞培养基中所需溶液均购自格来赛生命科技(上海)有限公司;FITC 标记的羊抗小鼠IgG 荧光二抗购自北京博奥龙免疫技术有限公司。
1.2 试验方法
1.2.1 重组FAdV-4 Fiber2 将诱导表达后的菌体用PBS 溶液(0.05 mmol/L,pH 7.4,下同)缓冲液按照1∶10(m∶V)充分重悬,用超声破碎处理后8 000 r/min离心10 min 收集上清。用0.22 μm 滤膜过滤上清,获得预处理后的蛋白液。用Ni-NTA 树脂亲合层析柱纯化,PBS 溶液作为缓冲液,用含50 mmol/L 咪唑的PBS 溶液洗脱目的蛋白;用SDS-PAGE 电泳对纯化后的蛋白进行测定。
1.2.2 Western blot 鉴定 对纯化后的目的蛋白进行SDS-PAGE 凝胶电泳,然后将蛋白转移至NC 纤维膜上,用含5%脱脂奶粉的PBS 溶液作为封闭液在37 ℃孵育1 h;6×His Tag Mouse Monoclonal antibody作为一抗(1∶10 000),37 ℃中孵育1 h;用1×PBST 溶液(含0.05%Tween-20 的PBS 溶液,下同)清洗5 次,5 min/次;HRP 标记的羊抗小鼠IgG 作为二抗(1∶20 000),37 ℃中孵育1 h;用1×PBST 溶液清洗5 次,5 min/次。用ECL 化学发光超敏显色试剂盒进行显色处理,并用凝胶成像仪进行化学发光成像并拍照分析。
1.2.3 间接ELISA 方法的建立 用碳酸缓冲液(0.05 mol/L,pH 9.5)将纯化的FAdV-4 Fiber2 蛋白稀释至5 μg/mL,混合均匀后按100 μL/孔加入酶标板中,在25 ℃中孵育5 h;弃去板中液体并拍干,按200 μL/孔加入封闭液,在37 ℃中封闭2 h;弃去板中液体并拍干备用。以按照100 μL/孔的剂量加入稀释后的一抗样品,同时设置阴性对照,在37 ℃恒温箱中孵育30 min;弃去板中液体并用1×PBST 溶液洗板;用HRP 标记的羊抗小鼠IgG 作二抗(1∶10 000),100 μL/孔,并在37 ℃中孵育30 min;弃去板中液体并用1×PBST 溶液洗板;加入显色液100 μL/孔,在37 ℃中避光孵育10 min 后加入终止液(2 mmol/L H2SO4),100 μL/孔;测定各孔在波长450 nm 处的OD值。当阴性对照的OD值<0.2 时,试验成立;当S/N(待检样品OD值/阴性对照OD值)≥2.1 时,判定为阳性;当S/N<1.6 时,判定为阴性;2.1>S/N≥1.6 为可疑;在测定效价时,将S/N值等于2.1 时所对应的稀释倍数定为其效价。
1.2.4 小鼠免疫 选用3 只4~6 周龄BALB/c 小鼠,将纯化后的FAdV-4 Fiber2 蛋白稀释至100 μg/mL并与弗氏完全佐剂等体积混合并充分乳化,按照200 μL/只腹腔注射;一免后第14 天,将目的蛋白与弗氏不完全佐剂等体积乳化后二次腹腔注射免疫小鼠;第28 天按相同剂量加强免疫。于加强免疫后第3 天采血检测血清抗体效价,选择抗体效价高于105的小鼠进行细胞融合。
1.2.5 杂交瘤细胞的筛选及亚克隆
1)细胞融合。3 次免疫后的BALB/c 小鼠采血后颈椎脱臼法处死,无菌取脾脏,研磨制成单细胞悬液,70 μm 细胞筛网过滤后,用淋巴细胞分离液分离淋巴细胞,并用RPMI1640将细胞稀释成1×108个/mL,在37 ℃,5%CO2培养箱培养备用。取培养至对数期的SP2/0 小鼠骨髓瘤细胞,稀释为1×107个/mL,与脾脏淋巴细胞按照1∶10 的体积混合于25 mL 无血清培养基中,400 r/min 离心10 min 后弃去上清。轻拍管底打散沉淀,将离心管于37 ℃水浴中保温至融合开始。在1 min 内匀速加入37 ℃1 mL PEG-1450 溶液,期间不停搅拌,37 ℃水浴90 s,每隔2 min 分别加入37 ℃1、3、10 mL 不完全培养液,终止PEG 作用,并在37 ℃水浴中孵育5 min,300 r/min 离心5~10 min,弃 去 上 清。用1×HAT 培 养 基(RPMI1640+20%FBS+1×HAT+谷氨酰胺+丙酮酸钠)将沉淀细胞重悬,并接种于96 孔板中,每孔200 μL,将培养板放入37 ℃,5%CO2培养箱中培养。
2)杂交瘤细胞的筛选及亚克隆。当细胞长至孔底面积约50%时,取100 μL 上清用“1.2.3”中间接ELISA 方法检测。选择OD值大于1.0 的孔,采用有限稀释法进行3 次亚克隆,并换用1×HT 培养液(RPMI1640+20%FBS+1×HT+谷氨酰胺+丙酮酸钠)培养,直至单克隆孔的细胞上清检测阳性率为100%,即获得稳定、可分泌单抗且增殖的细胞株。
1)腹水的制备及效价测定。取4~6周龄的BALB/c雌性小鼠,腹腔注射腹水制备用佐剂0.5 mL/只;第15 天,每只小鼠腹腔注射1 mL 杂交瘤细胞(1×106~5×106个/mL);第22~25 天,小鼠腹部明显膨胀后抽取腹水,2 000 r/min 离心10 min 取上清液,倍比稀释后用“1.2.3”间接ELISA 方法检测,检测结果为阳性的孔对应的最高稀释度为腹水的抗体效价。
1.2.6 单克隆抗体的鉴定
1)Dot blot 斑点杂交。取攻毒FAdV-4 的鸡肝组织,按照1∶10(m∶V)加入PBS 溶液研磨,4 000 r/min离心5 min 取上清;平行处理健康鸡肝组织。在NC膜上依次点入2 μL 大肠杆菌裂解液、1 μL 纯化的Fiber2 蛋白、1 μL 攻毒鸡肝组织研磨液、1 μL 健康鸡肝组织研磨液,放入37 ℃恒温箱中干燥。待样品吸收完全后,将NC 膜完全浸泡在含5%脱脂奶粉的PBST 溶液中,37 ℃封闭1 h;用1×PBST 溶液清洗5次,5 min/次;制备的单抗作为一抗(1∶10 000),37 ℃中孵育1 h;用1×PBST 溶液清洗5 次,5 min/次;HRP标记的羊抗小鼠IgG 作为二抗(1∶10 000),37 ℃中孵 育1 h;用1×PBST 溶液 清 洗5 次,5 min/次。用ECL 化学发光超敏显色试剂盒进行显色处理,并用凝胶成像仪成像并拍照分析结果。
英藏敦煌文献指斯坦因(M.A.Stein)于1906—1908年第二次中亚考察和1913—1916年第三次中亚考察在莫高窟藏经洞所获敦煌文献,起初分别收藏在大英博物馆和设在伦敦的印度事务部图书馆;绢、纸绘画则被当时的英印政府设在印度新德里的中亚古物博物馆和大英博物馆分割收藏。1973年,大英博物馆图书部与博物馆分离,与印度事务部图书馆等合并建立了大英图书馆,原大英博物馆和印度事务部图书馆收藏的敦煌文献均被移交给大英图书馆收藏。
2)间接免疫荧光试验鉴定。将鸡肝癌细胞LMH 铺于24 孔板中,待LMH 细胞生长至底部80%~90%后,用MOI 为0.01 的FAdV-4 病毒量进行感染,同时设立正常细胞为阴性对照。FAdV-4 感染24 h后,弃去细胞上清,用预冷的4%甲醛固定液在室温下固定细胞20 min,并用PBS 溶液洗涤3 次;用0.1%TritonX-100 在室温下通透细胞膜10 min,并PBS 溶液洗涤3 次;用含10%胎牛血清的PBS 溶液在室温下封闭1 h,并用PBS 溶液洗涤3 次;将适当稀释的小鼠IgG 和制备的抗FAdV-4 Fiber2 蛋白的单克隆抗体与固定的LMH 细胞在37 ℃中孵育1 h,PBS 溶液洗涤3 次,再加入FITC 标记的山羊抗小鼠IgG(1∶1 000),37 ℃避光孵育1 h 后用PBS 溶液洗3次;加入DAPI 染色试剂,室温中避光孵育10 min,PBS 溶液洗3 次后用双蒸水洗3 次;最后用封片剂封片后放置于荧光显微镜下观察拍照并分析。
2 结果与分析
2.1 重组FAdV-4 Fiber2 蛋白的纯化与Western blot鉴定
将长江大学生命科学学院构建表达的重组FAdV-4 Fiber2 蛋白进行镍柱亲和层析后SDSPAGE 电泳,结果如图1A 所示。蛋白大小为28 ku,与预期大小相符,纯度为95%,经测量蛋白浓度为0.582 mg/mL。将纯化的FAdV-4 Fiber2 蛋白进行Western blot鉴定,结果如图1B 所示,纯化的FAdV-4 Fiber2 蛋白能与His 单克隆抗体特异性结合,表明纯化所得蛋白是构建表达的重组FAdV-4 Fiber2蛋白。
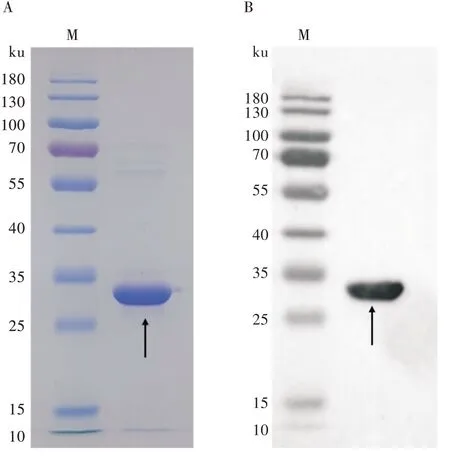
图1 重组蛋白纯化及Western blot 鉴定
2.2 小鼠血清ELISA 效价测定
利用FAdV-4 Fiber2 蛋白免疫BALB/c 小鼠,将3 免后第3 天的小鼠经尾静脉取血后进行间接ELISA 方法检测其抗体分泌水平,ELISA 检测结果如图2 所示。3 只免疫后的小鼠血清中所含Fiber2 抗体水平较高,且血清稀释至204 800 倍后OD450nm仍高于0.2,且S/N值大于2.1,即认为小鼠血清效价高于2×105。为提高融合成功率,便于后续阳性杂交瘤细胞株的筛选,选取效价最高的195 号小鼠进行细胞融合。
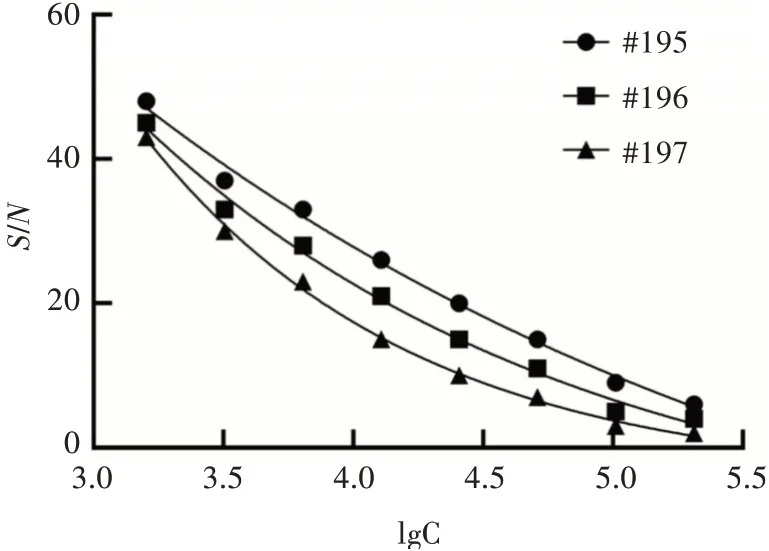
图2 间接ELISA 检测免疫小鼠血清中Fiber2 抗体
2.3 杂交瘤细胞的筛选及亚克隆
取96 孔中的杂交瘤细胞的上清100 μL,按照“1.2.4”的间接ELISA 方法检测其在波长450 nm 处的OD值,选取OD值最高的孔中阳性细胞采用有限稀释法进行亚克隆,经过3 次亚克隆筛选后获得10 株能稳定分泌FAdV-4 Fiber2 蛋白单克隆抗体的阳性杂交瘤细胞,分别命名为1B5F1、1B5G11、1B5C1、1B5D2、1B5E3、1B5F3、1B5E4、1B5G4、1B5A8、1B5G8。10 株杂交瘤细胞经间接ELISA 方法检测其上清中所含抗体,结果如图3 所示。10 株杂交瘤细胞的上清液在波长450 nm 处的OD值均大于1 且S/N值远大于2.1,即成功筛选出10 株阳性杂交瘤细胞。该10 株细胞均能稳定分泌单抗并且能稳定传代,传代3 d 后即能铺满T25 瓶底50%以上;细胞株系在液氮冻存60 d 后复苏,对其分泌抗体和传代均无影响,表明该细胞株系的稳定性较好。为保证所获取的小鼠腹水的效价相对较高,选择细胞上清中所含抗体水平最高的1B5F1 制备腹水。
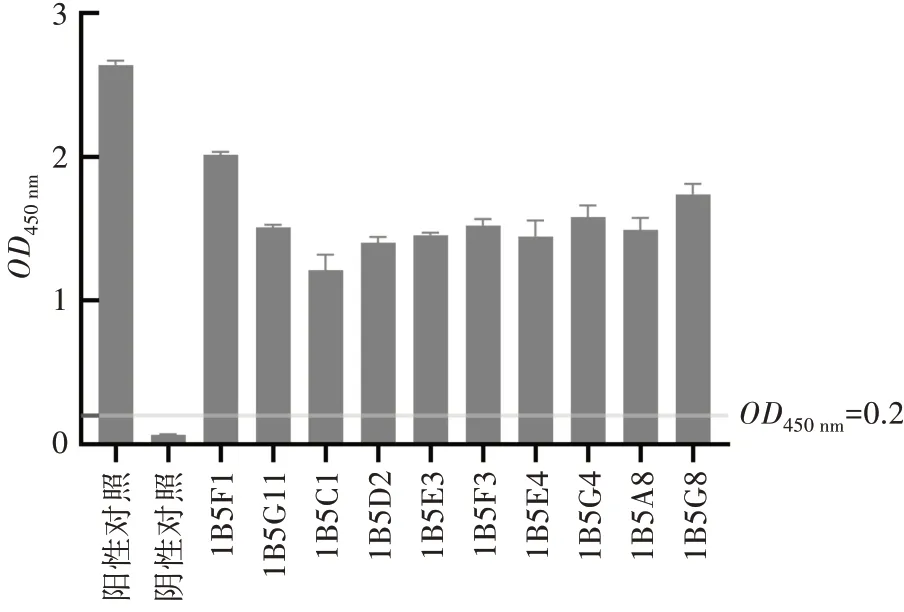
图3 间接ELISA 检测杂交瘤细胞上清抗体
2.4 腹水的制备及效价测定
将所取的小鼠腹水离心取上清液后按照“1.2.4”间接ELISA 方法检测其抗体含量并进行效价测定,根据GraphPad 曲线拟合结果如图4 所示,当稀释倍数为6.2×105倍时,S/N等于2.1 且其在波长450 nm处的OD值仍高于0.2,即认为所制备的腹水效价是6.2×105。
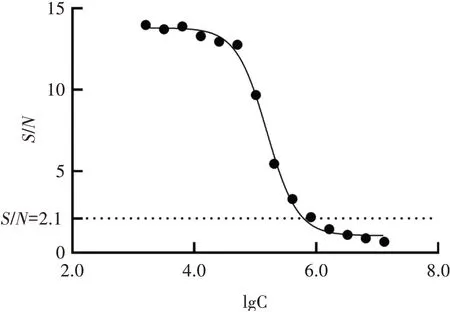
图4 间接ELISA 检测小鼠腹水效价
2.5 FAdV-4 Fiber2 蛋白单克隆抗体的鉴定
2.5.1 Dot blot 斑点杂交鉴定 间接ELISA 试验中,纯化的重组蛋白能与制备的单克隆抗体进行识别,表明制备的单克隆抗体具有特异性,但却在Western blot 中无明显的杂交显色,分析原因后可能是Western blot 试验中SDS-PAGE 蛋白电泳导致重组蛋白变性,改变了其空间结构,而制备的单克隆抗体不具备线性识别位点,进行Dot blot,不破坏重组蛋白的空间结构。Dot blot 结果如图5A,制备的单克隆抗体能与纯化的重组蛋白杂交显色,而与大肠杆菌对照无杂交显色,表明制备的单抗能与FAdV-4 Fiber2 重组蛋白进行特异性识别,且识别与其空间结构有关;而图5C 中,单抗能与攻毒鸡肝组织研磨液杂交显色,而与健康鸡肝组织研磨液无杂交显色,表明虽然构建的Fiber2 是截断片段,但是也能识别出全长病毒,证明制备的单抗也可用于病毒检测中。将不同浓度的重组蛋白与制备的单抗进行Dot blot杂交,结果如图5B 所示。随着蛋白浓度的降低,单抗的杂交显色反应稍有下降,但不明显,分析原因可能是蛋白浓度过高,单抗特异性识别蛋白的下限可能在1×10-12级,表明其特异性和灵敏性较高。将不同拷贝数的染毒鸡肝组织研磨液与制备单抗进行杂交显色,结果如图5C 所示,随着病毒拷贝数的降低,杂交显色反应呈明显的线性下降趋势,表明单抗能检测到的最低病毒拷贝数为6.25×105个。制备的单克隆抗体不仅能特异性识别重组蛋白,也能识别出全长病毒,特异性及灵敏性都较高。
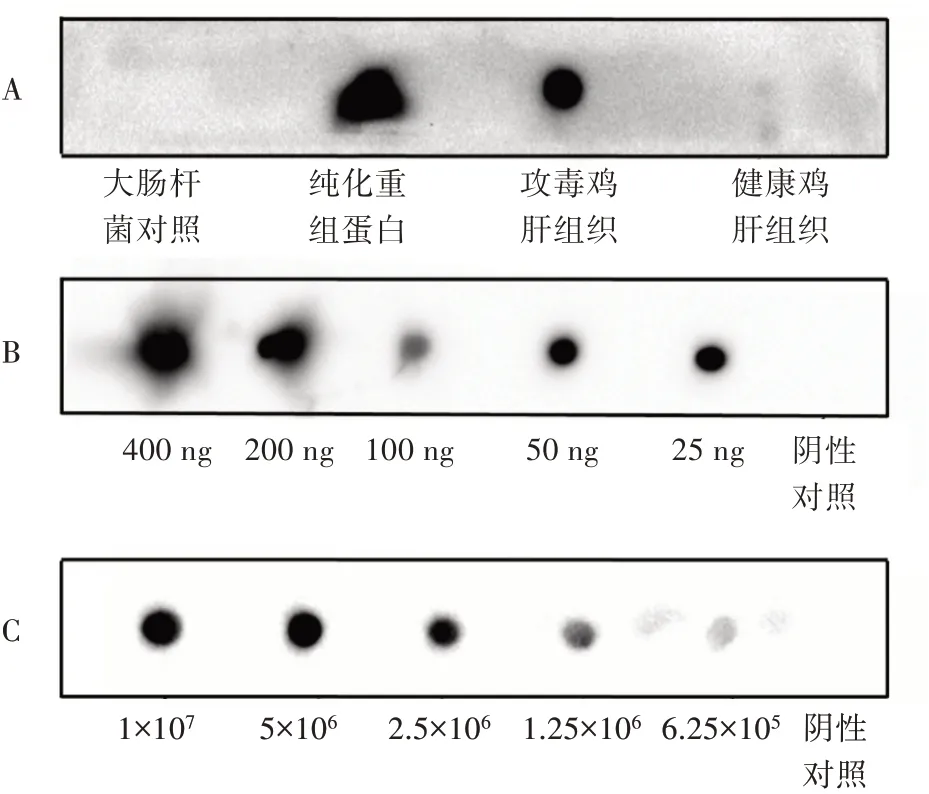
图5 斑点杂交检测单抗特异性
2.5.2 间接免疫荧光试验鉴定 为进一步验证制备的单克隆抗体的特异性,对感染FAdV-4 的鸡肝癌细胞进行间接免疫荧光试验IFA 分析。将正常培养的鸡肝癌细胞感染FAdV-4 后培养24 h,显微镜下观察结果如图6C 所示,鸡肝癌细胞开始有明显的病变,表明鸡肝癌细胞具有正常的生物学活性,并且感染鸡肝癌细胞的FAdV-4 具备一定的毒力。在染毒24 h 后加入制备的单克隆抗体,检测结果如图6A 所示,单抗与染毒FAdV-4 的鸡肝癌细胞呈现出特异性免疫反应,在荧光显微镜下可见绿色荧光;而未加单克隆抗体反应后无可见荧光如图6B。制备的单抗具有针对FAdV-4 Fiber2 的良好特异性。

图6 IFA 检测单克隆抗体特异性
3 小结与讨论
目前,国内对于FAdV-4 的研究多集中于病毒的分离鉴定及生物学特性研究,对其蛋白的结构与功能的研究多集中于Hexon[24]。其中哈尔滨兽医研究所通过反向遗传技术,首次证实了Hexon 基因的188 位氨基酸可以决定禽腺病毒的致病性[25];而除Hexon 外,Fiber2 基因在病毒感染和致死率中也发挥重要作用[24]。Fiber2 作为FAdV-4 的结构蛋白,其抗原表位具有主要的型特异性和亚属特异性,能有效诱导中和抗体产生[26];并且流行病学研究调查结果指出Fiber2 不仅是中国高致病性流行FAdV-4 毒力的关键毒力因子[24],而且还可以对FAdV-4 的高致病性感染提供有效的保护[9]。国内文献报道的重组Fiber2 表达蛋白多由于空间结构异常而形成包涵体[10,27],影响表达蛋白的生物学活性及构象,在纯化时需要经过变性与复性后才能变成具有一定活性的蛋白,且纯化操作繁琐[28];获得可溶性的Fiber2 蛋白会增加蛋白的生物学活性,有利于FAdV-4 的检测和疫苗的研发[5,29-31]。可溶性较好的Fiber2 蛋白,利用镍柱纯化后能得到大量且纯度较高的具有生物学活性的Fiber2 蛋白,并以此为基础制备了禽腺病毒4型的亚单位疫苗[32]。
目前,单克隆抗体制备常采用重组蛋白抗原和合成抗原多肽;用合成多肽做抗原相比于重组蛋白抗原,不用考虑包涵体引起的蛋白不可溶,减少了纯化条件的探究以及蛋白纯度的要求,但是合成多肽做抗原时需选取多个不同序列的肽段,避免因肽段选择不合适造成的免疫原性弱或者无反应原性的风险。选择FAdV-4 Fiber2 重组蛋白做抗原,利用其抗原决定簇来检测目的蛋白,通过大肠杆菌的表达体系可以在较短时间内获得大量的基因表达产物,且所需的成本相对较低,有利于后续商品化的生产;获得的重组蛋白可溶性较好,且经纯化后得蛋白纯度能达到95%以上,保证了免疫后所获得的抗体的特异性。本研究中间接ELISA 能够检测出腹水中的抗体,证明制备的单抗具备特异性;但是在Western blot 中却没有杂交反应,但能通过Dot blot 斑点杂交呈现出特异性的杂交条带。经分析后认为在Western blot 中的SDS-PAGE 蛋白电泳中蛋白变性导致蛋白结构发生变化,由三维空间结构变为线性条带,致使蛋白的识别位点发生变化,从而导致制备的单抗无法与重组蛋白特异性识别,Western blot 中无特异性杂交条带。同时单抗与染毒鸡肝组织研磨液Dot blot 杂交试验结果表明,所制备的单抗不仅能与重组蛋白发生特异性反应,也能特异性识别出完整的病毒。Dot blot 和IFA 试验结果均可检测到制备的单抗与FAdV-4 特异性反应,证明虽然构建的重组蛋白是Fiber2 的截短片段,但是制备的FAdV-4 Fiber2 蛋白单克隆抗体针对Fiber2 蛋白的构象表位,为进一步研究Fiber2 蛋白在禽病发病机制中的作用提供了一定的基础,同时也为禽腺病毒4 型的检测与防控,以及疫苗的评估提供了技术支持。
通过构建表达的FAdV-4 Fiber2 蛋白制备了单克隆抗体,效价高、特异性强,针对Fiber2 蛋白的构象表位,且具有良好的IFA 和Dot blot 反应原性,能特异性识别禽腺病毒4 型,同时也具有一定的中和活性,为禽腺病毒的检测、监测及预防提供了一定的参考,为检测试剂盒的研制及疫苗的评估奠定了基础。

