组蛋白修饰在水稻中的研究进展
杨涛, 马小倩, 张全, 张洪亮
(中国农业大学农学院,北京 100019)
表观遗传是指生物体内不依赖于DNA序列改变、可稳定遗传的变异,主要包括DNA甲基化、染色质重塑、基因组印记、非编码RNA以及组蛋白修饰等多种类型[1]。
在真核生物中,DNA缠绕在组蛋白八聚体(由2个拷贝的组蛋白H2A、H2B形成的异源四聚体与H3、H4形成的四聚体组装而成)形成核小体[2],这些缠绕着DNA的核小体经过复杂的空间折叠形成染色质。很多组蛋白基团可被翻译后修饰,组蛋白上各种各样的共价修饰在某些特定条件会发生动态变化,造成核小体和DNA的缠绕状态发生改变,进一步影响基因的表达水平[3]。
水稻作为世界上重要的粮食作物之一,也是禾谷类单子叶植物分子生物学研究的理想模式植物。研究水稻产量、品质以及抗逆性等重要性状的调控机制对提高水稻产量和品质具有重要意义。伴随着高通量测序的发展,表观遗传尤其是DNA甲基化及组蛋白修饰在水稻中对于生长发育、重要农艺性状、抗逆性等方面的研究取得了一系列重要进展。目前,关于组蛋白修饰在高等植物,特别是在重要农作物的研究热度呈持续上升趋势,本文详细剖析了组蛋白修饰在水稻中的研究进展,以期为现代农业生产中作物产量和品质的遗传改良、抗逆育种以及种质创新等相关研究提供理论参考。
1 组蛋白修饰类型
组蛋白的共价修饰主要发生在核小体的N端末端,近年来随着检测技术的进一步成熟,发现组蛋白的中间肽段位置以及C端也会被特异性修饰,这些修饰可以是甲基化、乙酰化、磷酸化、泛素化、核糖基化、SUMO(small ubiquitin-like modifier)修饰等,且不同的蛋白酶类控制不同位点的组蛋白修饰[4]。目前水稻组蛋白修饰研究较多的是甲基化和乙酰化。
1.1 组蛋白甲基化修饰
组蛋白甲基化可以作用在精氨酸和赖氨酸2个位点上。其中,精氨酸残基可以被单甲基化或双甲基化,双甲基化按照发生共价修饰的位置又包括对称性甲基化和非对称性甲基化;而赖氨酸残基可以发生单甲基化(me1)、双甲基化(me2)以及三甲基化(me3)[5]。组蛋白不同位点的赖氨酸或精氨酸发生不同水平的甲基化修饰程度,丰富了组蛋白甲基化修饰参与转录调控的类型。组蛋白甲基转移酶将S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)上的甲基转移到组蛋白赖氨酸或精氨酸位点上以完成对组蛋白的甲基化修饰。组蛋白甲基化对于下游基因的转录水平既可以与RNA聚合酶协同作用来激活转录,又可以维持异染色质上基因的转录抑制[6-7]。
1.1.1 组蛋白赖氨酸甲基化修饰 组蛋白赖氨酸甲基化转移酶(histone lysine methyltransferase)负责催化赖氨酸的甲基化修饰。大部分组蛋白赖氨酸甲基化转移酶包含SET(Su,enhancer of zeste,and trithorax)结构域,也有部分KMTs包含DOT1L(disruptor of telomeric silencing 1 like)结构域[8]。组蛋白赖氨酸甲基化发生的位点包括组蛋白H3第4位(H3K4)、第9位(H3K9)、第27位(H3K27)、第36位(H3K36)、第79位(H3K79)及组蛋白H4第20位(H4K20)等[9]。
拟南芥中已发现可催化H3K4甲基化的蛋白,包括铜伴侣蛋白ATX等。除催化H3K4发生甲基化的酶外,还有一些酶催化H3K4发生去甲基化,这些酶被称为H3K4去甲基化酶。目前,发现组蛋白赖氨酸特异性去甲基化酶1(lysine specific demethylase,LSD1)和某些 JMJ类的蛋白酶(含有JmjC结构域)具有H3K4去甲基化活性[10-11]。H3K4甲基化一般与基因的转录激活有关,其中,组蛋白H3第4位赖氨酸三甲基化(H3K4me3)最为重要,植物中大约有40%基因被H3K4me3修饰[12]。
水稻中共发现12个SET结构域蛋白家族(SET domain group,SDG),其中SDG710、SDG714和SDG727蛋白具有H3K9me2和H3K9me3甲基转移酶活性[13]。启动子区的H3K9me3通常与基因沉默有关[14]。
EZH2(enhancer of zeste homolog 2)是催化H3K27发生甲基化修饰的主要蛋白,其在发挥催化作用时需要形成多梳蛋白复合物PRC2(polycomb repressive complex 2)。H3K27甲基化使得组蛋白更加紧密,从而抑制基因的表达。此外,多梳蛋白复合物PRC1能够对H3K27甲基化修饰区域造成的基因沉默起维持作用[15]。
1.1.2 组蛋白精氨酸甲基化修饰 蛋白质精氨酸甲基化酶负责将S-腺苷甲硫氨酸SAM的甲基转移到组蛋白精氨酸位点的胍基上[16]。蛋白质精氨酸甲基化包括以下3种形式:精氨酸单甲基化(ω-NG-mono-methylarginine,MMA)、非对称精氨酸二甲基化(ω-NG,NG-asymmetric methylarginine,aDMA)和对称精氨酸二甲基化(ω-NG,NG-symmetric methylarginine,sDMA)。催化蛋白质发生精氨酸修饰的精氨酸甲基酶按照催化形式可以分为2种类型:蛋白质精氨酸甲基转移酶(protein arginine methyltransferase,PRMT)家 族 中 的 PRMT1、PRMT2、PRMT3、PRMT4、PRMT6和 PRMT8可催化形成单甲基化和非对称性二甲基化,属于第一类精氨酸甲基化酶;PRMT5、PRMT7和PRMT9可催化形成单甲基化和对称性二甲基化,属于第二类精氨酸甲基化酶[17-18]。在已发现的酶中,除了PRMT3、PRMT8和PRMT9外,精氨酸甲基转移酶均可以作用于组蛋白。
精氨酸残基的翻译后甲基化影响基因的表达,对许多细胞生物学过程具有调控作用,如信号转导、mRNA剪接和转录调控等[19-20]。拟南芥中AtPRMT5缺失导致多效性表型,包括开花延迟、生长迟缓、叶色变深绿、叶片卷曲及对春化的敏感性降低等,由此表明,AtPRMT5在拟南芥的基本发育过程中发挥重要的调控作用[21-23]。在atprmt5突变体中,由于KRP(kip-related proteins)基因启动子组蛋白H4R3甲基化减少造成KRP转录水平升高,导致芽的再生速率降低[24]。水稻中鉴定到8个编码蛋白精氨酸甲基转移酶(OsPRMTs)的基因,这些基因的编码蛋白在水稻不同组织中呈现不同的表达模式,如GFP标记的OsPRMT1、OsPRMT5和OsPRMT10定位于细胞质和细胞核,而OsPRMT6a和OsPRMT6b定位于细胞核,OsPRMT1、 OsPRMT4、 OsPRMT5、 OsPRMT6a、OsPRMT6b和OsPRMT10在体外表现出了精氨酸甲基转移酶活性[25]。
1.2 组蛋白乙酰化修饰
组蛋白乙酰化反应多发生在组蛋白N端的赖氨酸残基,通过组蛋白乙酰转移酶将乙酰辅酶A的乙酰基转移到组蛋白的赖氨酸残基上,该过程中和了1个正电荷,减弱了DNA与组蛋白的相互作用,使得DNA更容易与转录因子结合,因此组蛋白乙酰化往往与转录激活相关。组蛋白乙酰转移酶包括 GNAT(GCN5-related N-acetyltransferase)、MYST(MOZ-YBF2/SAS3-SAS2-TIP60)、CBP/p300(CREB-binding protein) 和 TAF1(TBP-associated factor 1)4个亚家族[26]。不同的乙酰转移酶负责催化不同的组蛋白位点:GNAT催化H3K14或 H3K12位点;MYST催化 H4K5;CBP/p300的作用位点较为广泛,对所有可以发生乙酰化的位点均有作用。GNAT是最大的组蛋白乙酰转移酶亚家族,包括GCN5(general control nondere-pressible 5) 、 PCAF (P300/CBP-associated factor)、Elp3(elongator protein 3)、Hat1(histone N-acetyltransferase 1)和 Hpa2(histone and other protein acetyltransferase)等。其中,GCN5是首个在酵母中被鉴定的组蛋白乙酰化酶,也是研究最为深入的组蛋白乙酰化酶之一[27-28];其是 SAGA(Spt-Ada-GCN5 acetyltransferase)复合物的核心组分,而该复合物是进化中非常保守的组蛋白乙酰化复合物[29-31]。
组蛋白乙酰化是可逆的过程,即在组蛋白去乙酰化酶的作用下组蛋白可发生去乙酰化。相比于组蛋白乙酰化酶,组蛋白去乙酰化酶的种类更多,并且数量更加庞大,目前鉴定到的组蛋白去乙酰化酶可以归为3个亚家族:RPD3/HDA1、HD2和SIR2[32],同时植物中还有其特有的去乙酰化酶家族,即第4类HD2亚家族[33]。
1.3 其他组蛋白修饰
相比于组蛋白甲基化和乙酰化修饰,其他的组蛋白修饰还有待深入研究。组蛋白泛素化是指泛素单体与组蛋白C末端结合的过程,主要发生在组蛋白H2A和H2B,组蛋白泛素化也是可逆的组蛋白修饰调控过程,通过特定的泛素蛋白酶可以使连接的泛素单体从底物脱落。组蛋白磷酸化修饰作为重要的翻译后修饰,能够通过改变蛋白与DNA或者蛋白与蛋白之间的相互作用重塑染色质结构,进而影响转录;最常发生磷酸化的氨基酸包括真核生物中的丝氨酸、苏氨酸、酪氨酸以及原核生物和植物中的组氨酸,这些氨基酸的磷酸化对于信号通路和生物代谢具有重要作用[34-35]。SUMO化修饰也是重要的翻译后修饰,参与胞核转运、转录调控、细胞凋亡、胁迫应答和细胞周期等多种细胞进程[36]。组蛋白乳酸化修饰是最近鉴定到的一种新型共价修饰,发生在赖氨酸位点,细胞代谢的小分子可以参与调控细胞信号以及基因表达。组蛋白乳酸化和组蛋白乙酰化类似,可以直接激活目标基因的表达。水稻中鉴定的组蛋白乳酸化修饰位点包括一些保守的位点[37],如H2BK114、H2BK60和 H2BK66,这些乳酸化修饰是否与水稻品质形成有关还有待进一步研究。
2 组蛋白修饰对水稻生长发育、逆境响应的作用
组蛋白修饰因子通过改变染色质状态调控生长发育相关基因的转录,从而影响水稻根、茎、叶等营养器官的发育以及抽穗期和开花等生长过程,此外组蛋白修饰还参与逆境胁迫应答(表1)。
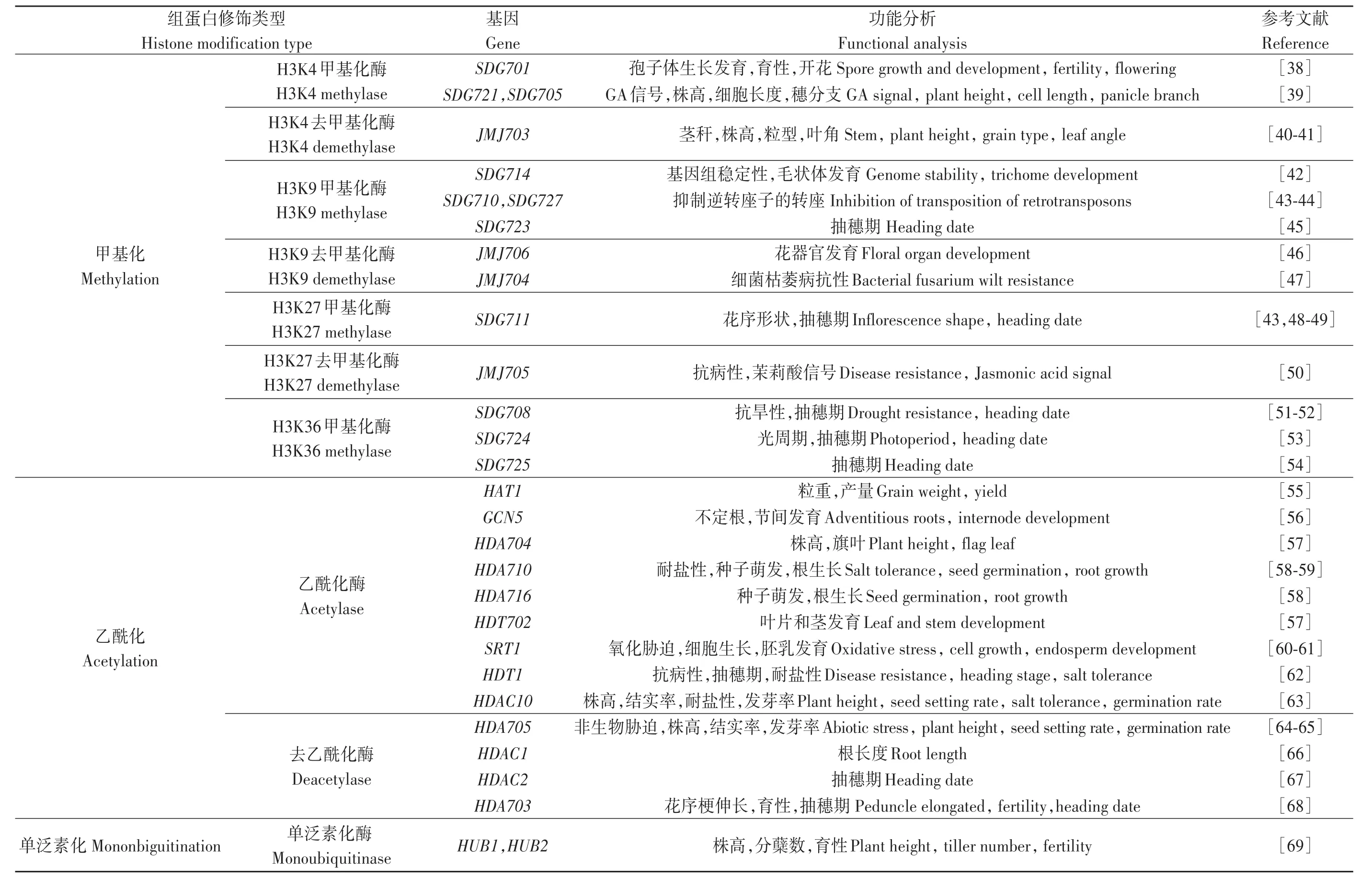
表1 水稻中部分已克隆的组蛋白修饰基因Table1 Part of cloned histone modification genes in rice
2.1 组蛋白修饰与营养器官发育
2.1.1 组蛋白修饰参与调控水稻根的发育 与野生型相比,组蛋白乙酰化酶基因GCN5 RNAi植株的冠根原基形成明显延迟,7日龄幼苗产生的冠状根较少,初生根长度、节间长度和幼苗高度也显著降低,成熟期为半矮秆,表明GCN5影响水稻冠状根的起始和伸长;进一步分析表明,RNAi植株根细胞数量和细胞层数减少,即GCN5可能在分
生组织细胞的横向和纵向分裂中起作用[33]。此外,WOX11-ADA2-GCN5三元复合物在水稻冠根分生区细胞分裂中起重要作用[33]。WOX11(WUSCHEL-related homeobox gene 11)与下游靶基因结合后,通过与ADA2(alteration deficiency in activation 2)互作招募乙酰化酶GCN5,GCN5对靶基因位点的组蛋白进行乙酰化修饰,改变靶基因的染色质状态,最终促进生长素转运、细胞组分和能量代谢等相关基因的表达[56]。OsHDAC1通过对OsNAC6启动子区组蛋白H3的K9、K14和K18以及组蛋白H4的K5、K12和K16进行去乙酰化来调控水稻根的生长[66]。由此可见,组蛋白修饰可与其他转录因子相互作用,通过改变下游基因的染色质状态实现对根系生长发育的调控。
2.1.2 组蛋白修饰参与调控种子发育和愈伤组织形成 在种子萌发阶段,过表达HDA705导致GA合成基因表达量降低,敲除HDA705后株高降低[64-65]。HDA710及HDA716可促进种子萌发及根的生长。在水稻成熟胚愈伤组织形成过程中,OsHDA710通过组蛋白脱乙酰作用抑制OsARFs表达来调节愈伤组织的形成[58]。SDG711介导的H3K27me3参与水稻种子胚乳发育,SDG711可直接与多个淀粉合成基因结合。此外,H3K4me3、H3K9ac与H3K27me3协同调节胚乳发育[48]。水稻SIR2家族中OsSRT1参与调控全基因组的H3K9ac水平,并与叶片中活性氧的积累、细胞生长以及胚乳的发育有关[60-61]。由此可见,组蛋白甲基化去乙酰化酶和组蛋白甲基化酶在水稻种子生长发育以及愈伤组织形成过程中发挥着重要作用,并且水稻胚乳的发育过程还存在着不同组蛋白修饰之间的协同调控作用。
2.1.3 组蛋白修饰参与调控水稻株高及叶片的发育 H3K4位点的去甲基化酶基因JMJ703参与调控水稻株高,该基因突变后,导致细胞分裂素氧化酶基因CKX启动子区域H3K4me3水平升高,进而促进了该基因的表达,导致水稻株高降低[40-41]。SDG721和SDG705功能的丧失导致GA缺陷表型,包括半矮化、细胞长度减少等。SDG721和SDG705基因被敲除后,GA生物合成基因和GA信号通路基因的转录水平和H3K4me3水平被下调[39]。SDG714编码组蛋白H3K9特异性甲基转移酶,SDG714的C末端决定了酶活性和底物特异性,N末端将其定位于细胞核中。SDG714功能丧失突变体由于颖片、叶子和茎秆缺少宏观毛状体导致大部分无毛的表型[42]。HDA704沉默则影响株高及旗叶的生长;HDT702低表达则抑制叶片和茎的发育等[57]。由此可见,组蛋白修饰蛋白参与了水稻茎秆以及叶片的发育调控,其中JMJ703、SDG721和SDG705与细胞分裂素和赤霉素信号相关。
2.1.4 组蛋白修饰参与水稻分蘖的调控 NGR5(nitrogen-mediated tiller growth response 5)受氮素诱导表达,对D14、OsSPL14等分蘖抑制基因相应位点进行H3K27me3甲基化修饰抑制其表达,从而实现对水稻分蘖的调控。在半矮杆背景下,可通过超表达NGR5来提高低氮水平下的水稻产量,此外NGR5被发现为赤霉素受体GID1的新靶标,受其负调控,NGR5和PCR2介导的H3K27me3参与了赤霉素信号响应,对新一代“绿色革命”育种实践具有重要意义[70]。OsVIL2(vernalization insensitive 2-like protein)可与分蘖调控的关键基因OsTB1(teosinte branched 1)的启动子区域结合,介导的H3K27me3也参与对OsTB1的调控,因此OsVIL2通过染色质修饰抑制OsTB1表达,从而诱导分蘖芽生长[71]。H3K27me3参与调控水稻分蘖,并靶向D14和OsSPL14等分蘖抑制基因。
2.2 组蛋白修饰与抽穗期以及穗部发育
2.2.1 组蛋白修饰参与调控水稻抽穗期 抽穗期是水稻重要的农艺性状,由品种遗传特性决定,是水稻生长发育过程中由营养生长转向生殖生长的关键时期。抽穗期过短导致基本营养缺乏、植株矮小影响最终产量;抽穗期过长会因气温降低影响籽粒成熟,最终减产甚至绝收。
SDG701蛋白直接与成花素基因Hd3a和RFT1相结合,通过建立H3K4me3修饰来促进成花素基因的表达,进而调控水稻开花[38]。OsTrx1编码SET结构域包含蛋白SDG723,SET结构域具有组蛋白H3甲基转移酶活性,因此,OsTrx1的PHD基序能与组蛋白H3结合,对来自寡核小体的组蛋白H3K4位点甲基化;OsTrx1位于Ehd1上游,为Ghd7的负调控因子,参与调控水稻开花[45]。SDG711是Zeste增强子,属于核心的PcG蛋白,其编码基因的过量表达或下调表达,在长日照下(long day,LD)抑制或促进开花,但在短日照下没有作用。SDG711在LD条件下抑制OsLF(Hd1抑制因子),促使Hd1高表达,导致开花延迟;在LD条件下,SDG711还会抑制Ehd1表达[49]。SDG708敲除突变体中,Hd3a、RFT1和Ehd1的H3K36me1、H3K36me2和H3K36me3的修饰水平均有降低,导致基因表达量降低,水稻开花延迟[51]。MORF相关蛋白702(MRG702)在体外与三甲基化H3K4和H3K36(H3K4me3和H3K36me3)结合,作为阅读蛋白来破译甲基化信息,参与油菜素内酯信号传导以及调控花期,即呈现出与SDG725功能缺失突变体相似的表型[72]。此外,SDG724调控MADS转录因子家族基因MADS50和成花素基因RFT1的启动子区域H3K36me2/3,从而促进水稻开花[53]。转录因子OsSUF4识别特定元件,并招募H3K36甲基转移酶SDG725,通过调控成花基因RFT1和Hd3a表达来促进水稻开花[54]。植物特有的组蛋白去乙酰化酶HD2亚家族成员OsHDT1介导了长日照条件下水稻Shanyou 63(SY63)开花关键基因OsGI和Hd1的组蛋白H4去乙酰化,从而抑制基因的表达,促进开花[62]。OsSFL1(SAP30 functional like 1)可与OsHDAC2互作,靶向水稻开花基因Hd1,通过调控H3乙酰化水平调控该基因表达,进而调控花期[67]。组蛋白去乙酰化酶OsHDA703可与OsBZR1互作调控BR信号和植物生长,通过调控Ghd7的H4去乙酰化水平来调控抽穗期[68]。FRRP1编码E3连接酶(C3H4型环指结构域蛋白),影响组蛋白H2B单泛素化,调控花期和产量相关基因的表达,最终影响水稻抽穗期和产量[73]。综上所述,水稻中SET结构域家族蛋白SDG701、SDG723、SDG711、SDG708、SDG725和SDG724等组蛋白甲基化酶参与调控水稻抽穗期,此外组蛋白去乙酰化和组蛋白单泛素化在调控水稻开花时间也发挥了重要作用。
2.2.2 组蛋白修饰参与调控水稻穗部性状SDG701编码H3K4甲基转移酶,对水稻孢子体生长发育和配子传递的正常进行具有重要意义,其异常表达直接影响水稻结实[38]。JMJ706编码与异染色质相关的H3K9脱甲基酶,JMJ706蛋白在体外特异性地去除组蛋白H3第9位赖氨酸位点的二甲基化和三甲基化;该基因的功能丧失突变导致H3K9的二甲基化和三甲基化增加,影响花和小穗发育,如改变花的形态和器官数量等[46]。SDG727和SDG710对组蛋白H3K9去甲基酶JMJ706有拮抗作用,这些基因的下调表达能够部分互补jmj706的表型,并且降低H3K9的甲基化。SDG711介导的H3K27me3能抑制参与花序分生组织活性的多个重要基因,过量表达SDG711能增加花序分生组织活性,使穗部增大[43-44]。降低HDA703的表达可抑制花序梗的伸长及育性[70]。GW6a编码组蛋白乙酰转移酶的类GNAT蛋白OsHAT1,其调控水稻粒重、产量和植株生物量[55]。OsHUB1和OsHUB2在核内存在互作,介导组蛋白H2B单泛素化,调控绒毡层降解相关基因的表达;并且与H3K4me2协同影响水稻花药发育[69]。由此可见,组蛋白修饰与水稻花序分生组织发育等穗部性状形成有关,对穗粒数、结实率等水稻产量性状具有重要作用。
2.3 组蛋白修饰与生物和非生物胁迫
除对植物生长发育有影响外,组蛋白修饰还参与水稻生物和非生物胁迫相关基因的表达调控。
2.3.1 组蛋白修饰参与调控水稻抗病性 jmj704突变体中H3K4me2/3水平显著升高,表明JMJ704参与调控H3K4me2/3去甲基化,JMJ704通过减少下游靶基因上的激活标记H3K4me2/3,从而下调NRR、OsWRKY62和Os-11N3等水稻防御负调节基因的转录水平实现正向调控水稻对细菌枯萎病的抗性[47]。水稻JMJ705为拟南芥REF6的同源蛋白,该蛋白参与H3K27me3修饰的去除,超表达JMJ705基因产生明显的假病斑表型,而jmj705突变体的感病性增强,表明JMJ705参与水稻H3K27me3修饰的去除和基因表达的激活[50]。OsHDT1影响全基因组H4乙酰化水平,当其被抑制后全基因组H4乙酰化水平上升,从而提高抗病相关基因的表达量,增强水稻对稻瘟病菌的抗性[62]。
2.3.2 组蛋白修饰参与调控水稻非生物胁迫抗性 生物钟核心转录因子OsPRR73能通过组蛋白去乙酰化酶HDAC10在转录水平上抑制OsHKT2;1表达,在特定时间内减少钠离子的吸收,以避免钠离子过度积累。盐胁迫耐受性方面,OsHKT2;1位于OsPRR73下游,通过调节钠离子稳态和活性氧水平调控水稻耐盐性[63]。HDA705参与ABA和非生物胁迫的响应,过表达HDA705导致GA合成基因的表达量降低,而ABA合成基因的表达量增加[64-65]。组蛋白H3K4me3修饰和转录因子OsbZIP23在水稻干旱胁迫条件下调控脱水蛋白基因簇的相互作用。当H3K4me3修饰水平增加时,脱水素基因表达水平增加,OsbZIP23与脱水素基因启动子的结合水平也增强,转录因子和H3K4me3修饰在干旱响应基因调控中具有协同作用[76]。SDG708通过直接靶向和激活关键的ABA生物合成基因OsNCED3和OsNCED5来促进ABA生物合成。在正常和干旱胁迫条件下,SDG708的过表达增强了水稻的耐旱性,从而提高水 稻 的 产 量[52]。 HDA710 通 过 改 变 OsLEA3、OsABI5、OsbZIP72和OsNHX1等ABA和盐胁迫响应基因启动子中H4乙酰化水平来调控基因表达,从而响应盐胁迫应答[59]。茉莉酸受体蛋白基因OsCOI1a启动子区域的DNA甲基化和H3K9me2水平影响该基因的表达,表观遗传修饰和茉莉酸信号共同调控水稻对除草剂的抗性[74]。综上所述,组蛋白修饰对水稻抗除草剂、耐盐和抗旱性具有重要意义。
2.4 组蛋白修饰的作用机制
组蛋白修饰作为重要的表观遗传类型,不同的共价修饰类型对组蛋白与组蛋白、组蛋白与DNA之间的作用具有显著影响,从而对基因转录和表达实现调控作用。在水稻中,组蛋白修饰对生长发育、产量、品质、适应性以及抗性等相关基因的表达进行调控,从而影响水稻生长发育(图1)。

图1 组蛋白修饰在水稻生长发育、抗逆等过程中的作用机制Fig.1 Role mechanism of histone modification in the process of rice growth,development and stress tolerance
3 展望
表观遗传作为一个新兴的研究领域,是当前生命科学的研究热点之一。随着染色质免疫共沉淀技术及第三代测序技术的不断发展,水稻组蛋白修饰的研究取得了重大进展。然而,与哺乳动物和模式植物拟南芥相比,水稻组蛋白修饰的研究相对滞后,目前组蛋白修饰的研究多集中在H3K4、H3K27和H3K9等几个特定位点,且修饰的类型也局限于甲基化、乙酰化等常见类型。借鉴其他物种中组蛋白修饰的研究成果将为水稻组蛋白修饰的研究开创更大的发展空间。随着生物信息学的不断发展,研究组蛋白修饰在水稻生长发育以及产量和品质形成的分子机制,利用组蛋白修饰等表观遗传效应改良水稻的产量、品质以及抗逆性有着广泛的应用前景。

