不同稀释法对公猪冷冻精液品质的影响
周 健,曹婷婷,2,曹俊新,赵云翔,2
(1.广西贵港秀博基因科技股份有限公司,广西 贵港 537100;2.佛山科学技术学院生命科学与工程学院,广东 佛山 528000)
公猪精子对温度变化十分敏感,在冷冻保存过程中极易受到冷冻损伤,虽然Polge等[1]在1956年首次运用冻精技术进行人工授精(AI)并获得仔猪,但是到目前为止世界范围内猪冷冻精液应用比例仍没超过1%。冷冻保护液是影响冻精冷冻效果的主要因素之一,目前常用以卵黄为基础的稀释液添加冷冻保护剂来进行冻精研究。常用的冷冻保护剂有甘油、DMSO(二甲基亚砜)、乙二醇等,这些渗透性冷冻保护剂虽然具有优异的抗冻作用,但均具有细胞毒性,所以多数会在冷冻前进行添加,以降低不良影响。一步稀释法和两步稀释法进行精液冷冻主要是针对冷冻保护剂的细胞毒性衍生出来的冷冻方法,虽然现在以两步稀释法冷冻公猪精液在实验室层面得到满意且稳定的冷冻效果,但两步稀释法在实际生产中会增加处理时间。为提高生产效率,进行一步稀释冷冻试验,探索一步稀释法冷冻猪精技术。据相关报道,不同稀释方法的冻精研究已在绒山羊[2]、牛[3]、犬[4]等动物上得到应用,但冷冻效果参差不齐。为了提高精子的冻融质量,OEP (Orvus ES Paste)、ESP(Equex STM Paste)作为新型冷冻保护剂已被应用到冻精研究中。OEP、ESP是一类表面活性剂,对精子膜结构有保护修补作用,主要含有十二烷基硫酸钠(SDS)复合物,能够提高冻融精子活率、活力及质膜完整率[5]。精液在超低温下可以长期有效的保存,这对于保护种猪种质资源及基因传递具有突出的优势。
1 材料与方法
1.1 试验动物及精液采集
试验动物为沈阳秀博种猪繁育科技有限公司提供的体质健壮、性欲旺盛的6头成年杜洛克公猪,采集2021年12月份公猪精液作为样本,在扬翔农牧育种中心北方冻精实验室进行试验。每头公猪精液均分成2份,每份3个重复,分别进行一步稀释法冷冻精液和两步稀释法冷冻精液。使用自动采精设备对试验公猪进行原精采集,通过精液传动系统将采集好的原精传送到精液检测实验室,利用IVOS II(法国,IMV)精子自动检测仪进行精液质量评估。原精要求:精子活力≥90%,精子密度≥2亿/mL,精子畸形率≤10%。
1.2 主要试验仪器及试剂
TurboFreezerM程序冷冻仪(米尼图)、HH-6数显恒温水浴锅(常州澳华)、EasyCoder 2.0色带打印机(米尼图)、KDC-2046低速冷冻离心机(安徽中科)、冷冻精子平衡柜(米尼图)、精子检测分析仪(IVOS II, IMV)、单头灌装机MPPUno(米尼图)、0.5 mL冻精细管(米尼图)。甘油(Sigma)、乳化剂Equex-Paste(米尼图)、柠檬酸钠(Sigma)、果糖(Sigma)、Androstar®CryoPlus、新鲜卵黄。
1.3 冷冻保护液配制
Ⅰ组冷冻保护液配制:首先在1 000 mL的烧杯中准确倒入770 mL超纯水,在磁力搅拌器上搅拌并加热至34 ℃,此时缓缓倒入Androstar®CryoPlus基础稀释粉,充分搅拌溶解,待溶液pH稳定后加200 mL新鲜卵黄并充分搅拌溶解,向溶液中添加30 mL甘油和5 g乳化剂Equex-Paste,充分搅拌溶解后使甘油浓度为3%、乳化剂Equex-Paste浓度为0.5%,作为Ⅰ组冷冻保护液。
Ⅱ组冷冻保护液配制:本组冷冻保护液分为冷却液A和冷冻液B,主要配制如下:用770 mL超纯水溶解Androstar®CryoPlus基础稀释粉,34 ℃下充分搅拌溶解,待溶液pH稳定后加200 mL新鲜卵黄并充分搅拌溶解,取出500 mL作为冷却液A;向剩余溶液中添加30 mL甘油和5 g乳化剂Equex-Paste,充分搅拌溶解后作为冷冻液B,冷冻液B中甘油和乳化剂含量分别为6%和1%。
1.4 精液冷冻处理
1.4.1 Ⅰ组冷冻保护液冷冻处理(一步稀释) 检测合格的精液使用常温稀释液进行1~2倍等温稀释,梯度降温至17 ℃,在此温度下900 g离心20 min,抽弃上清液后添加Ⅰ组冷冻保护液,调整精液终密度为8亿/mL,充分混匀悬浮后置于5 ℃平衡柜中降温150 min,使用单头灌装机(MPPUno)灌装成0.5 mL/支进行程序化冷冻,具体降温曲线如下:5 ℃降至-6 ℃用时200 s,-6 ℃停留60 s,-6 ℃降至-100 ℃用时144 s,-100 ℃降至-140 ℃用时80 s。
1.4.2 Ⅱ组冷冻保护液冷冻处理(两步稀释) 使用Ⅰ组同样的方法进行原精稀释并17 ℃离心,之后添加冷却液A,使用移液器悬浮混匀后放置于5 ℃平衡柜中降温150 min,添加含有甘油和乳化剂Equex-Paste的冷冻液B,调整精液终浓度为8亿/mL,充分涡旋混匀后灌装成0.5 mL/支,使用与一步稀释相同的降温程序进行冷冻。
1.5 冻精解冻及精子运动性检测
从液氮罐中取出冻存3 d以上的冻精细管,迅速放入50 ℃水浴锅中,水浴解冻16 s,迅速拿出放入到34 ℃水浴中缓孵,使用吸水纸擦干细管,把管中气泡轻摇到封口段,在气泡处剪开,开口向上,翻转细管把精液流入预先预热至34 ℃的解冻液中,1支冷冻精液加入到8 mL解冻液中,平衡5~20 min,使用IVOS II精子分析仪进行精子运动性能评估,主要检测参数包括活力(MOT,%)、前向精子(PM,%)、VCL(曲线速度,μm/s)、VSL(直线速度,μm/s)、VAP(平均路径速度,μm/s)、ALH(精子头侧摆幅度,μm)、LIN(直线性,%)、STR(前向性,%)及BCF(鞭打频率,Hz)。
1.6 解冻后精子质膜完整性评估
本试验采用低渗肿胀试验来评估解冻后精子质膜完整性(plasma membrane-intact, PMI),根据Revell等[6]的方法配制低渗肿胀液,低渗肿胀液(HOST)配制:将0.735 g柠檬酸钠和1.351 g果糖溶解在100 mL超纯水中来制备HOST溶液(渗透浓度约190 mOsmol/kg)。为了评估精子质膜的完整性,解冻后将50 μL精液样品与500 μL预热的HOST溶液混合,并在37 ℃下孵育30 min。温育后,取1滴精液进行400×显微镜检测。判断标准:尾部肿胀弯曲的预示完整的、具有生物学活性的精子膜,尾部未膨胀弯曲的表明损坏的、无正常生物学功能的精子膜,见图1。
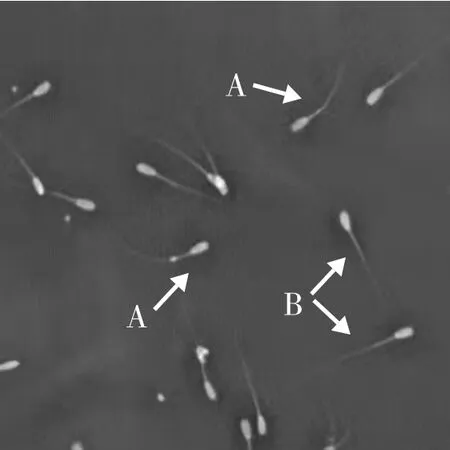
图1 低渗肿胀试验
1.7 数据统计与分析
数据先使用Excel处理,再使用SAS 9.2软件进行单因素方差检验,结果以平均值±标准差表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 试验结果与分析
冷冻解冻后精子活力(MOT)、前向精子(PM)、直线速度(VSL)、曲线速度(VCL)、平均路径速度(VAP)、鞭打频率(BCF)及质膜完整性(PMI)两组之间差异极显著(P<0.01),而解冻后直线性(LIN)、前向性(STR)、精子头侧摆幅度(ALH)两组之间差异不显著(P>0.05),详见表1和表2。
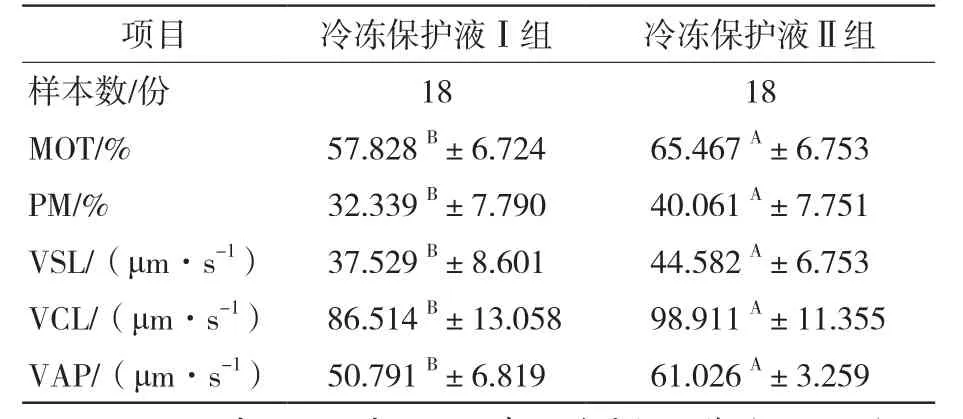
表1 解冻后精子活力、前向精子以及运动速度对比
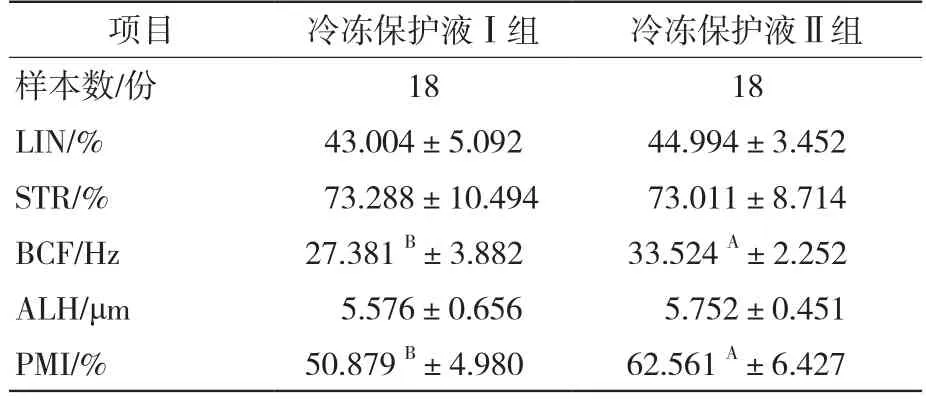
表2 解冻后精子运动参数及质膜完整性对比
3 讨论
本试验结果表明,杜洛克精液17 ℃离心后两步稀释法的冷冻效果优于一步稀释法,两步稀释法冻融后精子运动性能和质膜完整性高于一步稀释法。路佩瑶等、胡月超、王素梅等分别在绒山羊、公牛和宠物犬上进行相似的研究[2-4],但与本试验不同的是冷冻保护液里没有添加OEP类物质。
众所周知,甘油是十分常用的渗透性冷冻保护剂,但甘油本身也具有一定的细胞毒性,对精子毒性的大小与浓度相关[7]。甘油与精细胞较长时间接触会诱导膜的不稳定。甘油对精子提供低温保护效果的同时,由于冷冻的前处理会对精子结构造成一定的损害,这种损害目前是不可避免的。在一步稀释法中甘油与精子接触时间较长,增加了甘油对精子膜的损伤,本试验也证明了这一点。若一步稀释法中缩短5 ℃平衡时间,或许会提高精液冷冻效果。刘兴伟等[8]冷冻辽宁绒山羊精液的研究结果表明,在先用不含甘油的稀释液进行第1次稀释,在冷冻前再用含甘油的稀释液进行第2次稀释,其冷冻效果优于直接使用含有甘油的一次稀释法。而吴云海等[9]对种公牛精液的研究结果表明,采用一步稀释法稀释精液同样也能达到比较理想的冷冻效果。这可能是与不同物种的精子对甘油毒性的耐受程度有关。
相关报道指出,在冷冻稀释剂中添加乳化剂Orvus ES Paste(OEP)可更好地保护质膜[10]。据李新红等[11]研究证明,OEP可使卵黄中的有益成分与犬精子膜更好地相互作用,从而降低冷冻损伤。在含有鸵鸟卵黄和甘油的稀释剂中添加0.25%和0.50%的OEP可以增强精子冻融后线粒体功能、总运动性、质膜完整性和顶体完整性[12]。Peña等[13]认为,ESP、OEP等成分具有黏性,对精子膜结构中的脂类具有稳定作用,可以降低或者阻碍由冷冻保存所引起的似获能性变化,从而起到保护质膜和顶体的作用。而Pontbriand等[14]猜测OEP不是直接作用于精子质膜,而是通过乳化卵黄中的类脂形成较小聚合体,这些微小的类脂聚合体更有利于维持精子质膜的流动性,从而达到保护作用,这种猜测还没有确切的证据来证明。
本试验与其他类似试验不同的是,同时控制甘油和OEP分步添加,虽然两组试验其终浓度保持一致,但两者对精子的作用时间不同,这可能是造成冷冻效果不同的主要原因。本试验采用终浓度0.5%的OEP进行两步稀释冷冻试验,得到了比较满意的冷冻效果,这与Fraser等[12]的试验结果类似。从一步稀释试验的结果看,甘油和OEP在17 ℃离心后直接添加对精液冷冻产生了不利影响,除了甘油本身的毒性所致,还没有相关报道证明是因为OEP直接添加所致。根据相关报道精子细胞长时间暴露于经SDS处理的卵黄基础稀释液中可能对精子功能产生负面影响[15-16],因此可以大胆地猜测较高浓度的OEP跟精子较长时间的接触也可能会对杜洛克精子产生不利影响,这可能是造成第一组试验冷冻效果差的原因之一。
4 结论
使用本试验冷冻保护液进行公猪精液冷冻,17 ℃离心后采用两步稀释法进行冷冻后,其解冻后精子活力、前向精子、精子运动速度和质膜完整性等参数显著高于一步稀释组。

