EMS诱变对糜子种子出苗及幼苗生长的影响
闫锋 李清泉 董扬 季生栋

摘要:为了使甲基磺酸乙酯(EMS)诱变在糜子育种中发挥最佳效果,获得优质的诱变材料,对糜子新品种齐黍2号进行了4种EMS浓度、3种处理时间的诱导处理,并对当代的种子出苗及幼苗生长情况进行研究。结果表明,与对照相比,低剂量EMS处理(0.3%,6 h)對糜子相对出苗、成苗率以及幼苗生长影响差异不显著,随着EMS浓度升高及处理时间延长,糜子出苗及幼苗生长逐渐受到抑制,1.2%EMS浓度14 h处理对糜子出苗及幼苗生长影响最严重,大大降低相对出苗率、相对成苗率,幼苗生长受到严重抑制。以相对成苗率达到半致死剂量为标准,0.9%EMS浸种10 h或0.6%EMS浸种14 h可作为EMS诱变糜子建立突变体库的适宜条件。
关键词:糜子;种子萌发;幼苗生长;EMS诱变
中图分类号:S516.01 文献标志码: A
文章编号:1002-1302(2022)10-0094-04
糜子(Panicum miliaceum L.)起源于我国,已经有7 000多年的栽培历史,具有生育期短、耐瘠薄、耐旱等优点,是我国干旱、半干旱地区重要的特色杂粮作物[1]。糜子在长期的人工选择及驯化过程中,遗传基础愈发狭窄,很多特异资源不断消失。种质资源是生物多样性的重要组成部分,是种质创新的重要物质基础[2]。种质资源创新的方法较多,人工理化诱变是目前改善种质资源匮乏、拓宽遗传背景的常用方法[3]。甲基磺酸乙酯(EMS)是一种高效、稳定的化学诱变剂,具有突变率高、成本低、操作简单、突变范围广且突变性状稳定等优点,已被广泛用于农作物种质资源创新[4],如玉米[5]、水稻[6]、大豆[7]等作物。
有关EMS诱变在糜子育种中的相关研究较少,张彬等选用1.0%EMS对伊选大红糜进行诱变,所构建的糜子突变体库材料变异类型非常丰富,共发现104个形态性状突变株系,突变频率为4.5%,包括叶型、叶色、株高、育性、生育期、穗型、粒色等性状[8]。经查阅文献,鲜见EMS对糜子诱变效应的相关报导。本试验以糜子新品种齐黍2号为材料,通过探究不同EMS浓度、浸种时间对糜子种子萌发及幼苗生长产生的影响,从而筛选出适宜糜子的EMS诱变优化条件,以期为糜子突变体库构建及种质资源创新奠定理论基础。
1 材料与方法
1.1 供试材料与试剂
试验于2020年在黑龙江省农业科学院齐齐哈尔分院实验室进行,以本单位选育的糜子品种齐黍2号作为试验材料。EMS诱变剂购自上海麦克林生化科技有限公司。
1.2 试验设计
1.2.1 EMS处理方法
选取颗粒饱满的齐黍2号种子,先用8%NaClO溶液消毒15 min,然后用蒸馏水冲洗2次,浸种8 h吸胀后沥干水分备用。用 0.1 mol/L 磷酸缓冲液(pH值=7.0)配制体积分数分别为0.3%、0.6%、0.9%和1.2%的EMS溶液,以磷酸缓冲液为对照。每个处理取100粒吸胀种子,置于100 mL锥形瓶中,分别加入50 mL不同浓度的EMS溶液,然后用锡纸包裹严实以防止EMS见光分解,在转速为120 r/min的摇床中分别均匀摇晃6、10、14 h,每个处理3次重复,EMS诱变处理后的种子用自来水冲洗2 h,然后再用蒸馏水漂洗3次。用滤纸吸干种子表面水分后播种于直径为 8 cm 塑料花盆中(每盆播5粒种子),置于湿度为70%、温度为28 ℃的人工智能气候箱中培养,培育期间水分供给保持一致。
1.2.2 种子发芽及幼苗形态指标测定
播种后每天观察萌发情况并统计各处理出苗数,计算各处理出苗率和相对出苗率,出苗第10天每个处理随机选取10株幼苗测定苗高、根长。出苗30 d后计算成苗率和相对成苗率。计算公式如下:
出苗率=(出苗总数/供试种子数)×100%;
成苗率=(成活苗总数/供试种子数)×100%;
相对出苗率=(处理的出苗率/对照出苗率)×100%;
相对成苗率=(处理的成苗率/对照成苗率)×100%。
1.2.3 电导率的测定
将每个EMS处理的种子取20粒,蒸馏水漂洗后用滤纸吸干水分,置于小烧杯中,倒入10 mL蒸馏水浸泡,30 min后测定电导率,以蒸馏水为对照。
1.3 数据分析
采用Excel 2007对试验数据进行统计及作图,采用DPS 7.05软件进行方差分析。
2 结果与分析
2.1 EMS处理对种子浸出液电导率的影响
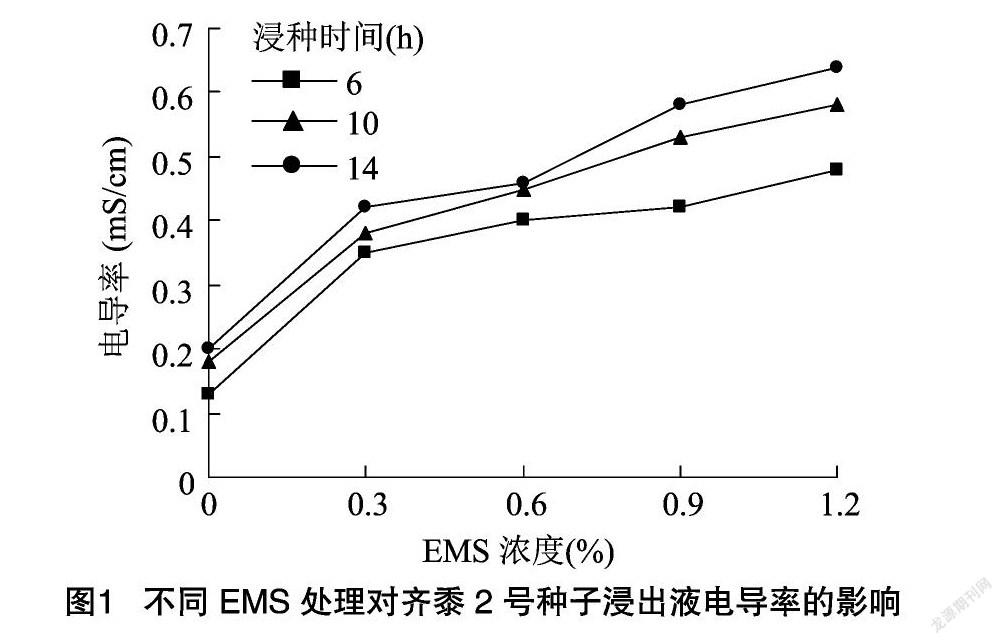
由图1可知,在经过EMS处理后,糜子种子浸出液电导率相比对照大幅升高,随着EMS浓度升高及处理时间延长,电导率也随之增加,但是增长幅度有所变缓;6、10、14 h这3种浸种时间处理下,电导率均在EMS浓度为1.2%达到最高,分别为0.48、0.58、0.64。在3种浸种时间处理下电导率由大到小依次14 h>10 h>6 h。
2.2 EMS处理对糜子出苗进程的影响
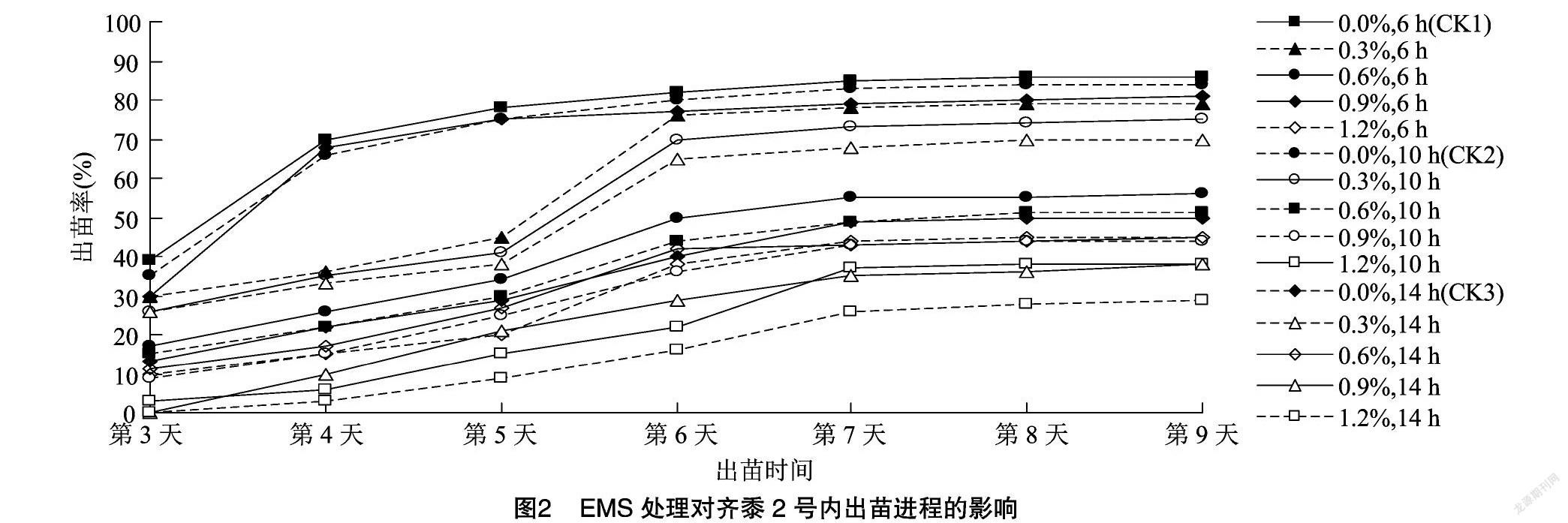
EMS处理对糜子出苗进程有延迟和抑制作用(图2),15个处理中有13个处理在第3天破土出苗;出苗最晚的是EMS 0.9%和1.2%浓度下浸种14 h这2个处理,均在第4天出苗。3个对照的出苗高峰均在第4天,随后出苗速度变缓;在EMS浓度为0.3%下浸种6、10、14 h这3个处理的出苗高峰在第6天,随着时间推移出苗速度也逐渐变缓;其余处理出苗高峰并不明显。播种第7天所有处理出苗率趋于稳定,至第9天所有处理基本出苗完毕。
2.3 EMS处理对糜子出苗率和成苗率的影响
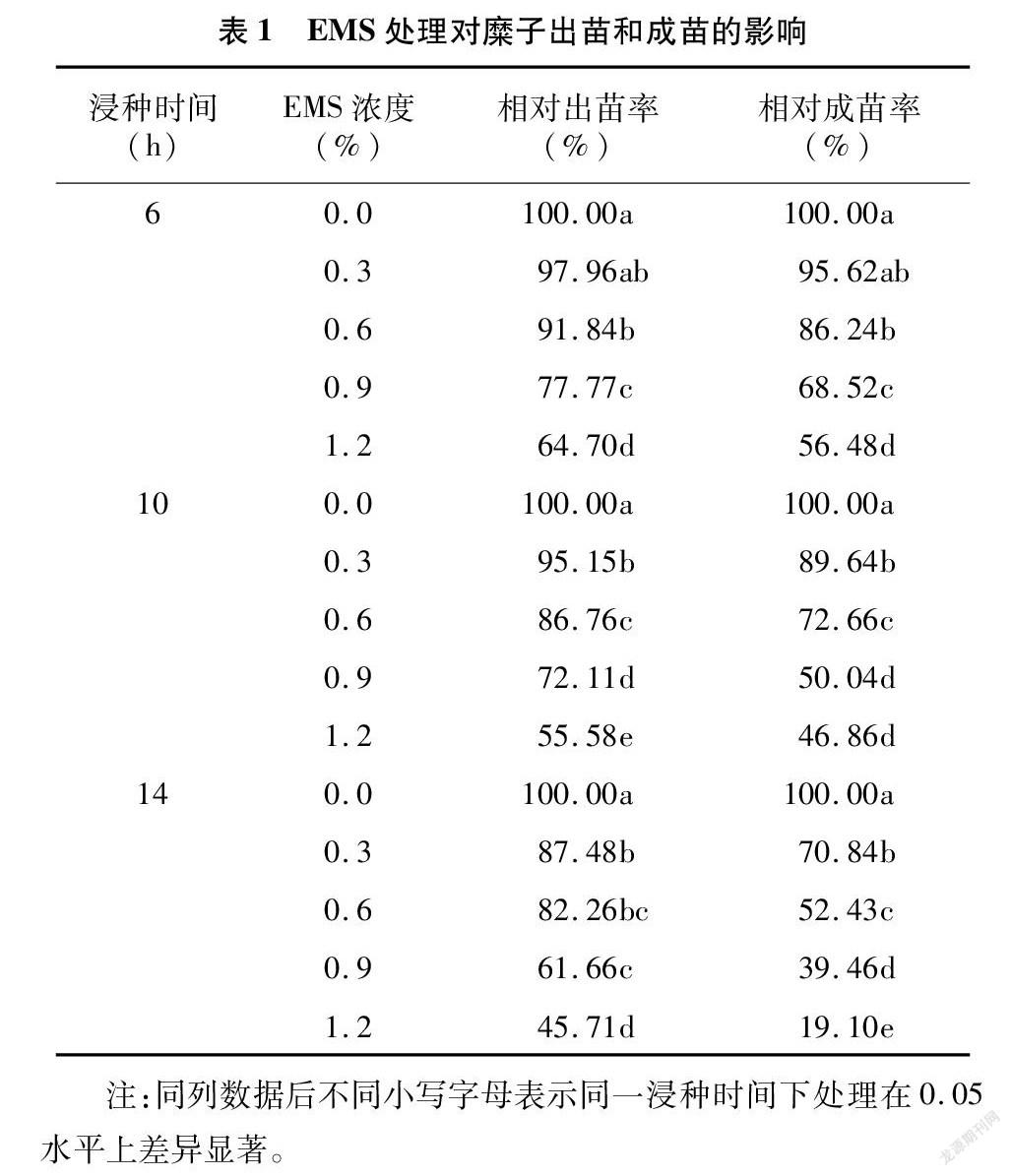
由表1可知,EMS处理对糜子种子萌发产生了抑制作用,并随EMS浓度升高及处理时间的延长,相对出苗率和相对成苗率均呈下降趋势。低浓度下,0.3%EMS处理6 h的相对出苗率和相对成苗率与对照差异不显著,其他EMS处理的相对出苗率和相对成苗率均显著低于对照(P<0.05)。1.2%EMS处理14 h的相对出苗率和相对成苗率在所有处理中均最低,种子萌发受到严重抑制。通常以半致死剂量作为适宜处理剂量。本试验中 观察不同处理的幼苗致死情况,0.9%处理10 h和0.6%处理14 h的相对成苗率分别为50.04%和52.43%,接近半致死剂量,可作为EMS诱变糜子建立突变体库的适宜浓度和时间。
2.4 EMS处理对糜子幼苗生长的影响
2.4.1 EMS处理对糜子苗高的影响
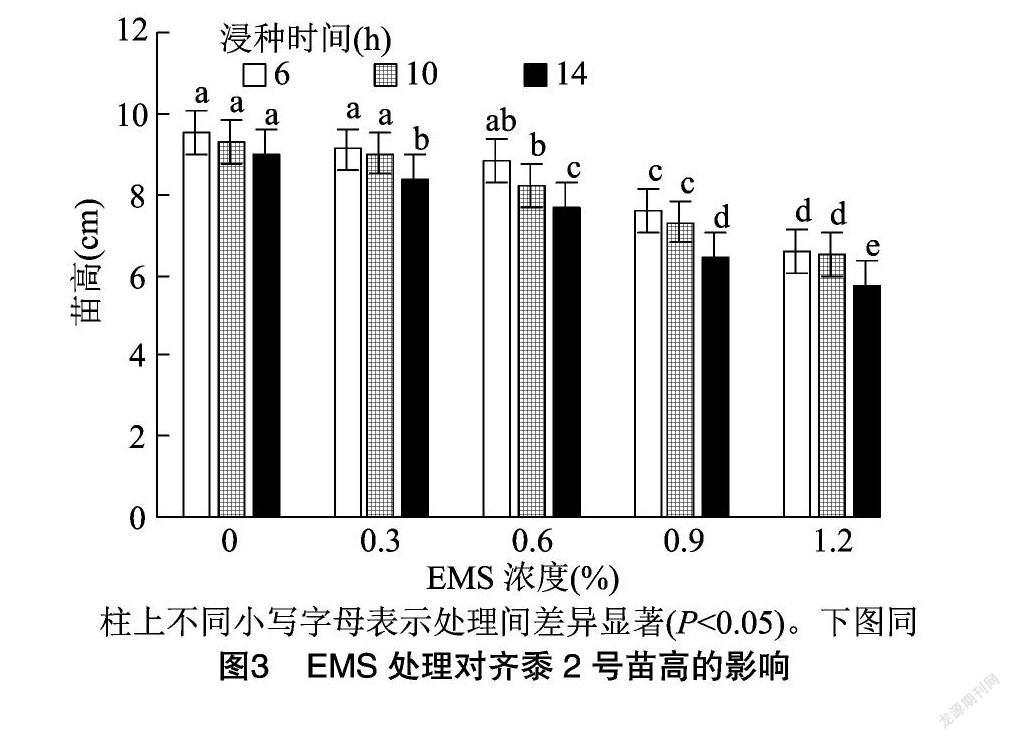
由图3可知,在0.3%、0.6%的EMS浓度下浸种6 h以及0.3%EMS浓度下浸种10 h处理的糜子幼苗高度与对照差异不显著。随着EMS浓度的增加及浸种时间延长,糜子幼苗生长逐渐受到抑制,当EMS浓度>0.6%,浸种时间>10 h时,糜子幼苗高均显著低于对照,1.2%EMS浓度下浸种14 h的苗高最低(5.70 cm),比对照(0,14 h)低36.67%。
2.4.2 EMS处理对糜子根长的影响
由图4可知,糜子幼苗根长的变化规律与苗高大体一致,总体来看糜子根长随着EMS浓度升高及处理时间延长逐渐减小。在0.6%、0.9%EMS浸种6 h处理以及0、0.6%EMS浸种10 h处理条件下,糜子根长与对照差异不显著;当EMS浓度>0.6%,浸种时间>10 h时,糜子根长显著低于对照。1.2%EMS浓度下浸种14 h的根长最低(6.20 cm),比对照(0,14 h)低34.74%。
3 讨论
3.1 EMS处理对糜子种子萌发的影响
张忠武等用EMS处理豇豆种子后,其细胞遭受一定程度损害,导致细胞内物质渗漏,种子浸出液电导率上升[9]。云娜等用EMS处理对蒙农红豆草荚果出苗进程有延迟和抑制作用[10]。本试验结果显示,齐黍2号经过EMS处理后,与对照相比种子浸出液电导率上升,出苗进程延缓,相对出苗率及相对成苗率显著降低,且随着EMS处理浸种时间延长和浓度加大,糜子种子萌发受抑制程度加深,这与上述研究结果一致。
3.2 EMS处理对糜子幼苗生长的影响
郭晓珊等用6种浓度EMS对番茄种子进行处理,结果显示EMS对不同基因型的加工番茄的胚根和胚轴的生长有显著抑制作用[11]。伊风艳等用9种浓度EMS对苜蓿种子进行处理,结果显示低浓度EMS对苜蓿幼苗高无显著影响,随着EMS处理浓度的升高,幼苗生长逐渐被抑制[12]。本试验结果显示,在0.3%、0.6%的EMS浓度下浸种6 h以及0.3%EMS浓度下浸种10 h,糜子幼苗高度与根长与对照差异不显著。随着EMS浓度的增加及浸种时间延长,糜子幼苗生长逐渐受到抑制,1.2%EMS浓度下浸种14 h对齐黍2号生长一致程度最严重,苗高(5.70 cm)和根长(6.20 cm)在所有EMS处理中最低。
3.3 EMS处理糜子种子半致死剂量的选择
适宜的诱变条件是诱变育种的关键,不同物种间或同一物种的不同品种间对诱变剂的敏感性不同,故选择适宜的诱变浓度十分重要。半致死剂量是衡量敏感性的主要指标,也是诱变育种适宜剂量的参考[13]。本试验中,根据相对成苗率试验结果分析,认为EMS对齐黍2号的适宜诱变条件为0.9%EMS溶液处理10h或0.6%EMS溶液处理14 h,不同于烤烟(0.35%~0.52%,16 h)[14]、火龙果(0.5%~0.6%,1~3 d)[15]的适宜诱变条件,进一步印证了不用作物对EMS的敏感程度不同。由于本试验只对齐黍2号这1个糜子品种进行了试验,其分析结果是否具有普遍性、指导性有待进一步研究验证。
4 结论
随着EMS浓度升高及处理时间延长,电导率也随之增加,在EMS浓度为1.2%达到最高;EMS处理可对糜子种子萌发及幼苗生长产生抑制作用,出苗高峰延迟,随着EMS浓度升高及处理时间的延长,苗高、根长、相对出苗率和相对成苗率均呈下降趋势。本试验中,0.9%处理10 h和0.6%处理14 h的相对成苗率分别为50.04%和52.43%,接近半致死剂量,可作为EMS诱变糜子建立突变体库的适宜浓度和时间。
参考文献:
[1]林凡云,胡银岗,宋国琦,等. 糜子抗旱及复水相关基因的cDNA-AFLP差异显示[J]. 干旱地区农业研究,2006,24(3):95-99.
[2]董俊丽,王海岗,陈 凌,等. 96份糜子种质的遗传多样性分析[J]. 河北农业科学,2014,18(4):1-4.
[3]梁任繁,何龙飞. EMS在作物育种应用中的研究进展[J]. 种子,2008,27(2):47-49.
[4]Greene E A,Codomo C A,Taylor N E,et al. Spectrum of chemically induced mutations from a large-scale reverse-genetic screen in Arabidopsis[J]. Genetics,2003,164:731-740.
[5]Kumar G,Rai P K. EMS induced karyomorphological variations in maize (Zea mays L.) inbreds[J]. Turkish Journal of Biology,2007,31:187-195.
[6]葉 俊,吴建国,杜 婧,等. 水稻“9311”突变体筛选和突变体库构建[J]. 作物学报,2006,32(10):1525-1529,1599.
[7]韩锁义,杨玛丽,陈远东,等. 大豆“南农94-16”突变体库的构建及部分性状分析[J]. 核农学报,2008,22(2):131-135.
[8]张 彬,王 喆,陈利青,等. 糜子EMS突变体库构建和突变体筛选[J]. 植物遗传资源学报,2019,20(2):370-376.
[9]张忠武,孙信成,杨友伟,等. EMS处理对豇豆生长发育的影响[J]. 热带作物学报,2017,38(2):218-225.
[10]云 娜,石凤翎,王晓龙,等. EMS诱变对蒙农红豆草出苗和幼苗生长的影响[J]. 中国草地学报,2014,36(3):5-9.
[11]郭晓珊,庞胜群,单淑玲,等. 甲基磺酸乙酯对不同基因型加工番茄诱变效应[J]. 分子植物育种,2019,17(18):5986-5992.
[12]伊风艳,孙海莲,王晓娟,等. EMS诱变对蒙古国黄花苜蓿种子萌发和幼苗生长的影响[J]. 种子,2018,37(10):41-44.
[13]耿兴敏,王良桂,李 娜,等. 60Co-γ辐射对桂花种子萌发及幼苗生长的影响[J]. 核农学报,2016,30(2):216-223.
[14]王军伟,蒋彩虹,宋志美,等. 甲基磺酸乙酯对烤烟种子发芽率的处理效应[J]. 中国烟草科学,2011,32(3):17-20,27.
[15]张冰雪,文晓鹏. EMS对火龙果种子萌发的影响[J]. 山地农业生物学报,2013,32(3):194-197.

