土壤中PAHs预处理方法研究进展
孙美辰 王重阳

摘 要:多环芳烃(Polycyclic Aromatic Hydrocarbons,简称PAHs)是一种常见的持久性有机污染物,广泛存在于各种环境中,因其具有较高的生物毒性,受到研究者的广泛关注。土壤作为地球表层系统的重要组成成分,其中蓄积了大量的多环芳烃。因此,对土壤中多环芳烃含量的准确检测十分关键。本研究对土壤中多环芳烃预处理方式进行调研,着重介绍的提取方法有索氏提取(SOX)、快速溶剂萃取(ASE)、固相萃取(SPE)、QuEChERS法、超声波萃取(USE)等;浓缩方法有氮吹浓缩、旋转蒸发仪浓缩等;净化方法有柱层析法、磁固相萃取净化等。通过对这些方法的原理和优缺点进行分析,为未来多环芳烃检测预处理研究方向提供依据。
关键词:多环芳烃(PAHs);土壤;预处理方法;研究进展
中图分类号:X53 文献标志码:A 文章编号:1003-5168(2022)10-0115-05
DOI:10.19968/j.cnki.hnkj.1003-5168.2022.10.026
Research Progress on Pretreatment Methods of PAHs in Soil
SUN Meichen WANG Chongyang
(Miami College of Henan University, Kaifeng 475004,China)
Abstract: Polycyclic Aromatic Hydrocarbons (PAHs) is a common persistent organic pollutant, which widely exists in various environments. Because of its high biological toxicity, it has attracted extensive attention of researchers. As an important component of the earth's surface system, soil accumulates a large amount of polycyclic aromatic hydrocarbons. It is very important to accurately detect the content of polycyclic aromatic hydrocarbons. This study investigated the pretreatment methods of polycyclic aromatic hydrocarbons in soil, focusing on the extraction methods, including SOX, ASE, SPE, QuEChERS, ultrasonic extraction (use), etc. The concentration methods include nitrogen blowing concentration, rotary evaporator concentration, etc. Purification methods include column chromatography, magnetic solid phase extraction and so on. The principles, advantages and disadvantages of these methods are analyzed to provide a basis for the future research on the detection and pretreatment of polycyclic aromatic hydrocarbons.
Keywords: Polycyclic Aromatic Hydrocarbons (PAHs); soil; pretreatment method pretreatment method; research progress
0 引言
多环芳烃(Polycyclic Aromatic Hydrocarbons,简称PAHs)是含有两个及以上苯环的碳氢化合物的总称,是一种典型的持久性有机污染物(Persistent Organic Pollutants,简称POPs),具有半挥发性、疏水性、亲脂性等特征。PAHs主要来源为生物质、酶和石油类污染,且迁移性较强[1]。
环境中的PAHs可以通过直接或间接的方式进入人体,继而破坏细胞膜,损坏DNA,使细胞遗传物质发生改变,存在致畸、致癌和致突变型的潜在危险[2],损害人体健康。
PAHs在土壤中含量处于痕量级或超痕量级。同时,由于土壤成分复杂,测定过程中存在的干扰物较多,会对测量结果产生一定影响。因此,在PAHs检测过程中,选取合适的预处理方法对PAHs检测具有重要意义。土壤中PAHs的预处理过程主要包括提取、浓缩和净化三个步骤。本研究汇总对比了三个步骤中的不同方法及优缺点,为土壤中PAHs测定过程中预处理方法选择提供依据。
1 提取方法
1.1 索氏提取(Soxhlet Extraction, SOX)
传统的索氏提取法主要是利用虹吸原理使液体不断回流,使土壤样本不断与新鲜溶剂接触。这一过程主要是通过提取液在索氏提取管中不断蒸出,冷凝回流实现[3]。在使用索氏提取法時,利用索氏提取器和加热器即可,装置相对简单,李盛安等[4]开发了采用全自动索氏提取仪对PAHs萃取的方法。将土壤样品放置于干净滤纸桶中,放置棉花于表面并固定于提取杯内,正己烷和乙酸乙酯溶液1∶1混合加入提取杯,高出土壤样品5 cm(约为80 mL),放入全自动索氏提取仪中。测得平均回收率为80.2%~92.4%,对土壤中多环芳烃的回收率较高,检测效果良好。索氏提取法的缺点在于萃取时间长,一般在20 h左右。且消耗大量溶剂,成本较高,不利于大批量的土壤样品检测。
1.2 快速溶剂萃取(Rapid Solvent Extraction, ASE)
快速溶剂萃取是根据不同溶质在溶剂中的溶解度不同,利用快速溶剂萃取仪,实现高效、快速萃取固体中有机物的方法。快速溶剂萃取仪可以在加入不同溶剂后满足不同的萃取温度和压力条件[5]。相比于传统的索氏提取法,ASE优点在于萃取时间相对较短,整个过程在10 min左右,环保且自动化较高,提取效率有很大提高。林晶[6]运用加压流体萃取,称取土壤样品与50 μL替代物稀释液一同放入快速溶剂萃取仪,选择对环境影响相对较小的1∶1二氯甲烷/正己烷作为萃取溶剂,相对标准偏差2.6%~13.3%。该方法的缺点在于准备工序、操作相对复杂,除研磨外还需真空冷冻干燥,萃取液成本也相对较高。
1.3 固相萃取(Solid Phase Extraction, SPE)
固相萃取法操作主要包括吸附和洗脱两部分。吸附指的是利用固体吸附剂使目标化合物与物体基质进行分离,之后利用洗脱剂洗脱,再对目标化合物进行富集[7]。固相萃取不需要有机溶剂,因而操作安全,且洗脱液无须浓缩,可直接进行分析。但价格昂贵、成本高且寿命短。周友亚等[8]将磁子、土样以及微固相萃取料袋一同放入萃取溶剂中。加水封口后加热至70 ℃持续运转20 min,将料袋取出、清洗、烘烤,加入1 mL洗脱剂乙腈进行超声洗脱,洗脱液直接进入气相色谱分析。萃取过程中萃取时间、水温和超声萃取时间均对SPE结果产生影响。
1.4 QuEChERS法应用
QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)是一种分散固相萃取技术。主要是将固相萃取剂分散到样品萃取液中,从而吸附干扰物,保留目标物进行检测分析,具有高效分离、高选择性、高灵敏度和高准确度优势。为使其更符合有机物质检测,提高检测效率,目前QuEChERS在PAHs检测预处理方面有许多适应性改进方法。其中比较有代表性的是微量QuEChERS法(μ-QuEChERS)和QuEChERS-分散液液微萃取法。
根据谭华东等[9]研究过程,微量QuEChERS 法的研究过程如下:准确称取1.0 g(精确至0.001 g)土壤样品,将其置于10 mL塑料离心管内,加入2.0 mL去离子水、2.0 mL V(1%乙酸的乙腈)∶V(二氯甲烷)=2∶1混合溶液。之后辅以超声萃取。PAHs的加标回收率为70.3%~109.1%。在提取过程中,提取溶剂是影响目标物效率及基质效应的重要因素,根据目标提取物不同,可对提取溶剂做出调整。
分散液液微萃取为2006年ASSADI等发明,是通过分散剂作用将样液和萃取剂充分混合,形成均相乳浊液体系,增大接触比表面积,从而达到快速萃取目的。王传咪等[10]运用QuEChERS-分散液液微萃取法对土壤中的PAHs进行萃取和浓缩,在土壤样品中分次加入甲醇、二氯甲烷溶液进行多次离心,将离心液合并后加入4 g无水MgSO4和2 g NaCl涡旋30 s。减压浓缩后加入甲醇超声提取、离心,用正己烷稀释后进行分析。其中,提取剂种类和配比均对提取效率和样品回收率产生影响。且方法操作简单,适合于PAHs的批量检测。
1.5 超声波萃取(Ultrasonic Extraction, USE)
超声波萃取主要是根据超声波的空化效应和机械振动增大分子运动速度,增大溶剂萃取能力,加速目标成分进入溶剂,从而提高萃取效率[11]。车凯等[12]在土壤样品中加入约20 mL体积比为1∶1的正己烷和丙酮混合溶液,以保证提取剂液面高出液体样本,放入到超声波萃取仪中萃取。该试验同时对索氏提取、加压流体萃取和超声萃取三种方法进行比较,发现三者的平均回收率无明显差别,但超声波萃取法耗时更短,溶剂萃取升温小,功耗低。目前超声波萃取技术仍存在自动化程度不高的问题,且在萃取过程中,其余非目标成分也会进入到萃取液中,从而降低了萃取的纯度。萃取时间和萃取次数的选择均对萃取效果产生影响。
1.6 微波萃取法(Microwave Extraction, MAE)
微波萃取法是利用电磁场等致使溶液中分子间摩擦产生热量,从而增加分子本身的活跃性,使溶质加速进入溶液,进而增加萃取效率。由于萃取时温度会升高,温度对溶质品质和萃取效率有限制性影响,因此在选取微波萃取法时,溶液的温度、萃取时间以及微波功率等都有比较严格的要求。侯善华等[13]将固体样本和体积比为1∶1正己烷-丙酮一同置于萃取罐中,置于微波萃取器,升温至100 ℃萃取20 min,选用相同溶液多次洗涤萃取后合并,平均加标回收率为87.1%~113.4%。微波萃取法具有选择性高、节省时间和溶剂等优点。李海燕[14]选用微波萃取法对土壤中的PAHs进行萃取,微波萃取杯中加入有机溶剂量为30 mL,萃取时间同样仅需20 min。但其萃取过程需要极性溶剂,且设备比较昂贵。
1.7 超临界流体萃取法(Supercritical Extraction, SFE)
超临界流体技术是通过改变压力和温度使得流体处于一种超临界状态,在这种状态下流体具有相较于常温、常压下更强的溶解能力,萃取效率会随之提高。如使溶质析出,可通过改变温度与压力,使溶质的溶解度再次发生改变而析出。高连存等[15]取土样与无水硫酸钠进行混合,加入少許酸化的铜屑防止硫化物进入限流器而导致堵塞。在一定条件下,先静态萃取15 min,后动态萃取一定体积的二氧化碳,最后将萃取物收集于丙酮中,回收率均值为78.5%~104.1%。超临界萃取具有萃取速度快、选择性高等特点,且溶剂使用量相对较少,成本相对较低。但超临界萃取法设备昂贵,且操作难度高,土壤中的水分含量对检测结果也有一定影响。
1.8 亚临界水萃取法(Subcritical Water Extraction, SCWE)
亚临界水指的是在一定压力和低于水的临界温度下,仍然保持液态的高温度水。由于水在这种状态下的极性较强,对于土壤中的目标污染物具有一定萃取能力。宓捷波[16]在固相吸附萃取的基础上结合使用亚临界水萃取。将样品与固相萃取填料(海砂)一同放入萃取池中,萃取池于ASE上在90 ℃、10.3 MPa条件下进行亚临界水萃取,静态萃取3 min后置换冲洗体积60%,循环萃取两次后乙腈洗脱,氮吹浓缩。该萃取方法流程中无有害溶剂,绿色环保。且相比于超临界流体技术操作难度较低,具有更强的推广性。但由于极性问题,在萃取过程中仍然存在萃取不充分的问题。
1.9 固相微萃取法(Solid Phase Microextraction ,SPME)
固相微萃取法以传统的固相萃取方式为基础,以纤维剂作为吸附剂中的固定相,运用吸收原理萃取目标物质。由于土壤本身属于固体,可先进行加热,运用固相微萃取法中的顶空萃取法对挥发性有机物进行测定。岳瑞江等[17]将土样进行研磨,风干等预处理后放入顶空瓶中,加入蒸馏水混匀后置顶空进样器中平衡30 min进行分析,相对标准偏差小于5.05%。萃取温度、萃取时间和加水量都对萃取效果产生影响。在对不同目标物质进行萃取时,可选取多组平行试验进行效果比较。固相微萃取法的纤维头极易破坏,所以一般而言不可重复试验。
1.10 协同萃取法
协同萃取法指的是同时使用多种萃取技术对样本进行萃取分析。例如,用超声微波协同萃取法对土壤中持久性有机污染物进行萃取时,相较于传统的索氏提取法,操作更加简单,萃取时间更短。邹世春[18]将土壤样品置于与超声波换能器紧密黏结的250 mL玻璃萃取容器中,以正己烷-二氯甲烷混合溶液作为萃取剂,放入至超声微波萃取仪中,冷却后过滤浓缩,PAHs的平均回收率可达到86.9%,相较于传统超声波萃取方式,具有样品容量大,重现性好等优点。
2 浓缩
浓缩是土壤萃取液处理的重要步骤。萃取液在浓缩过后,溶剂活度降低,浓缩液相较于萃取原液更加稳定,且能显著提高纯化速度和效率。土壤中多环芳烃萃取液浓缩方法主要有氮吹浓缩、旋转蒸发仪浓缩和离心平行蒸发仪浓缩三种。
氮吹浓缩主要是用仪器将氮气加压,使其可控地吹向加热液体样品表面,使得样品中的水分迅速蒸发,进而达到浓缩的目的[19]。氮吹浓缩一般使用氮吹仪进行操作,在浓缩过程中,根据浓缩对象不同,水浴温度和氮气气流压力均对浓缩效果产生影响。该浓缩方法操作相对便捷,但单个样品的压缩时间较长,不适用于需要进行大量蒸发的前处理样品。
旋转蒸发仪主要是在减压的状态下循环蒸发易挥发性的溶剂而达到浓缩目的。水浴温度、旋转速度等都对旋转蒸发仪浓缩有着一定的影响。杨美玉等[20]将二氯甲烷作为提取液萃取后,放入旋转蒸发仪浓缩旋蒸至约1 mL,过程中重复加入1 mL乙腈3次后进行测定。
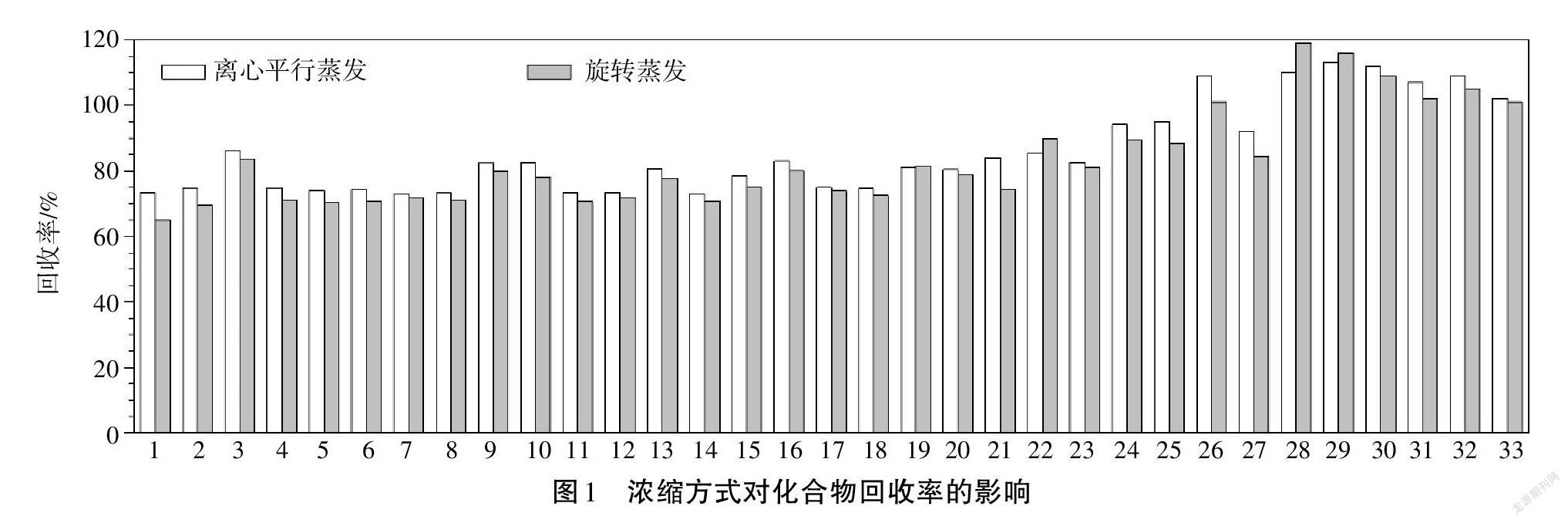
离心平行蒸发仪主要是利用离心力使得液料分离,再通过加热进行蒸发达到浓缩目的。冯丽等[21]运用ROCKET离心平行蒸发仪,选择Low BP & Mix模式,通过ΔT的变化判断剩余溶剂体积。并考察旋转蒸发仪和离心平行蒸发仪对目标物回收率的影响,具体结果如图1所示。结果显示,离心平行蒸发仪回收效果更好。选用离心平行蒸发仪,只需將收集瓶直接放入仪器中,且无须转移,可多个样品同时进行,因而操作相对简单。
3 纯化
在提取土壤中PAHs的过程中所选取的萃取溶剂大多数具有半选择性,由于土壤中成分复杂,提取液中除PAHs外,还有许多干扰性物质,对后续的定量分析产生影响。因此提取液在进行分析之前必须要进行纯化,以避免杂质干扰。纯化方法的选择对纯化效果和定性、定量的准确性产生重要影响。
3.1 柱层析法
柱层析法是PAHs净化过程中的常用方法。由于混合物中各物质的性质不同,导致各组分从材料转移到流动相中的性质不同,提取液在充满材料的柱体中流动,洗脱其所经过的材料颗粒[22]。根据中心填料不同,柱层析法可分为弗罗里硅土柱(F)、硅胶柱(Si)、PAHs专用柱(MIP-PAHs)、硅酸镁净化小柱净化、活性氧化铝柱层析法等,具体不同填料的使用条件和效果见表1。柱层析法操作简单,且推广性好。
3.2 磁固相萃取净化
磁固相萃取法是固相萃取法的一种,中心萃取物质选取磁性物质,除保留固相萃取操作简单的优点之外,萃取效率更高,有机溶剂用量更少。魏丹等[23]取100 mg的ZIF-8/nZVI磁性材料放入烧杯后加入样品溶液,在室温下震荡至完全吸附,利用磁铁将磁性粒子分离后氮吹,装入样品瓶中进行分析测定。该方法操作性强,准确度和精确度好,具有较高的应用性。
3.3 凝胶渗透色谱法
凝胶渗透色谱法主要运用了体积阻滞的分离原理,根据分子性质不同,分子筛分离出与原物质分子不同的物质。张茜等[24]在测定PAHs的过程中先氮吹浓缩,而后将提取液旋转浓缩至近干,再用环己烷∶乙酸乙酯(体积比为50∶50)溶解后使用自动凝胶渗透色谱系统和在线浓缩系统净化,使用弗罗里硅土固相萃取柱净化,二氯甲烷活化后上样,再使用二氯甲烷洗脱,获得了良好的净化效果。
4 结语
本研究对于土壤中PAHs的前处理流程与方法进行描述。土样中的PAHs经萃取后,萃取液经浓缩、纯化等过程可直接进入测定。目前,检测多环芳烃的方法中被广泛应用的有高效液相色谱法(HPLC)、气相色谱-质谱联用法(GC-MS)、恒能量同步荧光法(CESF)等。在选取合适的多环芳烃的预处理方法的基础上,要选择具有选择性好、快速等优点的检测方法。
通过对前期萃取、浓缩和纯化等方法进行汇总对比,以期为多环芳烃前处理方法的选择提供依据,也为未来多环芳烃的检测方法研究提供方向。随着工业生产和研究需求的不断发展,PAHs的提取纯化方法向高效、快速的方向不断进步,检测方法的选择也从单一转向多种方法联用,不断提高检测效率。
参考文献:
[1] 曾超怡,徐辉,许岩,等.长江重点江段水体中多环芳烃及其衍生物的分布及健康风险[J].环境科学学报,2021,41(12):4932-4941.
[2] 叶凯,孙玉川,朱琳跃,等.典型岩溶槽谷区不同地表覆被土壤中多环芳烃的运移特征和来源解析[J].环境科学学报,2021,41(12):5127-5136.
[3] 张静玉.黄连素超声提取与索氏提取工艺的对比研究[J].化工管理,2015(25):206-207.
[4] 李盛安,冯敏铃,张定煌,等.全自动索氏提取-气相色谱三重四极杆串联质谱法测定土壤中18种多环芳烃[J].绿色科技,2018(22):23-26.
[5] 宋雪梅,张力天,章梦圆,等.土壤中多环芳烃不同预处理方法比较[J].低碳世界,2020,10(8):48-49.
[6] 林晶.加压流体萃取-气质联用法测定土壤中15种多环芳烃[J].科技创新与应用,2020(9):121-125.
[7] 孟玲芝,刘坤,刘荣光,等.固相萃取技术在农药残留检测中的应用[J].吉林农业,2018(12):55.
[8] 李可及,周友亚,汪莉,等.异烟酸铜磁力搅拌微固相萃取-气相色谱法测定土壤中多环芳烃[J].环境科学研究,2010,23(2):198-202.
[9] 谭华东,赵淑巧,吴东明,等.微量QuEChERS/气相色谱质谱法快速测定土壤中15种农药残留[J].化学试剂,2020,42(2):147-153.
[10] 王传咪,谭华东,武春媛,等.QuEChERS-分散液液微萃取结合GC-MS测定土壤中的多环芳烃残留[J].化学试剂,2022,44(5):755-761.
[11] 张卫红,吴晓霞,马空军.超声波技术强化提取天然产物的研究进展[J].现代化工,2013,33(7):26-29.
[12] 车凯,郑宇超,范辉,等.超声波萃取-气相色谱-质谱法同时测定土壤中16种多环芳烃和18种多氯联苯[J].中国测试,2021,47(5):68-75.
[13] 侯善华,姜晓辉.微波萃取-气相色谱-质谱法测定文具中16种多环芳烃[J].化学分析计量,2019,28(4):61-64.
[14] 李海燕,李楠,于丹丹.微波萃取-气质联用测定土壤中的16种多环芳烴[J].环境监控与预警,2010,2(1):20-23.
[15] 高连存,张春阳,崔兆杰,等.炼钢厂炼焦车间土壤中PAHs的超临界流体萃取-色质联用分析方法研究[J].环境科学研究,1998(1):38-41.
[16] 宓捷波,林安清,林幸,等.亚临界水萃取法检测粮谷中24种残留农药[J].食品研究与开发,2012,33(3):115-119.
[17] 岳瑞江,邱自兵,王志苗,等.顶空固相微萃取-气相色谱-质谱法分析土壤中多环芳烃含量[J].资源节约与环保,2015(1):55-57.
[18] 刘春娟,邹世春.超声-微波协同萃取分离、气相色谱-质谱联用测定土壤中多环芳烃[J].理化检验(化学分册),2008(5):421-424,426.
[19] 上海新拓分析仪器科技有限公司.氮吹仪的原理及应用[J].食品安全导刊,2010(12):54-55.
[20] 杨美玉,倪进治,杨柳明,等.土壤中多环芳烃定量检测的前处理方法比较研究[J].实验室科学,2020,23(3):34-38.
[21] 冯丽.离心平行蒸发-气相色谱/质谱法同时测定土壤中多环芳烃和硝基苯类化合物[J].色谱,2020,38(5):617-619.
[22] 崔遥,戴鹂莹,钟方丽,等.室温下柱层析法同时提取刺玫果肉中维生素C和花色苷及其体外活性研究[J].化学试剂,2022,44(5):736-743.
[23] 魏丹,国明,吴慧珍,等.加速溶剂萃取-磁固相萃取净化-气相色谱-质谱法测定土壤中16种多环芳烃和23种有机氯残留[J].色谱,2020,38(8):945-952.
[24] 张茜,刘潇威,罗铭,等.快速溶剂(ASE)提取、凝胶渗透色谱(GPC)联合固相萃取(SPE)净化,高效液相色谱法测定土壤中的多环芳烃[J].环境化学,2011,30(4):771-777.

