猕猴桃溃疡病防治策略的研究现状与展望
游雨欣, 戴德江, 罗金燕, 朱洁, 李斌*
(1.浙江大学 生物技术研究所,浙江 杭州 310058; 2.浙江省植保检疫与农药管理总站,浙江 杭州 310020;3.上海市农技推广中心, 上海 201103; 4.温州市植物保护与土壤肥料管理站,浙江 温州 325000)
猕猴桃溃疡病是一种极具毁灭性的细菌性病害,现已被列为中国森林植物检疫性病害[1],对猕猴桃种植产业的发展起到巨大的阻碍作用。该病害的病原菌为丁香假单胞杆菌猕猴桃致病变种(Pseudomonassyringaepv.actinidiae,PSA)[2]。PSA能够侵染猕猴桃属(Actinidia)多种寄主,经人工接种后,还可感染番茄、大豆、蚕豆、马铃薯、桃、杏、李、樱桃、梅等作物,对烟草也具有很强的侵染能力[3];PSA主要危害植株的新梢、枝干及叶片,易使枝梢枯死、叶片萎蔫、树势衰弱甚至使植株死亡[4],同时危害花蕾,导致果皮增厚,果实畸形,果味变酸,使猕猴桃的产量及品质受到严重的影响[5]。
该病害于1984年在日本静冈县首次被发现,目前新西兰、韩国、土耳其和希腊等20多个国家的猕猴桃产区均有报道[6]。我国主要分布在陕西、四川、安徽、贵州、湖南和浙江等地区[7],1985年在湖南东山峰农场暴发[8],由于其传播速度快、致病性强、传播范围广且防治难度较大[9],大面积猕猴桃果园遭到破坏。浙江作为我国南方最大的猕猴桃商品化生产基地及野生种质资源分布中心之一[10],该病害在浙江省内各地区均有分布,以江山、台州、上虞和余姚市为主。猕猴桃溃疡病的暴发与流行短时间就可造成巨大的经济损失[10],目前仍未找到有效的防治药剂。因此,制定安全有效、绿色环保的防治策略进行猕猴桃溃疡病的防治已成为当前研究的热点。
本文基于目前国内外学者在猕猴桃溃疡病防治上的相关研究,分析PSA快速流行的主要原因,比较了各防治措施的优劣,提出了依法检疫、健全监测预报系统预防病原传入,利用高抗品种、增强树势和药剂防治相结合的综合防治策略,并展望了猕猴桃溃疡病的防治方法和技术前景。
1 猕猴桃溃疡病快速流行的主要因素
猕猴桃溃疡病可短时间内大面积暴发流行,难以根治,主要有以下几个原因。
1.1 大规模种植易感品种
不同的猕猴桃品种对溃疡病的抗性存在一定的差异。我国猕猴桃主产区的现有品种较为单一,缺乏综合性状优良的配套品种。秦美、海沃德等猕猴桃品种抗病性强,但因其果实品质不佳、商品性不高等原因而未能广泛种植。红阳等品质极佳、商品性非常好的品种,抗病性很弱,国内常大面积栽培单一品种的红阳猕猴桃,一旦感病便会加快溃疡病的蔓延速度,轻则减产,重则毁园。由于猕猴桃溃疡病极强的致病能力,我国现存的品种中,兼具丰产性、耐贮性、高品质、高抗逆与抗病等综合性状优良的品种极少,尚未发现完全抗病的品种[11]。为研究猕猴桃抗感品种与溃疡病原菌的差异性互作,研究人员已对不同猕猴桃品种在生理和分子水平上进行了分析,结果发现,猕猴桃感病品种感病后其叶片与枝条组织中的可溶性蛋白和酚类物质含量显著低于抗病品种,说明猕猴桃品种抗性与可溶性蛋白、酚类物质具有一定的相关性,可以作为猕猴桃溃疡病的鉴定指标[12]。进一步采用随机扩增多态DNA(Random amplified polymorphic DNA,RAPD)分析发现,抗病品系能够扩增出一条1 458 bp的DNA片段,而感病品系无法扩出此条带[13],由此可推断该片段可能与抗溃疡病基因相关,但仍需进一步验证,现只能用于抗病品种的初步鉴定。
1.2 传播扩散迅速
猕猴桃溃疡病具有极强的传染性,使得其能够在短时间内迅速蔓延至世界各地的猕猴桃产区。近距离传播主要依靠风雨、昆虫活动和人为农事操作中通过树木的皮孔、芽眼和伤口直接入侵[2]。研究[14]表明,蚜虫可作为PSA的载体进行传播,蚜虫取食感病植物组织后被感染,随着虫体内细菌浓度增加,蚜虫将带有病菌的蜜露滴在植株表面,导致猕猴桃溃疡病的迅速传播。除此之外,在出入猕猴桃果园时,农作工具、人员及车辆往往会成为携带溃疡病的主要载体,造成连片的果园大面积感病。溃疡病的远距离传播主要通过未经检测的苗木、接穗及携带病菌的花粉,在嫁接、授粉的过程中,苗木、商业花粉常携带病原菌,成为溃疡病主要的传染源,但具体的侵入方式仍需根据各地情况进一步系统试验观察。
1.3 温湿气象条件
猕猴桃溃疡病的发生及流行与种植区的温度、湿度和持续降雨天数具有密切的关系。研究表明,低温阴雨高湿的气候条件是导致猕猴桃发病的重要因素。早春时节多雨、高湿和低温(12~18 ℃)有利于溃疡病菌的侵入及快速繁殖,当气温升高至25 ℃,溃疡病的存活率降低,病害减弱[15]。在阴冷潮湿地区该病害易暴发,学者发现该病原菌在5 ℃时即开始繁殖,侵染植株7 d后植株开始表现出病症[16]。当气温低至-12 ℃时,由于植株自身抗性下降,树势衰弱,也有利于病害传播,导致病害发生愈加严重[17]。
2 猕猴桃溃疡病综合防治策略比较分析
猕猴桃溃疡病传播扩散快,一旦暴发难以防治,应坚持“预防为主,防治结合”的原则,采取综合防治的策略,降低该病害的危害。
2.1 依法检疫监管,阻止病害传入非疫区
1996年猕猴桃溃疡病被列入国内森林植物检疫对象名单[18],为防止溃疡病迅速扩散,造成大面积毁园,加强检疫工作,强化调运检疫监管显得尤为重要。在苗木、接穗和商业花粉的运输期间,应按照规定严格实施检疫,禁止未检疫的种苗流通,把溃疡病扼杀在萌芽阶段;利用全国植物检疫信息化管理系统,对苗木、接穗和商业花粉调入信息进行实时监管,严格执行持有《农作物种苗生产经营许可证》和《植物检疫证书》两证者才能调运和销售种苗,同时应每年进行严格复查,以确保携带PSA种苗进入非疫区;强化市场检疫监管,严禁销售、购买未取得《植物检疫证书》和手续不全的境内外苗木、接穗和商业花粉等,制定相应的处罚措施并进行销毁处理。
2.2 建立健全监测报告系统,做到疫情“早发现、早拦截”
在全国各地设立多个监测点进行监测预报,定时定点进行专项调查和大面积普查。同时可以参照新西兰的检疫防治体系,建立溃疡病监测及报告系统,根据受PSA威胁的程度划分不同区域,制定《果园进出管理细则》《果园卫生条例》等条例,配置专业人员全面负责防治检疫工作的监督和管理,做好隔离防护和相关疫病知识培训,尽可能减少PSA病原,降低对猕猴桃产业及经济的影响[19]。目前,溃疡病特异、快速的检测技术主要有症状观察、分子生物学和血清学检测等鉴定方法。
2.2.1 症状观察
通过直接观察感病植株症状可进行初步病原鉴定。植株树干和枝条感病部位凸起龟裂,皮层初期有乳白色菌脓溢出,后期随着植株伤流形成黄褐色或锈红色脓液。叶片感病后呈焦黄、枯萎状,伴随有黄色晕圈的红色小点,后期变成褐色不规则斑块[20]。花蕾不能开花,易脱落死亡。感病植株树势衰弱,对果实品质造成严重影响[21]。由于其他猕猴桃病原也可能引起类似症状,该鉴定方法只可作为PSA的辅助鉴定。
2.2.2 分子生物学检测
猕猴桃溃疡病为系统性细菌病害,具有较强的潜伏性和暴发性,利用分子检测技术有助于早期发现PSA,及时采取有效措施防控。较为传统的细菌检测技术是常规PCR,它能够利用体外扩增的方式从微量细菌中获取大量遗传物质,但由于其不能区分死活细菌,具有一定的局限性。RAPD是一种基于PCR的分子标记技术[22],具有信息量丰富、技术难度低、费用低、对DNA质量要求低等特点,已被广泛应用于PSA检测[23-24]。由于一些学者发现RAPD标记的重复性较差,为改善这一缺点,将获得的RAPD标记转化为更稳定可靠的序列特异扩增区域(Sequence characterized amplified region)标记,这项技术也已被广泛用于PSA的检测与鉴定[25]。相比传统方法,该方法能在短时间内完成检测,具有更高的准确度和灵敏度,可在病害潜伏期或发生期的植物组织中检测到PSA,因此,可将其应用于国内疫区与非疫区间调运植株的检验,及时阻断PSA的传播[26]。除此之外,双重PCR技术也能特异检测PSA,且极大地缩短了检测时间[27-28]。但分子生物学检测也存在成本较高、操作较复杂,难以满足田间大规模检测的需求。
2.2.3 血清学检测
近几年来,由于灵敏度高、特异性强和操作方便等特点,血清学检测技术在国内外迅速发展,已被广泛用于植物病原细菌的检测。酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)是得到广泛应用的血清学检测方法之一,其原理是将抗原与抗体的免疫反应与酶的催化反应相结合,从而达到检测的目的。目前主要的血清学方法有直接ELISA法、斑点ELISA法、抗原包被间接ELISA法、双抗体夹心法和三抗体夹心法等,这一系列血清学检测方法也正逐渐被应用到PSA的检测中。2017年,Cimmino等[29]通过制备PSA胞外多糖的多克隆抗体,建立了猕猴桃溃疡病的ELISA检测方法。国内学者利用ELISA的方法,采用PSA3特异效应蛋白Hopz5制备多克隆抗体,灵敏度可达3×105mL-1,可实现室内培养的菌液和田间样品的检测[30]。由于多克隆抗体存在特异性差等问题,而单克隆抗体具有较强的专化性,近年来学者积极制备以单克隆抗体为核心的间接ELISA法、斑点ELISA法,最高灵敏度分别达到9.0×102和 3.60×103mL-1[31],为从源头上预防猕猴桃溃疡病提供了检测技术支撑。
2.3 加强疫区科学防控,落实关键管理措施
2.3.1 选育和利用高抗品种和砧木
利用检疫或检测预报等措施,只能保证所用苗木未携带病菌,但是要使疫区猕猴桃植株高抗溃疡病,仍需从育苗上入手,这也是最为可行有效、经济效益较高的措施。目前已培育的品种主要以中华猕猴桃为主,大部分对猕猴桃溃疡病感病或中抗,其中种植面积最广的红阳最易感病。但大部分品种对溃疡病的抗性鉴定及评价相对模糊,现主要通过大田鉴定[32-33]来确定抗性能力,常存在发病条件局限、观察周期长等缺点。不少学者利用活体或离体人工鉴定技术[34]来评价植株的抗性水平,但由于该抗性鉴定方法存在局限性,得到的数据结果往往不稳定,难以进行推广应用。因此,应加快猕猴桃资源的抗性评价工作,完善和统一猕猴桃溃疡病抗性鉴定评价方法。已有研究表明,合适的砧木的使用能有效提高猕猴桃接穗品种的抗性。Lei等[35]利用分子杂交技术获得优良抗性砧木YZ310,通过离体枝条、叶片接菌等方法进行了验证。新西兰在对猕猴桃溃疡病的研究中筛选出具有强抗性的砧木品种邦蒂,但目前砧木选育主要从现有品种的杂交后代或实木中获取,缺乏针对溃疡病的选育策略。
2.3.2 利用基因工程育种技术,加快高抗育种
猕猴桃转基因或高效基因编辑技术体系的成熟,极大缩短育种年限,有利于加快抗性品种的选育。一方面可以对抗病品种的基因组测序分析,查找与抗病相关的基因,采用图位克隆、mRNA差异显示等技术定位、扩增,开发分子标记定位抗病基因,进行抗病分子辅助育种;另一方面,采用分子手段及诱变技术将拮抗基因、裂殖基因、耐杀菌剂基因等导入生防菌中,改良其遗传结构,形成高抗逆性、广适应性和抗菌谱宽的遗传工程菌,筛选出可促植株生长发育的生防菌。张阿玲[36]从毛花品种的猕猴桃叶片中筛选到PR2蛋白基因,对其进行克隆、亚细胞定位及抗溃疡病功能鉴定,结果表明,该基因具有抗溃疡病的功能,可为猕猴桃转基因抗溃疡病育种提供基因资源和分子依据。周月等[37]以红阳品种作为材料,通过根癌农杆菌介导将CaMV 35S启动子调控下的LJAMP2基因导入该品种中,成功获得了转基因植株。
2.3.3 加强果园管理,培育健壮树势
果园栽培管理措施直接影响猕猴桃溃疡病的发生,比如树龄、负载量、种植密度、施肥种类及数量、修剪时间与程度等措施,都会直接影响植株的生理活动[38]。在栽培过程中,应根据树龄大小和树势强弱,限制植株的负载量,禁止盲目使用膨大剂。根据灌溉情况合理施用有机肥、生物菌肥,适当追施钾、钙、镁、硅等矿物质肥料,以增强树木长势,改善土壤结构,过量的氮肥反而会增加植株的感病概率[39]。夏季修剪过程中,应确保树干有充足的光照,减少挂果量;冬季修剪过程中,应遵循“少留枝多留芽的原则”,适当增加留枝量,降低猕猴桃溃疡病对果实产量的影响[40]。修剪的枝条应及时带离果园进行销毁,对修剪工具也应勤消毒,防止病原多次传染。
2.3.4 化学药剂防控
化学药剂具有高效、速效、操作方便和经济效益高等特点,是传统和常见的猕猴桃溃疡病防治方法,但由于各地区气候环境不一,所采用的药剂及防治效果往往存在差异。国外早期主要利用铜制剂进行预防和控制,而长期施用高铜制剂易使PSA产生新的抗铜因子[41]。国内的室内及田间药剂防治主要使用81%乙蒜氯霉素、72%农用硫酸链霉素、0.15%四霉素、98%盐酸土霉素、80%代森锌、0.2%纳米银等。通过室内毒力测定得出抑制中浓度(EC50),其值越小说明该药剂抑制能力越强(表1)。在此基础上选取药剂进行田间药效试验,防治效果越高则该药剂防治能力越佳(表2)。也有研究表明,药剂的合理复配也能够起到增效作用,如2%春雷霉素300倍+43%戊唑醇1 000倍+56%丙森醚菌酯600倍+45%咪酰胺1 500倍和80%全螯合态代森锰锌800倍+0.15%四霉素600倍+50%嘧菌环胺800倍[42]等。
除此之外,不同施药方式也会影响防治效果,单一施药以刮除病斑涂药的效果较佳,其次为注干,而喷雾效果最差[43];研究发现,采用灌根+注干组合施药的防效最好,这种施药方式能够使药物充分与植株内部病菌接触,进而增加接触面与接触时间,明显优于喷雾、单独灌根和注干的施药方式[44]。虽然化学药剂能够快速防控溃疡病,但目前仍未研究出能够百分之百有效防治的化学药剂。国外研究[45]发现,一般的化学药剂能够抑制表面的病原菌,残余在植株内部的病原菌往往通过侵染寄主快速繁殖而又产生大量新的病原菌;另一方面,化学农药的持续大面积频繁滥用,易使PSA产生耐药性,污染环境、杀伤天敌,造成防治成本增加,甚至危害人体健康。
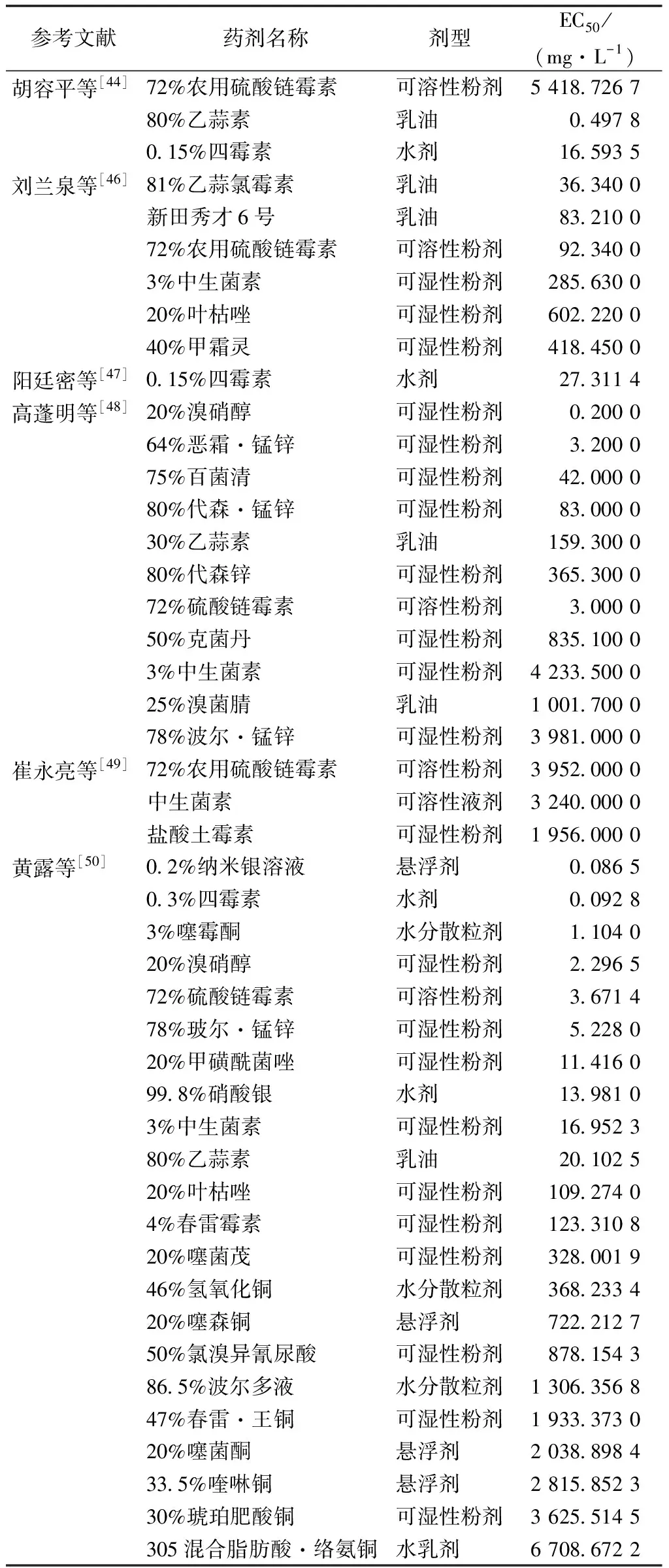
表1 化学杀菌剂对猕猴桃溃疡病的室内毒力测定
2.3.5 生物药剂防控
生物防治相比化学防治,有效避免了农药残留和病菌产生的抗药性,保护了生态环境,有利于产出绿色安全食品(表3)。目前,生物防治是防治猕猴桃细菌性溃疡病的有效途径之一。国内外学者经多年研究筛选出一批对猕猴桃溃疡病有良好防效的微生物菌株及其代谢物,如放线菌TGNBSA5[52]、噬菌体PPPL-1[53]、多羟基二萘醛提取物(WCT)[54]和生防菌株B56-3发酵原液[55]。利用外生菌根真菌菌剂涂干及灌根对猕猴桃溃疡病也具有良好的防治效果[56]。除此之外,农用链霉素、土霉素、四霉素等抗生素均能够有效抑制溃疡病的发生[57]。但这些有益微生物及其代谢物还仅局限在田间试验,尚没有商品化。此外,生物防治通常见效慢、费工费时、效果易受环境影响,关于猕猴桃溃疡病的生物防治研究还有待于进一步深入开展[58-59]。
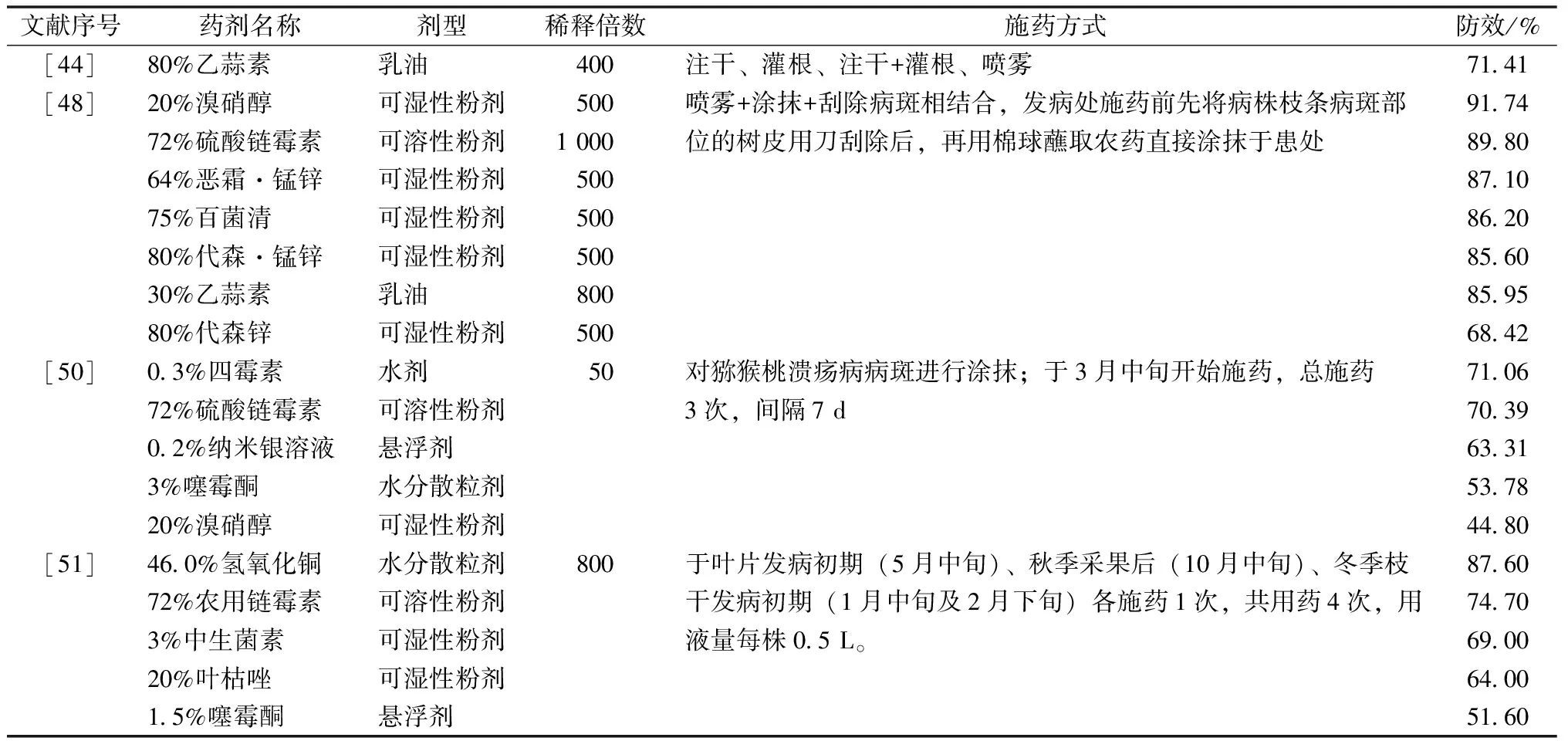
表2 化学杀菌剂对猕猴桃溃疡病的田间防治效果

表3 猕猴桃溃疡病防治策略的优劣分析
3 小结与展望
猕猴桃已经成为我国最重要的栽培水果之一,是农业增效、农民增收的富民产业,据联合国粮农组织最新数据显示,中国猕猴桃总收获面积大约为18.26万 hm2,总产量约为219.67万 t。然而,溃疡病极大地制约了我国猕猴桃产业的发展,各地应积极采取相关措施进行病害防治,但目前采取的主要防治手段效果不一,各有优缺点。各检疫部门在苗木、接穗和商业花粉运输期间严格检疫,可及时消灭传染源,但许多地区仍有来源和受检情况不明的苗木等,且不主动上报至检疫部门,很可能成为新的传染源;设立监测预报系统,一旦发现疫情,便能迅速销毁,切断PSA的传染源,由于猕猴桃极高的经济价值,在销毁过程中很可能给种植户造成巨大的经济损失,进一步加大了检疫监测的难度;在疫区内,通过选育和利用抗病品种,以增强植株抗病性,或利用基因工程技术,加快高抗品种的选育,但这种技术仍不够成熟;利用化学或生物防治手段对感病植株进行防治,化学防治易使PSA产生耐药性甚至污染环境,而生物防治虽对环境友好,但其效果易受到环境条件的制约。建议采取综合性的防控措施,以最大程度降低猕猴桃溃疡病菌入侵的风险,避免或减轻该病害的危害。
目前,包括浙江在内的国内外研究学者已对PSA的种属分类、发病规律和快速鉴定方法进行了多年的研究,并取得一定的成果。但从整体上看,猕猴桃溃疡病大面积暴发蔓延的态势并未得到根本的遏制,甚至还在逐年加重。由于PSA具有较强的潜伏传染性,急需加强PSA的致病机理、药剂防治措施及品种抗病性等相关研究。在猕猴桃溃疡病的未来研究方向上,首先可充分利用我国丰富的猕猴桃种质资源进行抗溃疡病新品种的选育及抗病基因的筛选;接着探索将猕猴桃与PSA构成的互作系统作为研究微生物与植物互作的模式系统;然后利用该互作系统研究抗病品种资源高效利用、绿色环保药剂筛选等;最后建立一套适合我国国情的包括严格依法植物检疫、培育抗病品种、利用农业措施增强树势以及结合化学和生物药剂防治的猕猴桃溃疡病绿色综合防控措施,从而保障猕猴桃产业的健康发展。

