T-G-C纳米材料联合声动力学治疗喉癌的研究
郑丹苹,钱 炜,郑楚杰
1.江苏大学附属人民医院耳鼻咽喉科,江苏 镇江 212000;2.南京中医药大学附属常州市中医院耳鼻咽喉科,江苏 常州 21300
喉癌是发生于喉黏膜上皮组织的一种常见恶性头颈部鳞状细胞癌,发病率约占耳鼻咽喉科恶性肿瘤的13.9%,男性高于女性。大多数患者一般表现为音质、音色的改变,呼吸和吞咽功能出现异常,但由于早期没有明显临床症状和恶性肿瘤的病史,临床上60%的患者初诊时即为晚期[1-3]。基于本课题组之前对纳米材料的研究[4-13],联合压电纳米材料T-BTO和声敏剂二氢卟吩e6(chlorin e6,Ce6)构建了新型的纳米体系T-BTO@PEG@Ce6,简称T-G-C纳米颗粒,不仅具有低毒性,而且对肿瘤具有较高的抑制率,可能为未来喉癌的多学科综合治疗提供一种新思 路。
声动力学治疗(sonodynamic therapy,SDT)是利用超声刺激声敏剂产生活性物质对细胞造成损伤[14]。其机制主要是由于声敏剂在低强度周期性机械振动下产生活性氧(reactive oxygen species,ROS)或活性氮(reactive nitrogen species,RNS),另外超声波的能量引起温度升高和其他非热效应,共同导致细胞的不可逆性损伤和凋亡[15]。SDT不仅有更深的组织穿透性(>10 cm),而且减少了非治疗区域的不良反应,如区域性皮炎或全身毒性,使其与传统光动力学治疗相比显示出巨大优势[16-17]。SDT是由声敏剂和超声两大部分组成的,声敏剂可以是有机或无机声敏剂,但是传统声敏剂存在光毒性和皮肤敏感性的限制。基于近年来纳米医学和材料化学的进展,人们致力于优化和开发用于肿瘤和炎症消除的新型声敏剂,以提高SDT的效率。从原卟啉Ⅸ被发现后,我们将研究重点转移到一些颗粒小、生物安全性好、亲和度高、代谢产物低毒的新型纳米声敏剂上,超声刺激后不仅能产生较强的细胞毒性,而且能通过接合化疗药物、靶向标志物等,对肿瘤细胞更好地定位,从而可能产生较好的疗效[17-19]。
1 资料和方法
1.1 实验动物、细胞株及试剂
30只雌性BALB/c裸小鼠(3~5周龄)购自上海斐林生物科技有限公司,体重为12~15 g,并由上海睿太莫斯生物科技有限公司在检疫室监测动物健康指标3 d,检疫合格后在无特定病原体(specific pathogen free,SPF)环境中适应3 d,自由摄取水和食物。本实验方案经江苏大学附属人民医院伦理委员会审批通过。
人喉癌Tu686细胞系购自湖南丰晖生物科技有限公司。
10%胎牛血清、青霉素-链霉素双抗、RPMI-1640培养基及含酚红的胰蛋白酶(0.25%)均购自美国Gibco公司,4%多聚甲醛溶液、DAPI染色剂购自上海碧云天生物技术有限公司。细胞计数试剂盒-8(cell counting kit-8,CCK-8)和Annexin Ⅴ-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)细胞凋亡检测试剂盒购自东仁化学科技(上海)有限公司。本实验超声强度均采用1.0 MHz,1 W/cm2,50%占空比。
1.2 Tu686人喉癌细胞培养
从-80 ℃冰箱中取出解冻Tu686细胞,在湿化的空气(37 ℃、CO2体积分数为5%)及含有10%胎牛血清和1%青霉素-链霉素双抗的RPMI-1640培养基中恒温培养,待细胞密度达到80%且状态良好时,及时传代。
1.3 细胞摄取材料评估
将对数生长期的Tu686细胞以2×105个细胞/孔的浓度接种于1 mL的共聚焦培养皿中培养24 h后,培养至80%密度。分别与T-G-C温育2、4、6、8 h,用磷酸缓冲盐溶液(phosphatebuffered saline,PBS)洗涤3次,去除多余材料。将500 μL 4%多聚甲醛溶液加入培养皿中,固定15 min后用100 μL 4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染色,温育20 min后在激光扫描共聚焦显微镜下观察细胞内的摄取情况。
1.4 细胞治疗效果评估
为确定纳米材料的安全性,首先进行T-G-C纳米材料安全性的预实验检测。将对数生长期的Tu686细胞以104个细胞/孔的密度接种于96孔板中,培养24 h。然后,以4孔为1组,将细胞与不同浓度的T-G-C纳米颗粒溶液温育24 h,接着用PBS洗涤3次。接着每孔加入100 μL CCK-8溶液与细胞恒温温育30 min,接着用全自动检测酶标仪在450 nm处评估不同药物浓度下细胞的存活情况。将Tu686细胞接种于6孔板中,培养2 d。细胞分6组,1~2组、3~4组、5~6组分别用PBS、80 μg/mL T-BTO、80 μg/mL T-G-C溶液温育24 h,其中第2、4、6组细胞用超声处理3 min。超声处理结束后所有细胞再温育6 h,PBS洗涤3次。胰蛋白酶处理后收集细胞,1 000 r/min离心5 min,PBS分散。每组取100 μL细胞悬液,加入5 μL Annexin Ⅴ-FITC和10 μL碘化丙啶(propidium iodide,PI)在室温下避光培养20 min。反应结束后1 h内上样检测。
1.5 构建BALB/c裸小鼠Tu686皮下移植瘤模型
Tu686细胞经传代4次后,取生长状况良好的对数生长期细胞,消化分离细胞后采集细胞并用0.9%的NaCl溶液制成细胞悬液,调整其密度至2×106个细胞/0.2 mL,取细胞悬液约0.2 mL皮下注射到BALB/c裸小鼠后腿部,约21 d后进行后续治疗。在治疗期间每隔1 d记录动物的体重及动物瘤体变化,测定动物瘤体的长(a)、宽(b),对喉癌移植瘤体积测量采用自动读数的电子游标卡尺,隔天记录拍照并分别测量瘤体的长、宽,肿瘤体积计算公式为V=(a×b2)/2。小鼠体重、肿瘤重量采用精密天平称重。待治疗过程结束采用颈椎脱臼法处死动物,取瘤,冷冻包埋肿瘤切片。
1.6 小鼠的分组
将荷瘤小鼠按照每组5只,随机分为6组,所有小鼠均在SPF环境中饲养。待每组小鼠成瘤后向瘤内注射100 μL药物,第1组(G1)小鼠注射0.9%的NaCl溶液作为对照;第2组(G2)小鼠瘤内不注射药物,仅超声处理;第3组(G3)小鼠按体重瘤内注射100 μL 2.5 mg/kg T-BTO溶液,在注射前接合PEG并且充分混匀增加纳米颗粒水溶性;第4组(G4)按体重瘤内注射100 μL 2.5 mg/kg T-BTOPEG溶液并进行超声处理;第5组(G5)按体重瘤内注射100 μL 2.5 mg/ kg T-G-C溶液;第6组(G6)按体重瘤内注射100 μL 2.5 mg/kg T-G-C溶液并进行超声处 理。
1.7 对实验小鼠的处理
上述需要超声组的小鼠在第1、3、5和7天经过瘤内注射药物和超声辐照。在为期16 d的治疗期内,记录小鼠的体重和相对肿瘤大小的变化。超声组小鼠在给药6 h后,将2、4、6组小鼠的肿瘤用超声照射5 min,并在每次超声后观察小鼠状态。治疗结束时,处死各治疗组小鼠,离体肿瘤组织进行称重记录,取肿瘤组织和主要器官(心、肝、脾、肺、肾)进行H-E、TUNEL、Ki-67及DHE染色。
1.8 统计学处理
采用SPSS 25.0软件进行数据分析,计数资料的表达采用,不同浓度T-G-C纳米材料对细胞存活率的影响采用χ2检验,不同浓度下T-G-C材料的细胞存活率采用Fisher精准概率法测定,治疗期间多组间的小鼠体重比较采取单因素方差分析,小鼠肿瘤体积采用Kruskal Willis检验分析,所得数据分析结果采用Adobe Illustrator 2021软件进行图像处理。
2 结果
2.1 细胞摄取材料评估
红色荧光代表纳米材料,蓝色荧光代表细胞核。细胞内的红色荧光强度随着纳米材料孵化时间的延长而增强,2 h后细胞内就出现红色荧光,4 h后红色荧光明显增强(图1)。

图1 细胞摄取T-G-C纳米颗粒分析Fig.1 Cellular uptake assessment of T-G-C nanoparticle
2.2 细胞凋亡评估
即使在200 μg/mL的高浓度下,与T-G-C温育24 h后,细胞活性也未受到明显影响(图2A)。当超声处理后,细胞存活率随药物浓度增加而急剧下降,在200 μg/mL浓度时,细胞活力不足10%(图2B)。25 μg/mL与200 μg/mL的细胞存活率相差不大,即使用200 μg/mL的高浓度药物与喉癌细胞共温育24 h后,细胞活性仍未受到明显影响(表1)。而经超声处理后,在T-G-C纳米药物浓度为25 μg/mL时,细胞存活率为90.63%,在T-G-C浓度为200 μg/mL时,细胞存活率为9.90%,在超声刺激时细胞存活率与未经过超声刺激时的细胞存活率有显著差异,且随着T-G-C纳米材料浓度增加,细胞存活率明显降低(表2)。

表1 不同浓度T-G-C下细胞的存活率Tab.1 Cell survival rates at different concentrations of T-G-C

表2 超声处理不同浓度T-G-C下细胞的存活率Tab.2 Cell survival rates at different concentrations of T-G-C after irritation of ultrasound
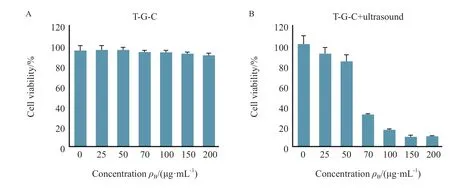
图2 细胞对T-G-C纳米颗粒安全性和毒性分析Fig.2 Cytotoxicity and biosafety evaluation of T-G-C nanoparticle
基于Annexin Ⅴ-FITC/PI染色法的流式细胞术分析显示,T-G-C+超声组的细胞凋亡率为33.66%,T-BTO+超声组的细胞凋亡率为21.37%,而未经过超声处理的T-G-C组的细胞凋亡率仅为11.60%(图 3)。
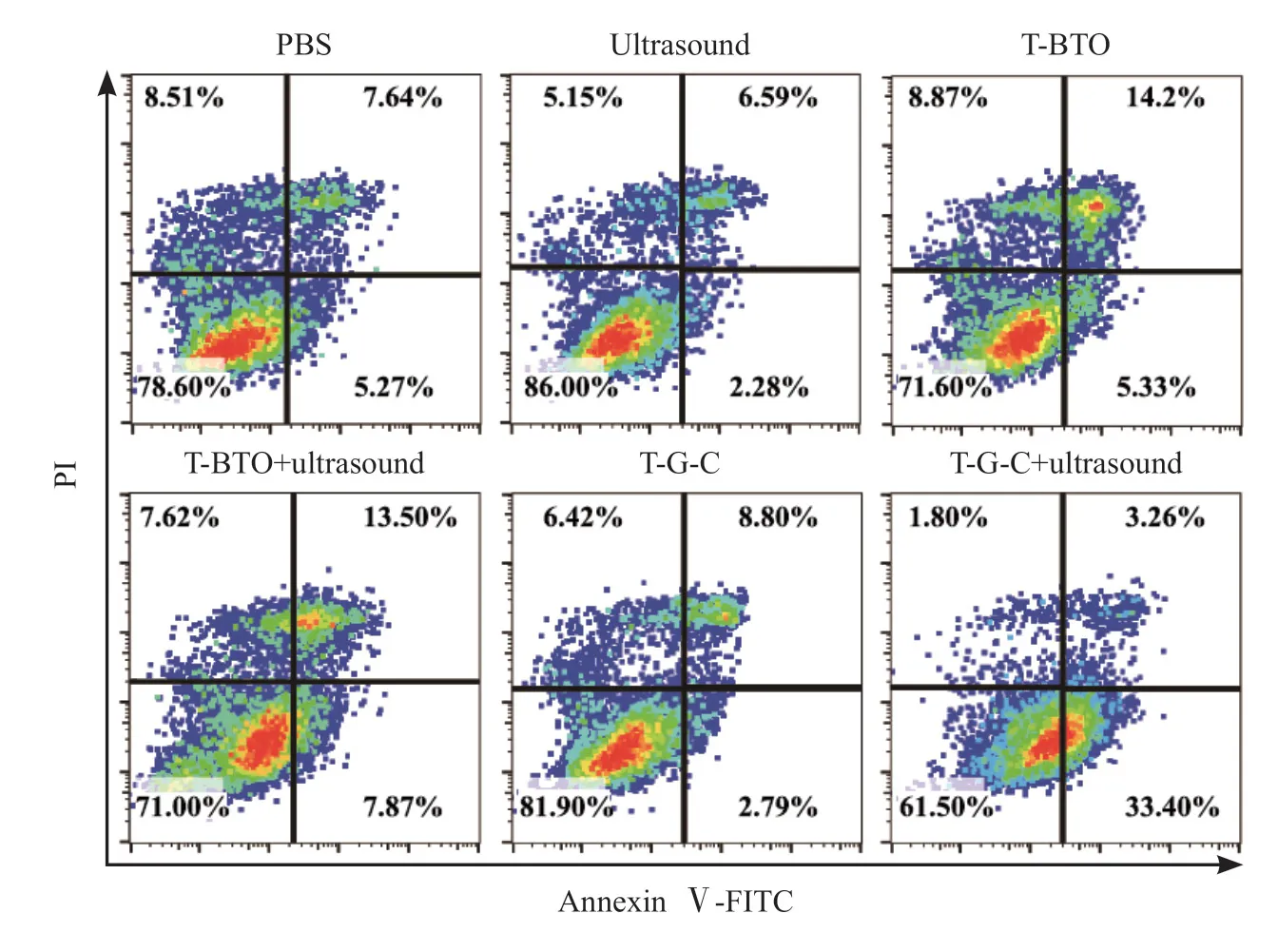
图3 流式细胞术Annexin Ⅴ-FITC/PI染色分析Fig.3 Analysis of cellular apoptosis through Annexin Ⅴ-FITC/PI staining
2.3 动物移植瘤的基本情况
30只裸小鼠造模成功,因此本实验全部纳入。在体移植瘤有包膜包裹,呈椭球型,离体后瘤体表面凹凸不平。
2.4 疗效评价
在治疗过程中,各组小鼠接受不同的处理,治疗期间各组小鼠的体重变化差异不大。通过测量治疗期间的小鼠肿瘤大小,发现第1、2和3组的小鼠肿瘤生长速度较快,第4组小鼠肿瘤生长受到部分抑制,而第6组小鼠肿瘤增长显著被抑制,抑瘤率为100%(图4,表3、4)。在处死小鼠剥离肿瘤组织后发现,第4组的小鼠肿瘤体积小于其他组,而第6组小鼠肿瘤几乎消除。

表3 不同治疗方案对小鼠体重的影响Tab.3 The effect of different treatment on body weight of tumor-bearing mouse

图4 SDT抑瘤效果评价Fig.4 The evaluation of anti-cancer therapeutic effect of SDT
2.5 肿瘤组织切片分析
与其他处理组相比,第6组小鼠肿瘤切片中凋亡、坏死细胞最多,与其他组有显著差异(图5)。Ki-67抗体染色试验结果表明,与其他治疗组的图像显示肿瘤细胞增殖明显不同,SOT联合纳米声敏剂治疗对肿瘤增殖有明显的抑制作用。同时采用DHE染色评价超声治疗后Tu686肿瘤细胞的ROS水平。在T-BTO+超声处理组中,有ROS生成,而在T-G-C+超声处理后,可见大量明显的红色荧光,产生的ROS量明显比单纯压电材料多。
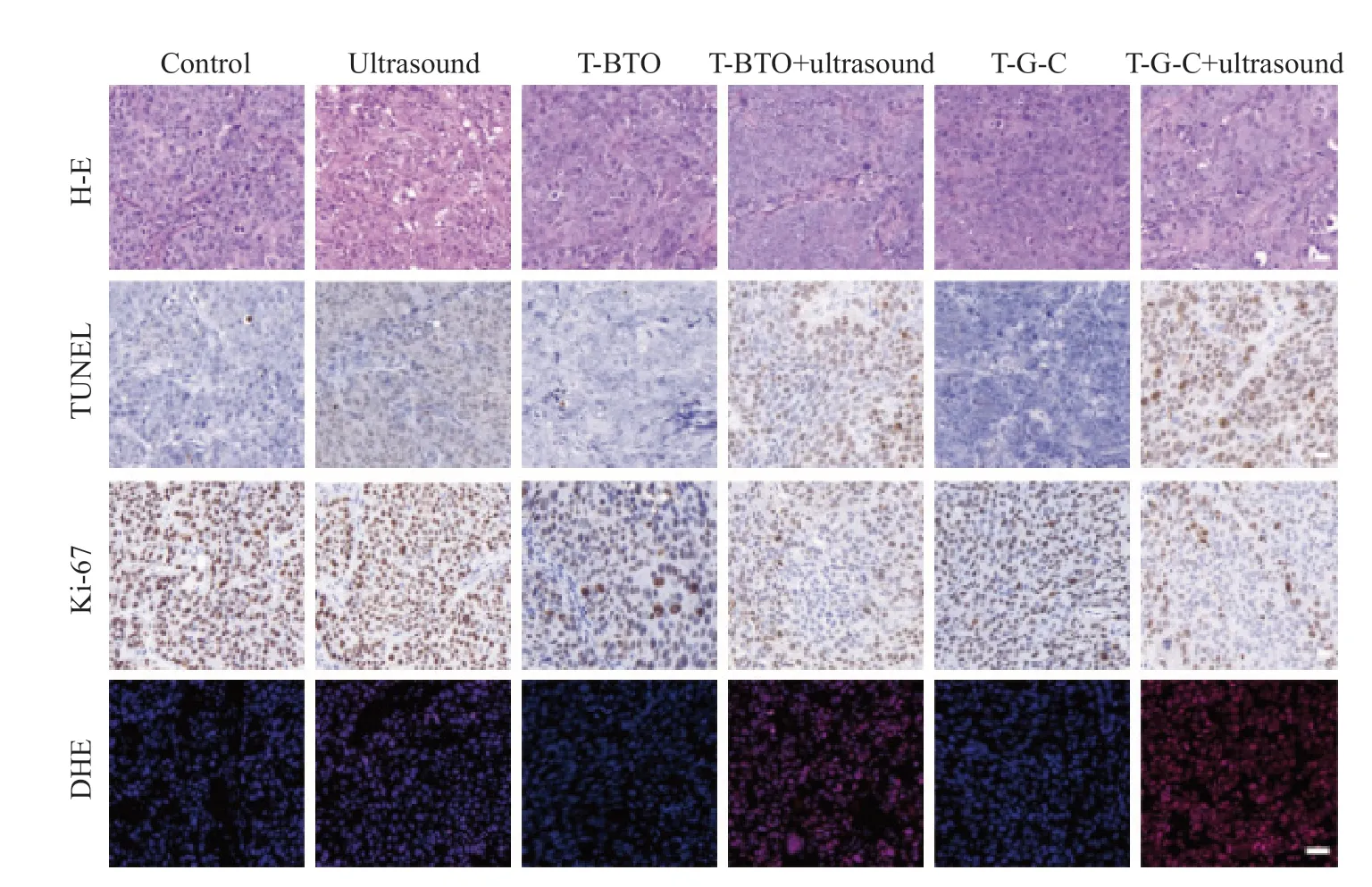
图5 肿瘤组织切片H-E、TUNEL、Ki-67和DHE染色结果Fig.5 H-E,TUNEL,Ki-67 and DHE staining of tumor sections in all treatment groups

表4 不同治疗方案对各组小鼠肿瘤大小的影响Tab.4 The effect of different treatment on tumor volume in each group
3 讨论
喉癌是临床上常见的头颈部恶性肿瘤之一,发病率逐年升高,喉癌患者的预后与肿瘤分期密切相关,T1和T2期肿瘤的治愈率高达80%~90%。然而Ⅳ期患者在经过各种综合治疗后生存率仍低至40%[9,20]。目前,手术联合放化疗仍然是喉癌的主要治疗方式,在临床常采用的治疗方法中,无论是经口激光显微手术、部分或全喉切除术,还是外科放疗,在维持喉部功能或总生存率方面作用不大。传统治疗方法可能导致患者喉功能丧失,如发声、呼吸、吞咽困难等[21],并且放化疗增加了患其他疾病的风险。所幸随着纳米材料和生物医学的发展,光动力学治疗、SDT等新的无创治疗方式不断涌现,尤为引人注目。为此本研究采用纳米声敏剂T-G-C作为压电治疗和SDT的敏化剂,利用纳米材料经超声激发后产生的ROS,来对喉癌进行治疗。这种非侵入性无创的SDT联合纳米材料不仅能减少患者痛苦,提高患者依从性,而且在偏酸、缺氧、高糖的肿瘤环境中,可降低肿瘤细胞的放化疗抵抗,提高疗效。
压电作用是通过压电材料接收外界震动,吸收外界能量并将其转化为电子空穴对的分离,形成内部电场的过程[22]。作为一种新型材料,BTO最初是被应用在接收器、传感器、有机染料的分解、外科植入材料、肿瘤治疗等领域中,在纳米科学和生物医学的发展中引起了医学界的关注[23-24]。相较于块状材料,尺寸在1~1 000 nm的纳米材料颗粒更小,比表面积更大,生物亲和性更高,通过结合化疗性药物、靶向荧光标记等,拓展了纳米材料在肿瘤的定位和诊断治疗中的新功能[25]。通过使用新型的纳米材料,联合压电材料和声敏剂构成了T-G-C,在细胞内随时间的延长而集聚,4 h就可以在肿瘤细胞中达到高效积累,说明T-G-C纳米颗粒与细胞亲和力高,在肿瘤细胞中以时间依赖的方式高效积累。当细胞与T-G-C纳米颗粒温育24 h后,经过CCK-8检测,不同浓度的T-G-C纳米材料下细胞的存活率组间差异无统计学意义(P=0.416),即使在高浓度下对细胞也是安全的。不同浓度下,采用超声处理细胞后的细胞存活情况有所不同。T-G-C纳米材料温育后超声处理能降低细胞存活率(P<0.01),且不同浓度的纳米材料对细胞存活率有影响,如200 μg/mL比70 μg/mL的细胞存活率低(P<0.05),说明存在超声时细胞存活率与材料浓度在一定范围内呈负相关。
为研究细胞凋亡情况,采用AnnexinⅤ-FITC/PI染色法的流式细胞术分析后发现,超声会引起实验组细胞的早期和晚期凋亡,而在仅超声辐照组未见明显的细胞损伤,T-G-C+超声组的细胞凋亡率为33.66%,T-BTO+超声组的细胞凋亡率为21.37%,而未经过超声处理的T-G-C组的细胞凋亡率仅为11.60%,验证了T-G-C+超声联合治疗的有效性。
在体内实验中发现,当T-G-C纳米颗粒注射到小鼠体内时,对小鼠的体重增长和主要器官并没有明显损伤,说明材料对小鼠来说较为安全(P>0.05)。且在联合声敏剂和压电材料的实验组中,肿瘤的增长得到完全抑制,说明T-G-C+超声组小鼠的肿瘤生长受到抑制,疗效优于其他治疗组(P<0.05)。在动物治疗DHE切片中发现,T-BTO联合超声产生的ROS量远小于T-G-C联合SDT,同时也证实了T-G-C在超声处理后产生抑瘤作用的核心是大量ROS的产生。ROS不仅参与许多生理过程,而且低水平的自由基还参与调节细胞自噬及自噬与凋亡之间的蛋白激酶[26],当ROS平衡被打破时对细胞产生氧化损伤引起细胞凋亡。ROS包括单线态氧、脂质过氧化氢等,这些都可以损伤细胞膜、线粒体、内质网及细胞核,参与核苷酸代谢、柠檬酸循环及AMPK通路等,诱导肿瘤细胞表现出凋亡特征[27]。AMPK通路作为维持线粒体稳态的关键通路,在能量稳态、细胞生长和凋亡过程中有重要意义。AMPK通路可以监测腺苷一磷酸/腺苷二磷酸的量,维持腺苷三磷酸稳态;在线粒体损伤时,参与线粒体生物发生,调节线粒体动力学;还可以调节线粒体网格形态,调节氧化磷酸化和线粒体自噬过程,而ROS过量产生不仅会打破氧化平衡状态,而且与主要的抗凋亡因子AKT2和AKT3相关的相邻蛋白被激活,与AMPK有拮抗作用,增加癌细胞对治疗的敏感性[28]。
基于声动力学和纳米材料,本研究研制出了新型纳米声敏剂T-G-C作为压电治疗和SDT的敏化剂,经超声辐照刺激后在体外有较高的压电催化活性。纳米材料仅经4 h即可在细胞内高度聚集,生物安全性高,经超声后在肿瘤细胞内激发了SDT和压电治疗的协同作用,且生物相容性高,经过实验验证了材料的安全性和抑瘤的有效性,是一种非常有潜力的治疗方法。此外,基于对纳米医学在肿瘤治疗中的研究,头颈部肿瘤的治疗在联合纳米医学的基础上,如何联合免疫治疗、如何进一步构建具有靶向性和定位诊断意义的新型纳米材料也是下一步的研究方向。总之,本研究结果有助于拓宽纳米生物医学在耳鼻咽喉科中的应用,促进多学科联合治疗在耳鼻咽喉科疾病无创治疗中的发展,为喉癌等头颈部恶性肿瘤患者的治疗提供新的思路。
利益冲突声明:所有作者均声明不存在利益冲突。

