早期左侧乳腺癌保乳术后大分割放疗同期瘤床加量的安全性及心脏亚结构剂量评估的重要性研究
章 倩,方晓燕,刘 娟,刘 进,程蕾蕾,孙 菁
1.复旦大学附属中山医院放疗科,上海 200032;2.复旦大学附属中山医院心超科,上海 200032
早期乳腺癌患者保乳术后辅助大分割放疗已成为指南推荐的标准治疗模式[1],大分割全乳放疗可以缩短治疗时间,降低正常组织的受照剂量[2],减少治疗费用[3],提高患者的依从性[4],但目前全乳大分割放疗后期瘤床加量和同期瘤床加量计划哪种更优目前尚无定论。对于左侧乳腺癌患者,辅助大分割放疗是否会增加其心脏损伤目前仍有争议。早期研究[5]发现,大分割放疗可能增加乳腺癌患者的放射性心脏损伤,但近年的研究[6]显示,大分割放疗与常规分割放疗相比,缺血性心脏病的发生率无显著差异。心脏损伤的早期发现和早期干预对患者至关重要,心脏亚结构剂量学的早期评估和心超技术能为放射相关心脏损伤的早期诊断提供可靠指标。本研究通过比较左侧乳腺癌保乳术后患者采用大分割放疗同期瘤床加量计划或常规分割放疗同期瘤床加量计划的剂量学及早期心超指标的差异,评估大分割放疗同期瘤床加量计划的心脏安全性,为临床治疗提供参考。
1 资料和方法
1.1 病例选取
选取复旦大学附属中山医院放疗科符合入组标准的左侧乳腺癌保乳术后患者,随机分为术后辅助大分割和常规分割放疗两组。入组标准:患者年龄≤70岁,术后病理学检查证实为乳腺癌,分期为pTis-2N0M0期,患者接受乳腺癌保乳术+腋窝淋巴结清扫/前哨淋巴结活检/腋窝淋巴结取样,切缘阴性,无远处转移证据。
1.2 计算机体层成像(computed tomography,CT)模拟定位
所有患者采用真空垫固定体位,双上肢上举,采用85 cm大孔径定位CT采集图像,上界包括环甲膜,下界包括全肺,层厚3 mm。CT扫描前无伪影定位标记在体中线、腋中线、锁骨头下缘、乳腺皱褶下1 cm及瘢痕两端。CT定位完成后,在ADAC Pinnacle计划系统上设计放疗计 划。
1.3 靶区和正常器官勾画
全乳临床靶区(clinical target volume,CTⅤ)按照美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)乳腺癌放疗靶区勾画图谱进行勾画。瘤床CTⅤ按照术中留置的钛夹范围外扩1~2 cm进行勾画,前后界不超过全乳CTⅤ。由摆位误差和生理运动增加的外放边界确定计划靶区(planning target volume,PTⅤ)。由放疗科医师和心超医师共同勾画心脏结构。全心脏包括纵隔窗CT扫描像中的肺动脉根部、升主动脉、右心房、左心房及结构以外的纵隔脂肪,后续层面依次勾画包括右心房、左心房、左心室、右心室及心包组织,下腔静脉不包括在此结构。冠状动脉左前降支(left anterior descending,LAD)勾画参照可见前室间沟位置,考虑心脏搏动及呼吸运动的影响并结合既往文献报道,LAD轮廓外扩1 cm得到LAD用于评估[7]。此外分别命名及勾画左心室、右心室,右室游离壁勾画参考影像学右室前壁,室间隔为左右心室之间区域。同侧肺利用治疗计划软件中的自动勾画功能自肺尖至肺底自动勾画。对侧乳腺勾画同乳腺CTⅤ。
1.4 放疗计划及心脏剂量学参数评估
大分割放疗组:全乳放疗剂量4 005 cGy/15次,同期瘤床加量至4 500 cGy/15次。常规分割放疗组:全乳放疗剂量5 000 cGy/25次,同期瘤床加量至6 000 cGy/25次。两组均制定以切线野为主的调强放疗(intensity-modulated radiotherapy,IMRT)计划。记录各患者全心脏、左心室、右心室、右室游离壁、室间隔的平均剂量(Dmean)、最大剂量(Dmax)、最小剂量(Dmin),LAD的Dmean以及受到5~35 Gy照射的相对体积分数(V5Gy~V35Gy)。
1.5 心脏超声检查指标
所有患者在乳腺癌术后或辅助化疗完成后且放疗前行基线心脏超声检查,在放疗结束后及放疗结束1年后进行心超随访。心超随访指标包括主动脉根部直径、左房内径、左室舒张末内径、左室收缩末内径、室间隔厚度、左室后壁厚度、肺动脉收缩压、左室射血分数、E峰、A峰、E峰减速时间(E-peak deceleration time,DT)、E、A、E/A和S波峰值。
1.6 美容效果评价
放疗结束1个月后根据Rose乳房美观评分评估美容效果:优秀为乳头外观自然,乳头间水平差距≤2 cm,乳头距胸骨中线距离差≤2 cm,瘢痕对外观无影响;良好为乳头轻度不自然,乳头间水平差≤3 cm,乳头距胸骨中线距离差≤3 cm,瘢痕使乳腺外观轻度变形;差为乳头倾向一侧,乳头间水平差>3 cm,乳头距胸骨中线距离差>3 cm,乳腺严重变形。
1.7 统计学处理
不同计划的每项参数的比较采用t检验,列表记录采用的形式。等级数据采用秩和检验。采用SPSS 19.0统计软件对数据进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的临床病理学特征比较
2017年3月—2018年3月共入组早期左侧乳腺癌保乳术后患者40例,其中大分割组20例,常规分割组20例。年龄28~63岁,中位年龄49岁;中位随访时间12个月;按美国癌症联合会(American Joint Committee on Cancer,AJCC)的第8版TNM分期标准分为T1-2N0M0期,其中腋窝淋巴结的手术方式包括前哨淋巴结活检14例和腋窝淋巴结清扫26例。全部患者中有9例未接受辅助化疗,仅2例患者接受靶向治疗,其余均未接受靶向治疗。大分割组和常规分割组患者的临床病理学特征差异均无统计学意义(P>0.05,表1)。
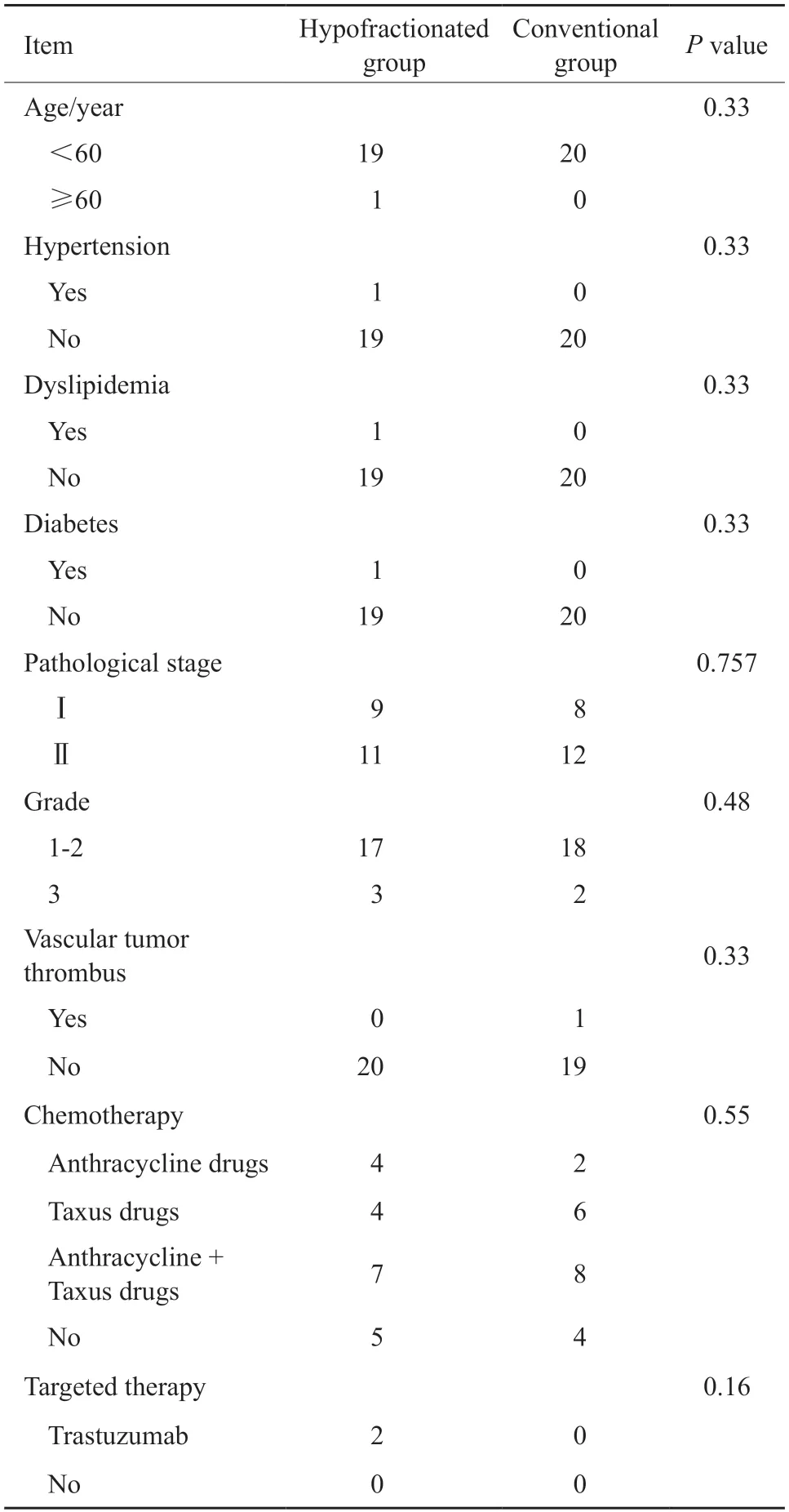
表1 大分割组和常规分割组乳腺癌患者的临床病理学特征比较Tab.1 Comparison of clinicopathological features between hypofractionated group and conventional group for breast cancer patients
2.2 两组患者的正常组织剂量-体积参数比较
2.2.1 心脏
大分割组与常规分割组相比,全心脏的Dmean和V20Gy~V35Gy显著降低(P<0.05),左心室的Dmax和Dmin也显著降低(P<0.05)。大分割组的心脏LAD和左心室的Dmean、V5Gy和V10Gy均低于常规分割组,但差异均无统计学意义(P>0.05)。而与常规分割组相比,大分割组显著降低了右心室、右室游离壁和室间隔的Dmax、Dmean和V30Gy(表2)。

表2 两组患者的正常组织剂量-体积参数比较Tab.2 Comparison of normal tissue dose-volume parameters between two groups
2.2.2 其他正常组织
大分割组与常规分割组相比,同侧肺的Dmean和V20Gy以及对侧乳腺的Dmean均显著降低(P<0.05,表2)。
2.3 两组患者的心超指标比较
在相同的检查时间点,大分割组与常规分割组相比,心超的所有检查指标均在正常区间,两组间差异均无统计学意义,即放疗前、放疗后及放疗后1年两组的心超指标差异均无统计学意义(P>0.05,表3)。

表3 两组患者的心超指标比较Tab.3 Comparison of cardiac ultrasound indexes between the two groups
比较不同的时间点的相同心超指标,放疗前的室间隔厚度与放疗后1年相比差异有统计学意义(P<0.05),放疗后与放疗后1年相比差异也有统计学意义(P<0.05),即放疗后1年的室间隔厚度显著增加。放疗后的左室后壁厚度与放疗后1年相比差异有统计学意义(P<0.05),即放疗后1年的左室后壁厚度增加。左室射血分数在各时间点均未观察到显著性差异(P>0.05,表 4)。

表4 全组患者放疗前后不同时间点的心超指标比较Tab.4 Comparison of cardiac ultrasound indexes at different time before and after radiotherapy in the whole group
大分割组有1例患者心超E/A在放疗后出现一过性增加,从放疗前1.28上升到1.97,放疗后1年复查心超E/A回落到1.48。
2.4 两组患者的心脏不良反应及复发率
随访1年,两组患者均未出现临床心脏不良反应及复发转移。
2.5 两组患者的依从性及美容效果
所有患者均完成放疗计划,随访1年,常规分割组12例(60%)患者的美容评分为优秀,8例(40%)为良好;大分割组14例(70%)患者的美容评分为优秀,6例(30%)为良好。常规分割组与大分割组相比,差异无统计学意义(P>0.05)。
3 讨论
有研究[8]证实,早期乳腺癌保乳术后患者接受辅助大分割放疗可以获得与常规分割放疗相当的肿瘤局部控制率和相似的不良反应发生率。但不少前期研究[6,9-10]均采用全乳放疗后序贯瘤床加量的放疗技术,增加了1.0~1.5周的治疗时间。在乳腺癌保乳术后常规分割放疗时,同期瘤床加量与序贯加量相比可缩短治疗时间,提高放疗计划的剂量均匀性,具有更高的生物学效应,且不影响美容效果[11-14]。结合全乳大分割放疗和同期瘤床加量技术可以进一步缩短治疗时间至3周,是近年来国内外研究的热点。
2021年Krug等[15]报道了保乳术后大分割放疗同期瘤床加量的多中心单臂Ⅱ期临床研究结果,143例患者接受了全乳40 Gy、同期瘤床加量至48 Gy、共16次的放疗计划,随访至放疗后6个月,仅14.7%的患者出现2度及以上皮肤反应。另一项更大型的大分割同期瘤床加量临床研究[16]入组1 160例患者,随访时间超过2年,15.2%患者出现2度及以上皮肤反应,随访2和5年分别有0.1%和0.3%的患者出现2度皮肤纤维化,1.9%和4.3%的患者出现2度毛细血管扩张,美容效果达到优秀和良好的占97%以上。本研究的20例患者采用大分割放疗同期瘤床加量技术,随访1年所有患者均达到优秀或良好的美容效果,与文献[17]报道的结果相似,证实全乳大分割放疗同期瘤床加量具有良好的患者依从性和临床可行 性。
随着医疗水平的提高,乳腺癌患者的生存期显著延长,因此,一些治疗导致的长期并发症日益受到关注,尤其是对心脏功能的影响。乳腺癌放疗后心血管死亡风险增加多发生于放疗后20年[18],且与放射剂量呈正相关[19]。近年来研究发现,由于射线剂量在心脏中的分布是不均匀的,仅评估心脏的Dmean可能低估放射性心脏损伤,左侧乳腺癌患者的左心室和LAD是剂量暴露最多的心脏亚结构,与长期的心脏损伤密切相关[20],LAD的Dmean高于20 Gy会增加5倍的晚期冠状动脉狭窄发生风险[21],目前心脏亚结构受到的照射剂量已受到关注[22]。本研究剂量评价的心脏结构包括全心脏、左心室、右心室、右室游离壁、室间隔和LAD,发现大分割同期瘤床加量技术相较常规分割显著降低了心脏的Dmean、V20Gy~V35Gy,右心室、右室游离壁和室间隔的Dmax、Dmean和V30Gy,大分割组的左心室和LAD的Dmean均低于常规分割组,但差异无统计学意义。目前鲜有研究报道左右心室结构和室间隔的剂量数据,本研究结果提示大分割同期瘤床加量技术相较常规分割具有剂量学优势,显著降低了心脏的受照剂量,有望降低长期的心脏不良反应发生风险。此外,本研究发现,全心脏的Dmean显著下降与左心室、LAD的下降程度不一致,提示放疗计划仅限制全心脏的Dmean不能有效地保护LAD,这与文献[22]报道结果相似,而高剂量照射LAD引发的缺血性心脏疾病是放射性心脏损伤的主要表现[18],因此本研究建议应将左心室和LAD作为独立剂量限制器官,从而更全面地保护心脏。
心脏超声检查可以早期发现放射性心脏损伤,Tuohinen等[23]研究发现,乳腺癌患者最早在放疗后3 d就可以用心超观察到心脏整体纵向应变的下降,同时可能伴有轻微舒张功能障碍。Cao等[24]研究发现,心超可以早期发现心脏舒张功能障碍,提出E/A可以作为参考指标,并证实心脏舒张功能障碍与心脏剂量体积有关。本研究的大分割与常规分割相比,未增加心脏功能障碍的发生率,提示大分割治疗的心脏安全性。全组患者数据提示患者在1年后室间隔和左室后壁厚度增加,虽目前未观察到心脏不良反应,但仍需长期随访心脏毒性。本研究中有1例患侧放疗后出现E/A一过性上升,该患者全心脏的Dmean仅363 cGy,全心脏的V30Gy仅2.74%,但该患者左心室的Dmean达3 465.4 cGy,LAD的Dmean达1 931.6 cGy,分析原因为该患者左心室较小且紧贴靶区,再次验证了放疗计划评估时左心室和LAD作为独立剂量限制器官的重要性和必要性。
本随机对照研究初步显示,早期左侧乳腺癌保乳术后大分割同期瘤床加量的放疗方式较常规分割放疗可显著降低全心脏和部分心脏亚结构的受照剂量,随访1年心超指标无异常,未出现临床心脏不良反应,且不影响美容效果,因此,临床采用本研究的剂量分割方式是安全可行的。仅限制全心脏剂量无法有效保护LAD,建议勾画心脏亚结构并单独限制剂量以更好地保护心脏。但对于准确评估心脏毒性还需要进一步扩大病例数及更长的随访时间。
利益冲突声明:所有作者均声明不存在利益冲突。

