不同年龄儿童及青少年分化型甲状腺癌患者的临床病理学特征与131I治疗分析
齐萌芳,田 甜,黄 蕤
四川大学华西医院核医学科,四川 成都 610041
甲状腺癌是儿童和青少年最常见的内分泌系统恶性肿瘤,发病率逐年增加[1-2],2012—2016年占所有儿童恶性肿瘤的6%以上[3]。2012—2016年,美国SEER数据库甲状腺癌年龄调整后的年发病率:儿童(5~9岁)为1.6/100万,青少年(15~19岁)为34.0/100万[4]。90%以上儿童及青少年甲状腺癌均为分化型甲状腺癌(differentiated thyroid carcinoma,DTC),主要包括甲状腺乳头状癌(papillary thyroid carcinoma,PTC)和甲状腺滤泡癌(follicular thyroid carcinoma,FTC)[5]。2015年美国甲状腺协会(American thyroid association,ATA)指南[6]规定儿童及青少年DTC的年龄上限为18岁。既往多项研究[7-8]已发现,儿童及青少年DTC与成人DTC相比,原发肿瘤直径大,侵袭性强,区域淋巴结转移和远处转移的比例更高,但对于其自身内部不同年龄段之间,特别是青春期前、围青春期和青春期之间的特征研究较少,因此本研究拟探讨不同年龄组儿童及青少年DTC的临床病理学特征及首次131I治疗效果的差异。
1 资料和方法
1.1 临床资料
回顾性分析四川大学华西医院2006年7月—2022年1月收治的甲状腺癌患者的临床资料,纳入标准为:①年龄≤18岁;② 均行甲状腺全切术,术后病理学检查证实为DTC;③术后半年内接受了首次131I治疗;④ 定期随访,且资料齐 全。
1.2 方法和分组
收集患者原发肿瘤的临床病理学特征、首次131I治疗前后的甲状腺球蛋白(thyroglobulin,Tg)水平及影像学检查结果等。根据发病年龄将患者分为青春期前(0岁<年龄≤10岁)、围青春期(10岁<年龄≤14岁)及青春期(14岁<年龄≤18岁)3组,分别对比分析3个年龄组间原发肿瘤的最大直径、有无包膜侵犯、TNM分期、切除淋巴结阳性转移比例、病理学类型、初始复发危险度分层、首次131I治疗剂量,以及第1次131I治疗前和第2次131I治疗前刺激性Tg(stimulated Tg,sTg)水平,分别命名为sTg1和sTg2,计算sTg下降幅度:ΔsTg%=(sTg1-sTg2)/sTg1×100%。根据美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版进行TNM分期[9],根据2015年ATA指南[6]进行初始复发危险度分层和动态风险评估。初始复发危险度分为低危、中危和高危;动态风险评估分为疗效满意(excellent response,ER)、疗效不确切(indeterminate response,IDR)、生化疗效不佳(biochemical incomplete response,BIR)和结构性疗效不佳(structural incomplete response,SIR)[10]。
1.3 统计学处理
采用 SPSS 26.0统计软件对数据进行分析,分析3组患者的临床病理学特征及首次131I治疗效果的差异。计量资料不符合正态分布时用中位数(范围)表示,组间比较采用Kruskal-Wallis检验;计数资料用百分比表示,组间比较采用χ2检验或Fisher确切概率法检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同年龄组间的临床病理学特征分析
经过筛选,本研究共纳入其中156例儿童及青少年DTC患者,发病年龄为4~18岁,男性38例(24.4%),女性118例(75.6%),男女比例为1.0∶3.1,48例(30.7%)患者发生远处转移,均为肺转移。其中0~10岁组为19例(12.2%),男女比例为1.0∶1.4;10~14岁组为38例(24.1%),男女比例为1.0∶2.8;14~18岁组为99例(62.7%),男女比例为1.0∶4.0。3组患者的性别、原发肿瘤最大直径、包膜侵犯、T分期、N分期及切除淋巴结阳性转移比例差异无统计学意义(P>0.05,表1)。但3组患者的病理学类型、远处转移率及初始复发危险度分层差异有统计学意义(P<0.05)。0~10岁组的弥漫硬化性乳头状癌(diffuse sclerosing variant PTC,DSⅤPTC)占比高于10~14岁组和14~18岁组,3组分别为10.5%、2.6%和0.0%(χ2=14.128,P=0.006)。3组患者的远处转移率分别为63.2%、42.1%和20.2%(χ2=16.839,P=0.000);高危患者分别为88.9%、60.5%和46.4%(χ2=12.447,P=0.009)。

表1 儿童及青少年DTC不同年龄组临床病理特征比较Tab.1 The clinicopathological characteristics by age in DTC in children and adolescents
2.2 不同年龄组间首次131I治疗后的动态风险评估比较
研究所纳入的156例患者术后半年内均接受了首次131I治疗,除去4例失访患者外,0~10岁、10~14岁和14~18岁3个年龄组首次131I治疗的中位剂量分别为3.70(2.96~7.40)、3.70(1.11~7.40)和3.70(2.22~7.40)GBq,组间差异无统计学意义(H=3.495,P=0.174)。3组的动态风险评估差异有统计学意义(χ2=21.744,P=0.001),其中0~10岁组的ER比例最低,3组分别为10.5%、25.0%和38.1%;0~10岁组的SIR比例最高,3组分别为68.4%、52.8%和25.8%;0~10岁组的BIR比例也是最高,3组分别为21.1%、13.9%和14.4%;0~10岁组没有IDR(图1)。
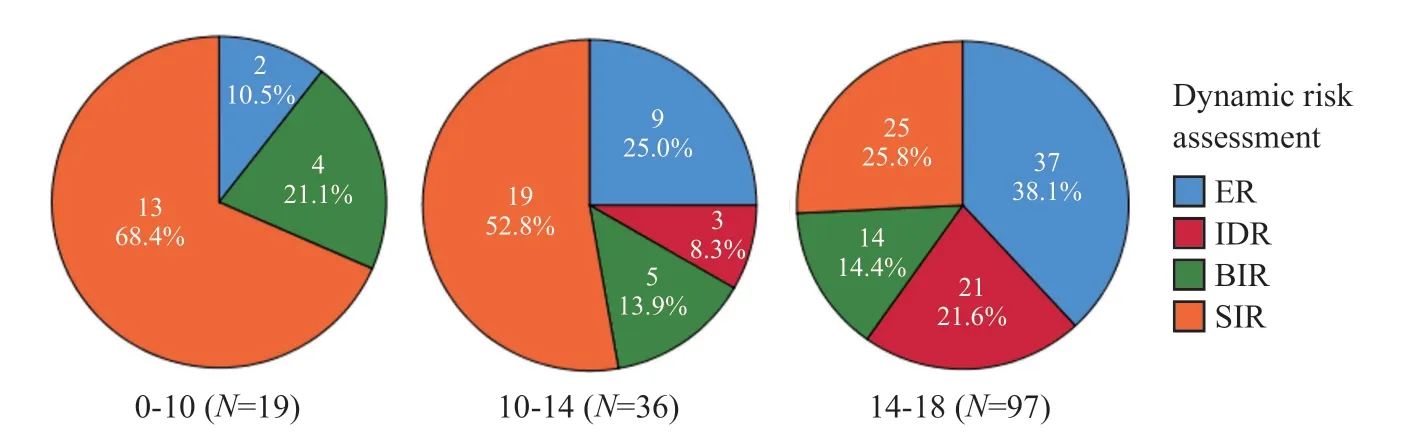
图1 儿童及青少年DTC不同年龄组首次131I治疗后疗效比较Fig.1 Dynamic risk assessment after initial 131I treatment by age in DTC in children and adolescents
2.3 不同年龄组131I治疗后的sTg变化
156例患者中,95例患者接受二次131I治疗,排除TgAb≥40 U/mL的患者,共纳入63例患者,51例(81%)患者首次131I治疗后sTg下降,3组患者的中位ΔsTg%分别为41.31%、38.02%和60.38%,组间差异无统计学意义(H=4.642,P=0.098,表2)。其中42例患者的sTg降幅大于30%,3组病例数分别为7例(70.0%)、7例(53.8%)和28例(70.0%)(χ2=1.212,P=0.546)。

表2 儿童及青少年DTC不同年龄组首次131I治疗前后血清sTg变化Tab.2 Serum sTg value change before and after initial 131I treatment by age in DTC in children and adolescents
3 讨论
本研究中,随着年龄增长,儿童及青少年DTC占比逐渐增加,0~10岁组最少,约占10%,男女比例约1∶1,进入围青春期和青春期,女性患病率逐渐高于男性,这与Hogan等[11]的研究结论相似,青春期前男女发病率基本相同,青春期后男女发病率比例为1∶4,这可能与围青春期及青春期雌激素水平逐渐开始接近成人有关。既往研究[12]发现,儿童DTC与成人DTC相比具有更明显的局部侵犯和淋巴结转移,Okada等[13]研究发现,儿童DTC颈部淋巴结转移比例高达40%~80%,而成人为20%~50%,远处转移最易发生在肺部,占20%~30%,骨、脑及其他组织转移罕见。因为本研究纳入的都是接受131I治疗的患者,淋巴结转移比例更高,达到94%,远处转移占31%,均为肺转移。
Chow等[14]研究证明,术后给予131I时,可以有效地降低儿童DTC的复发率,延长疾病的特异性生存期。本研究对首次131I治疗的效果进行评估,81%的DTC患者在治疗后sTg均有所下降;3个年龄组均有超过一半的患者sTg降幅超过30%,组间差异无统计学意义。但3组患者的ER比例在0~10岁组中最低,主要是该组患者具有最高的远处转移率,1次治疗难以达到ER。
由此可见,虽然10岁以下儿童DTC的发病率不足2/100万[4],但这一年龄段的患者DTC恶性程度更高,患者长期带瘤生存,难以达到ER,这可能与其分子病理学及遗传学特征密切相关。Lee等[15]研究发现,在10岁以下的PTC患儿组中92.9%的患儿会出现融合的致癌基因,主要为RET、ALK和NTRK等基因发生融合,15~19岁组仅有13.5%的患者发生基因融合,而以基因BRAFⅤ600E为主的点突变主要发生在15~19岁组,频率高达65.4%。基因融合的儿童及青少年PTC患者相比点突变儿童及青少年PTC患者分期更晚且预后更差[16],特别是10岁以下儿童DTC患者有更高比例的远处转移,因此131I治疗后也多处于SIR和BIR。
已有研究[15]报道,融合基因抑制剂靶向药物可抑制肿瘤生长,恢复或提高肿瘤细胞对131I的摄取能力,这为具有融合基因的难治性儿童及青少年DTC提供了联合治疗的新思路。
本研究有一定局限性,首先为回顾性研究,纳入病例较少,且部分患者术中及术后资料缺失,可能使统计学分析结果产生偏倚。其次只有少数患者进行了基因检测,未能在结果中展示,也未能进一步分析不同年龄组儿童及青少年DTC的分子表征的差异。研究也只比较了1次131I治疗对疾病的改善情况,没有长期随访并比较3组儿童及青少年DTC患者的治疗结局。
利益冲突声明:所有作者均声明不存在利益冲突。

