罗氏沼虾线粒体锰超氧化物歧化酶的克隆表达与功能研究
李亚男, 陆霖青, 张鹏, 秦真东, 林蠡, 晏磊
1. 仲恺农业工程学院动物科技学院, 广东省水环境与水产品安全工程技术研究中心, 广州市水产病害与水禽养殖重点实验室,广东 广州 510225;
2. 中国水产科学研究院南海水产研究所, 广东 广州 510300
罗氏沼虾(Macrobrachium rosenbergii)原产于东南亚淡水和咸淡水水域, 现今已在巴西、孟加拉国、厄瓜多尔、马来西亚、印度等许多国家都有养殖(De Almeida Marques et al, 2012)。我国最早于1976 年从日本引进罗氏沼虾, 1977 年实现繁育成功。由于罗氏沼虾养殖周期短、生长速度快、适应性强, 深受养殖户喜爱, 目前已在江苏、福建、上海、广东、广西等20 多个省进行推广养殖(肖楚康 等, 2019),是我国重要的经济虾类之一(Miao et al, 2020)。然而,随着罗氏沼虾高密度养殖的迅猛发展, 由病毒和细菌引起的各种疾病给该养殖行业带来了巨大的经济损失 (Khuntia et al, 2008; Lin et al, 2010; 董学洪等, 2015)。据报道, 嗜水气单胞菌(Aeromonas hydrophila)是危害罗氏沼虾养殖业的主要病原之一(Onming et al, 2018)。因此, 进一步了解罗氏沼虾的免疫机制对于指导其疾病防控至关重要。
罗氏沼虾属于无脊椎动物, 主要依靠先天免疫系统来抵御病原入侵, 包括免疫识别、体液免疫、免疫稳态维持和信号传导几个方面(Li et al, 2013a,b)。当病原入侵机体时, 宿主可产生大量具有杀菌作用的活性氧分子(reactive oxygen species, ROS), 如过氧化氢(H2O2)、超氧阴离子自由基(O2-)、羟基自由基(OH-)等(Bogdan et al, 2000), 但是过多的ROS积累会对机体造成氧化应激, 进而损害生物大分子,破坏机体内稳态, 加快疾病病程(Li et al, 2020)。生物体通过抗氧化系统调节体内氧化还原稳态, 因此,抗氧化系统也被认为是先天性免疫非常重要的组成部分(Li et al, 2018; 李亚男 等, 2018)。抗氧化系统主要由抗氧化酶系统以及一些非酶类小分子组成,如超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(CAT)、谷胱甘肽、维生素E 等(Li et al,2018)。其中, SOD 因其对O2-的快速特异性解毒效应而备受关注(Noor et al, 2002; Muth et al, 2004; Li et al, 2019)。依据其金属配体的不同, SOD 又分为CuZnSOD、MnSOD 和FeSOD 三种主要类型(Li et al,2019)。其中, MnSOD 主要定位于胞质和线粒体中。
有研究表明, 线粒体呼吸链是产生ROS 的主要场所之一(Mazat et al, 2020), 因此线粒体MnSOD(mMnSOD)被认为是机体抵御氧化应激的第一道防线, 作用至关重要。但是目前关于甲壳动物mMnSOD 的研究还处于初级阶段, 除了认识到mMnSOD 可通过调节机体氧化还原稳态参与非特异免疫外, 对该蛋白其他免疫功能的认识还非常有限。虽已有学者从罗氏沼虾中成功克隆了mMnSOD基因(MrmMnSOD), 但并未对蛋白功能开展深入研究(Cheng et al, 2006)。近年来有学者发现, 魁蚶(Scapharca broughtonii)MnSOD 具有一定的抑菌功能(Zheng et al, 2015)。因此, 本研究克隆了MrmMnSOD, 制备了多克隆抗体, 首次分析了嗜水气单胞菌刺激下, 该基因在不同组织中的表达模式,并对该蛋白的抑菌功能进行初步探究, 研究结果不仅丰富了甲壳动物先天性免疫基础理论, 也将为罗氏沼虾养殖与病害防控提供依据。
1 材料方法
1.1 实验材料与采样
实验所用罗氏沼虾购自广州市金洋水产公司,体长10±2cm, 暂养于28℃充气循环水中适应一周后开始实验。实验所用嗜水气单胞菌于37℃无抗LB培养基中过夜培养活化, 使用无菌PBS 清洗菌体三次后, 使用无菌 PBS 重悬菌液浓度至 1×106CFU·mL-1(Srisapoome et al, 2018)。将暂养的罗氏沼虾随机分为实验组和对照组, 每尾虾分别腹肌注射100 mL 1×106CFU·mL-1嗜水气单胞菌或等量无菌PBS, 注射后0、3、6、12 和24h, 采集肝胰腺和肠组织进行总RNA 提取和基因表达模式分析。每个时间点取3 只虾进行混样, 平均取3 次。
1.2 总RNA 提取与基因克隆
使用Trizol 法提取总RNA, 使用1%琼脂糖凝胶电泳检测RNA 的完整性, 使用超微量分光光度计NP80(德国, IMPLEN)检测 RNA 的纯度。根据GoldenstarTM RT6 cDNA Synthesis Kit(北京擎科生物有限公司)操作说明, 逆转录合成 cDNA。根据GenBank 中罗氏沼虾 mMnSOD 开放阅读框序列(ABU55004.1), 设计 PET-32a 载体一步克隆引物MrmMnSOD-32a S 和MrmMnSOD-32a A(表1), 以cDNA 为扩增模板, 扩增罗氏沼虾MrmMnSOD 基因序列。
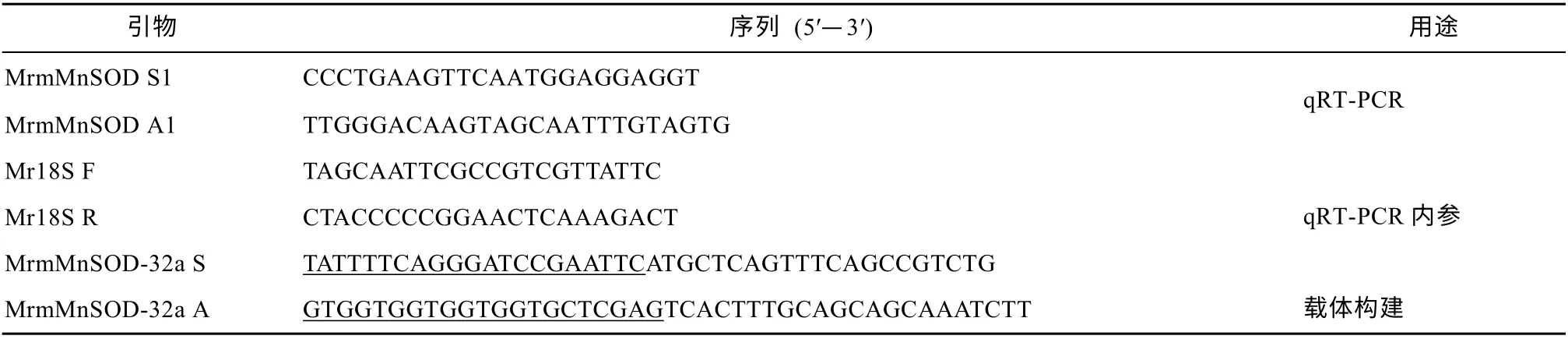
表1 引物序列Tab. 1 Primers used in the study
1.3 重组蛋白表达与纯化
参照 ClonExpress MultiS One Step Cloning Kit(南京诺唯赞生物科技股份有限公司)使用说明,将一步克隆引物扩增得到的罗氏沼虾mMnSOD 基因序列与相应双酶切(EcoRⅠ和 Xhol)线性化的PET-32a 载体进行同源重组反应。反应产物转化大肠杆菌DH5α 感受态细胞, 进行阳性克隆子筛选。阳性克隆子测序检验正确后, 提取质粒转化大肠杆菌 BL21(DE3)表达菌株进行重组蛋白表达。使用0.5mmol·L-1IPTG 在180r·min-1、37℃下震荡培养5~6h, 以7000r·min-1离心5min, 收集菌体, 使用PBS 清洗菌体三次并重悬, 低温下超声波破碎菌体,12% SDS-PAGE 胶检测融合蛋白的表达情况。之后,根据福因德生物《蛋白表达与抗体制备》技术手册对包涵体进行纯化与复性回收。首先使用PBS 在4℃下, 8000r·min-1, 10min 洗涤菌体4~5 次。然后分别 用20mL buffer A(50mmol·L-1Tris-HCI,25mmol·L-1EDTA-2Na, pH=8.0) 、 20mL buffer B(50mmol·L-1Tris-HCI, 5mmol·L-1EDTA-2Na、2mol·L-1脲, pH 为8.0)溶解杂质, 于4℃, 8000r·min-1下离心 10min, 去上清。最后使用 10mL buffer c(0.1mol·L-1Tris-HCI, 10mmol·L-1MDTT, 8mol·L-1脲, pH 为8.0)溶解蛋白质, 4℃ 10000r·min-1离心10min 保留上清, 去沉淀。将前述上清装入透析袋中,置于 50 倍体积透析液(0.1mol·L-1Tris-HCl,5mmol·L-1EDTA-2Na, 5mmol·L-1Cysteins, pH 为8.0)中, 4℃下透析16h 以上, 之后再使用PBS 于4℃下透析16h 以上, 最终得到纯化复性后的重组蛋白。
1.4 抗体制备与检测
用上海碧云天公司Bradford 蛋白浓度测定试剂盒测定纯化回收的重组蛋白浓度, 达到送样要求后送至武汉福因德公司免疫新西兰大白兔, 制备兔源性MrmMnSOD 多克隆抗体血清。抗体制备完成后,采用酶联免疫吸附检测法(ELISA)检测抗体效价,具体操作如下: 用50mmol·L-1的碳酸盐包被缓冲液(pH 9.6)溶解抗原, 使抗原浓度为10~20μg·mL-1, 每孔加100μL 到96 孔酶标板, 4℃过夜。第二天弃去包被液后, 用PBST 洗涤3 次, 每孔加入150μL 1%BSA 37℃封闭1h。PBST 洗涤后, 每孔加入不同浓度的血清和对照样品, 37℃孵育2h。然后洗去血清一抗加入HRP 标记的二抗, 37℃孵育1h。最后清洗二抗加入显色剂显色20min 后, 酶标仪上读取A405吸收值。
1.5 mRNA 水平表达模式分析
cDNA 经 4 倍稀释后, 根据 quantinova-SYBR-Green PCR 试剂盒, 制备20μL 反应体系检测MrmMnSOD 在嗜水气单胞菌刺激下的基因表达模式: 2×SYBR Green PCR Master Mix QN 10μL,RNase-free water 7μL, cDNA 模板 2μL, 引物(MrmMnSOD S1/ MrmMnSOD A1)各0.5μL。使用ABI 7500 Real Time PCR 仪(ABI, 美国)进行基因定量分析, 反应条件如下: 95℃ 2min; 95℃ 5s; 60℃30s; 72℃ 40s, 40 个循环。内参基因选择18S rRNA,引物见表1。采用2-ΔΔCt方法计算基因mRNA 水平相对表达量。
1.6 蛋白水平表达模式分析
为探索MrmMnSOD 在蛋白水平的表达变化,注射嗜水气单胞菌对罗氏沼虾进行免疫刺激后, 分别取攻毒后12h 和24h 肝胰腺、肠组织保存于4%的多聚甲醛中, 送至武汉赛维尔生物科技有限公司进行组织石蜡包埋切片制作。之后, 石蜡切片经脱蜡至水、抗原修复、血清封闭30min, 加一抗4℃过夜孵育, 加二抗室温避光孵育50min 后, 进行DAPI细胞核复染和抗荧光淬灭封片剂封片, 最后, 将切片至于荧光显微镜下进行观察和图像采集。
1.7 蛋白抑菌试验
为初步探究重组MrmMnSOD 的免疫学功能,选用三种革兰氏阴性细菌大肠杆菌(Escherichia coli) 、 嗜水气单胞菌、 副溶血弧菌(Vibrio parahaemolyticus)和两种革兰氏阳性细菌金黄色葡萄球菌(Staphylococcus aureus)、无乳链球菌(Streptococcus agalactiae)检测重组蛋白的抑菌功能。方法参照Zheng 等(2015)进行, 略做修改。实验开始前, 菌株在适宜条件下进行过夜活化, 使用无菌PBS 清洗菌体三次后, 重悬菌液调整浓度至2×107CFU·mL-1。将菌液与蛋白样品按照1:1 加入96 孔酶标板中培养, 蛋白终浓度分别为50μg·mL-1和100μg·mL-1, 每组设置3 个重复, PBS作为空白对照。37℃下孵育12h, 每小时用酶标仪读取A630 值。
1.8 数据处理
使用 SPSS 21.0 软件中单因素方差分析(ANOVA)进行数据处理, 分析差异性。所有数据均以平均值(n=3)±标准偏差(SD)表示。P< 0.05 和P<0.01 分别被认为有显著差异和极显著差异。作图使用Graphpad prism7.0 软件进行。
2 结果
2.1 基因表达模式分析
为了初步探讨MrmMnSOD 是否参与抗菌免疫反应, 使用嗜水气单胞菌感染罗氏沼虾后, 采集了肝胰腺和肠组织, 对MrmMnSOD 基因转录水平进行分析。结果如图1 所示, 肝胰腺中, MnSOD 的基因表达量在感染3h 后迅速升高至0h 的7.7 倍, 之后快速下降; 肠组织中MnSOD 的基因表达量在感染6h 后达到峰值, 为0h 表达量的4.5 倍, 之后表达量下降, 并在感染24h 后又升高至0h 的3.8 倍。该结果表明, mMnSOD 显著响应罗氏沼虾对嗜水气单胞菌感染的免疫应答。
2.2 重组蛋白表达检测
如图2 所示, 经0.5mmol·L-1IPTG 37℃诱导5~6h后, 重组蛋白可在大肠杆菌中 BL21 中大量表达。MrmMnSOD 蛋白由218 个氨基酸组成, 推测分子量约为24kDa, PET-32a 载体标签蛋白约为18kDa, 因此推测表达的重组蛋白大小约为40kDa, 与预期分子量大小一致。纯化后的重组蛋白纯度可达90%以上, 满足后续抗体制备要求。
2.3 多克隆抗体效价检测
如图3 所示, ELISA 效价检测结果显示, 制备的MrmMnSOD 多克隆抗体效价可达1250000 倍。
2.4 蛋白水平表达模式分析
采用组织免疫荧光法分析嗜水气单胞菌感染期间罗氏沼虾肝胰腺和肠中MrmMnSOD 蛋白水平表达模式。结果表明, 嗜水气单胞菌感染可显著激活免疫组织中MrmMnSOD 的表达水平(图4、5)。具体地, 肝胰腺和肠中MrmMnSOD 的表达变化呈现相似的趋势, 随着感染时间的延长, 荧光强度不断增加, 12h 时荧光强度达到最大, 感染后24h 荧光强度有所降低。
2.5 蛋白抑菌活性
罗氏沼虾mMnSOD 蛋白与细菌的共培养实验结果如图6 所示, 实验所选的5 种细菌在与重组蛋白共培养12h 内, 都呈现相似的生长趋势, 生长明显受到抑制。与PBS 对照组相比, 100 和50μg·mL-1两个蛋白浓度都能显著抑制菌体生长, 但抑制效果与蛋白浓度的依赖关系并不显著。仅实验后期,如副溶血弧菌培养至 8~12h, 无乳链球菌培养至5~10h 时, 100μg·mL-1重组蛋白的抑菌效果呈现略微高于50μg·mL-1浓度的抑菌活性。总体而言, 以上结果表明, 在本实验浓度下, 罗氏沼虾mMnSOD重组蛋白可显著抑制常见革兰氏阴性菌和革兰氏阳性菌的生长。
3 讨论
罗氏沼虾是我国重要的水产经济养殖虾类之一,病害的频繁爆发已经成为阻碍该产业健康发展的主要因素之一, 因此对其开展免疫机制的研究十分必要。罗氏沼虾属无脊椎动物, 主要依靠先天免疫来防御病原体入侵, 通过呼吸爆发产生大量ROS 杀灭入侵病原, 然而过量的ROS 如果得不到及时清除,就会破坏机体氧化还原内稳态, 从而加速疾病进程(Li et al, 2020, 2021)。线粒体是产生ROS 的主要场所之一(Mazat et al, 2020), 因此, mMnSOD 被认为是机体对抗氧化应激的第一道防线, 受到研究者的广泛关注(Wang et al, 2018)。
研究表明, 哺乳动物的mMnSOD 活性丧失与各种疾病发生有关, 例如帕金森病、癌症等(Noor et al, 2002; Tao et al, 2012)。水生生物中, mMnSOD 的研究相对滞后, 目前已从海马 (Hippocampus abdominalis)、菲律宾蛤仔(Ruditapes philippinarum)、中华绒螯蟹(Eriocheir sinensis)等物种中克隆得到了mMnSOD 基因 (Umasuthan et al, 2012; Zhao et al,2014; Perera et al, 2017)。日本囊对虾、中国对虾、南美白对虾、罗氏沼虾、小龙虾等虾类的mMnSOD基因也相继被报道(Cheng et al, 2006; Zhang et al,2007; Lin et al, 2010; Gu et al, 2014; González-Ruiz et al, 2021)。结果均显示, 病原刺激能够显著激活上述物种中mMnSOD 的表达水平, 表明mMnSOD 与水生生物的抗菌免疫反应有关。然而上述研究仅涉及基因表达层面, 未涉及蛋白表达水平以及该蛋白具体的免疫功能研究。嗜水气单胞菌是水生环境中常见的细菌性条件致病菌, 可感染罗氏沼虾各个生活史阶段, 引起高的死亡率(Sung et al, 2000;Onming et al, 2018), 但目前还未见罗氏沼虾mMnSOD 在嗜水气单胞菌感染中作用的相关报道。
本研究对MrmMnSOD 在嗜水气单胞菌感染中的作用机制进行了较为系统的研究。结果表明, 嗜水气单胞菌感染后, 罗氏沼虾免疫组织中的mMnSOD 无论是从基因表达水平, 还是蛋白表达水平, 都受到了明显诱导, 证实该蛋白能够积极参与嗜水气单胞菌所引起的免疫应答反应, 这与中国对虾、南美白对虾等物种中mMnSOD 的研究结果相一致(Zhang et al, 2007; González-Ruiz et al, 2021)。然而对于该蛋白更为深入的免疫功能, 目前了解还非常有限。近年来发现, 魁蚶的MnSOD 具有一定的抗菌功能, 可显著抑制大肠杆菌、金黄色葡萄球菌、藤黄微球菌(Micrococcus leteus)的生长 (Zheng et al,2015), 那么MrmMnSOD 是否具有类似的功能?为此, 我们进行了罗氏沼虾重组mMnSOD 抑菌功能实验, 结果表明, 该重组蛋白能够有效抑制三种革兰氏阴性细菌(大肠杆菌、嗜水气单胞菌、副溶血弧菌)和两种革兰氏阳性细菌(金黄色葡萄球菌、无乳链球菌)的生长, 且在检测浓度范围内, 该抑制作用与蛋白浓度的依赖关系并不显著。当前研究结果与魁蚶MnSOD 类似, 证实MrmMnSOD 可能属于免疫相关分子, 通过发挥抑菌功能而参与免疫反应。抑菌功能的强弱可能与细菌种类及表面结构相关(Zheng et al, 2015)。前人研究发现, 内毒素受体CD14 含有一个LPS 结合结构域, 可与细菌或LPS结合, 长牡蛎(Crassostrea gigas)SOD 就具有这样一个结构域, 这可能是SOD 具有抗菌活性原因之一(Gonzalez et al, 2005)。另外, 推测菌体生长代谢过程中, 会向培养基中释放一定的超氧阴离子自由基,超氧阴离子自由基极不稳定, 可被添加到培养基中的SOD 转化为较为稳定的过氧化氢, 而环境中过氧化氢酶相对不足, 从而造成过氧化氢积累, 产生杀菌作用, 但以上推测均有待进一步实验证实。

