槐定碱通过促进自噬改善急性肺损伤小鼠的炎症反应
汤业珍,彭 茜,张 玲,马小霞,韩怀钦,梁锦屏,2
(1.宁夏医科大学基础医学院,银川 750004;2.宁夏医科大学总医院临床病原生物重点实验室,银川 750004)
急性肺损伤(acute lung injury,ALI)是一种以肺部炎症和微血管通透性增加为特征的临床综合征,由多种致病因素引起[1],其病理特征是炎性细胞浸润和炎性介质的大量产生[2],并伴随肺泡上皮细胞和巨噬细胞的异常凋亡等[3],肺实质细胞死亡是ALI的基础。自噬是一种高度保守的分解代谢过程,涉及细胞成分的自噬溶酶体降解,是维持细胞内稳态和应激适应的重要过程[4],有研究表明,激活自噬能有效改善肺部炎性反应[5-6],因此,探究自噬在ALI中的作用将为防治ALI提供重要的理论支撑。
槐定碱(sophoridine,SRI)是天然产物中含量较丰富的生物碱之一,具有广泛的生物活性,如抗炎、抗菌、抗癌等,其有可能成为抗癌有效的、可选择的和耐受性良好的候选药物[7],目前已用于恶性滋养细胞肿瘤的治疗。课题组前期研究发现,SRI在体内外具有抗炎作用,并对内毒素血症小鼠模型显示出明显的防治效应[8-9]。一些药物在治疗ALI时也与自噬有关,如大麻素受体2的激活可以抑制炎症细胞因子的释放,从而缓解内毒素性肺损伤[10];人参皂苷Rg1可能通过激活自噬和核转录因子为ALI提供预防和治疗策略[11];雷帕霉素通过增加自噬和降低核转录因子-κB(nuclear factor kappa-B,NF-κB)信号转导而显著抑制小鼠单核巨噬细胞RAW264.7产生白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18),保护小鼠免受脂多糖(lipopolysaccharide,LPS)诱导的ALI[12]。这些药物均通过促进自噬抑制ALI,提示SRI减轻ALI或与自噬有关,因此本研究采用内毒素的主要成分LPS构建ALI小鼠模型,从自噬的角度探究SRI抑制小鼠ALI的炎性反应作用机制,并探究SRI对自噬及炎性反应的动态调控作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 选用SPF级C57BL/6小鼠,共60只,购自北京维通利华实验动物技术有限公司,动物质量合格证号为SCXK(京)2016-0006,通过伦理审核(宁夏医科大学伦理第2021-991号),所有动物饲养于宁夏医科大学实验动物中心,自由饮食。
1.1.2 仪器与试剂 SRI(MB7130,大连美仑生物技术有限公司);LPS(L2630,Sigma公司);抗体LC3Ⅱ/Ⅰ(L7543,Sigma);P62(39749,Cell Signaling Technology);Beclin1(WL02508,沈阳万类生物科技有限公司);全蛋白提取试剂盒(江苏凯基生物技术股份有限公司);蛋白定量试剂盒(上海碧云天生物技术有限公司);辣根过氧化物酶(HRP)标记的羊抗兔IgG(北京中杉金桥生物技术有限公司);ECL化学发光液(Amersham,美国);ELISA试剂盒(上海江莱生物科技有限公司),测试仪器为Rayto RT-6100。
1.2 实验方法
1.2.1 构建小鼠ALI模型 选取6~8周龄,60只18~22 g的C57BL/6小鼠随机分为6组,阴性对照组(NS对照组)、SRI对照组、LPS组、SRI(1 h、2 h、4 h)+LPS组,每组10只。NS对照组注射等量生理盐水,SRI对照组和SRI(1 h、2 h、4 h)+LPS组腹腔注射SRI(12 mg·kg-1)(参考预实验结果,小鼠腹腔注射SRI LD50为58.0 mg·kg-1,本实验选用SRI 1/5 LD50剂量为12 mg·kg-1)1 h、2 h、4 h后,5%水和氯醛(0.6 mL/10 g)麻醉,将小鼠垂直悬挂于细线上,采用非暴露式气管滴注法将LPS(5 mg·kg-1)滴注入LPS组和SRI(1 h、2 h、4 h)+LPS组小鼠气管诱导ALI模型。NS对照组滴注等量生理盐水,小鼠垂直悬挂1~2 min,确保LPS溶液进入气管并均匀分布在小鼠肺部,LPS刺激24 h后取材。
1.2.2 HE染色观察小鼠肺组织病理变化 无菌取小鼠左肺组织,置于4%多聚甲醛中固定48 h,石蜡包埋切片,HE染色。镜下观察小鼠肺组织炎性病变程度,并按5分制方法进行评分,评分原则以肺组织中的炎性细胞浸润范围为标准:0=0%;1=0~12.5%;2=12.5%~25%;3=25%~50%;4=50%~75%;5=75%~100%,每个切片选取5个视野,计算平均病变率[13]。
1.2.3 ELISA法检测小鼠血清炎症因子的含量 摘眼球收集小鼠外周血,室温静置2 h,15 000×g离心5 min,取血清,ELISA法检测炎症因子肿瘤坏死因子-α(TNF-α)、IL-6、IL-1β的含量。
1.2.4 Western blot法检测小鼠肺组织自噬相关蛋白的表达 提取小鼠肺组织蛋白,BCA法定量。制备10%聚丙烯酰胺凝胶,每孔上样量为40μg/10μL。电泳(80 V,30 min后转至120 V);转膜(80 V,90 min);将膜放置于5%脱脂牛奶中封闭2 h;PBS洗5次,每次6 min;孵育一抗(一抗稀释比例为1∶1 000),4℃过夜,次日室温孵育1 h;PBS洗5次,每次6 min;孵育HRP标记的二抗(二抗稀释比例为1∶5 000),室温2 h后PBS洗5次,每次6 min。使用Western blot印迹膜/凝胶成像仪获得图像,采用Image J分析系统对条带半定量分析。
1.2.5 免疫组化法检测小鼠肺组织LC3蛋白的表达 小鼠肺组织切片,常规脱蜡,抗原抗体修复液煮3 min,冷却后放入0.03%H2O2中10 min,PBS浸泡3次,每次4 min,滴加山羊血清覆盖组织37℃封闭30 min,PBS清洗3次,滴加LC3一抗(1∶150)37℃孵育2 h,PBS清洗后滴加HRP标记的二抗(1∶50)室温孵育2 h,PBS清洗后DAB显色。镜下观察LC3蛋白阳性表达呈棕褐色,结果经Image J分析切片组织阳性染色程度,GraphPad软件作图。
1.3 统计学方法
数据采用SPSS 21.0统计学软件进行分析。计量资料用均数±标准差(±s)表示,多组比较采用单因素方差分析,组内两两比较采用LSD-t检验。检验水准为双侧α=0.05。
2 结果
2.1 SRI对ALI小鼠肺组织HE染色及病理评分的影响
NS对照组与SRI对照组肺组织病理无差异,提示SRI对正常小鼠肺组织结构无影响;与NS对照组和SRI对照组相比,LPS组低倍镜下炎性细胞浸润范围>70%,高倍镜下清晰可见肺泡壁明显充血,大量炎性细胞浸润,肺泡间质增厚,这表明小鼠ALI模型建立成功;SRI预处理可明显减轻上述病理炎症改变,见图1A、1B。肺组织病理评分结果与上述结果一致,SRI(1 h、2 h、4 h)+LPS组肺组织评分均相对LPS组降低(P均<0.05);与SRI(1 h)+LPS组相比,SRI(2 h)+LPS组和SRI(4 h)+LPS组病理评分也均降低(P均<0.05),见图1C。
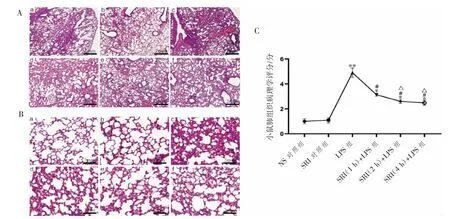
图1 SRI对LPS诱导ALI小鼠肺组织病理学影响
2.2 SRI对小鼠血清中IL-1β、IL-6、TNF-α炎症因子的影响
LPS组较NS对照组血清中TNF-α、IL-6、IL-1β含量升高(P均<0.01);与LPS组相比,SRI(1 h、2 h、4 h)+LPS组以上因子含量均下降(P均<0.05)。SRI(4 h)+LPS组较SRI(2 h)+LPS组IL-1β含量下降(P<0.05),但IL-6、TNF-α含量差异均无统计学意义(P均>0.05),见图2。

图2 SRI对LPS诱导ALI小鼠血清中IL-1β、IL-6、TNF-α的影响
2.3 SRI对自噬相关蛋白P62、Beclin1、LC3Ⅱ/Ⅰ蛋白的影响
与NS对照组相比,LPS组自噬相关蛋白Beclin1表达上升,P62表达下降;与LPS组相比,SRI(1 h、2 h、4 h)+LPS组P62蛋白表达降低,LC3Ⅱ/Ⅰ蛋白表达增加,SRI(2 h、4 h)+LPS组Beclin1蛋白表达增加(P均<0.05);与SRI(1 h)+LPS组相比,SRI(2 h)+LPS组P62蛋白表达降低(P<0.05),SRI(2 h)+LPS组和SRI(4 h)+LPS组Beclin1、LC3Ⅱ/Ⅰ蛋白表达均升高(P均<0.05),见图3。
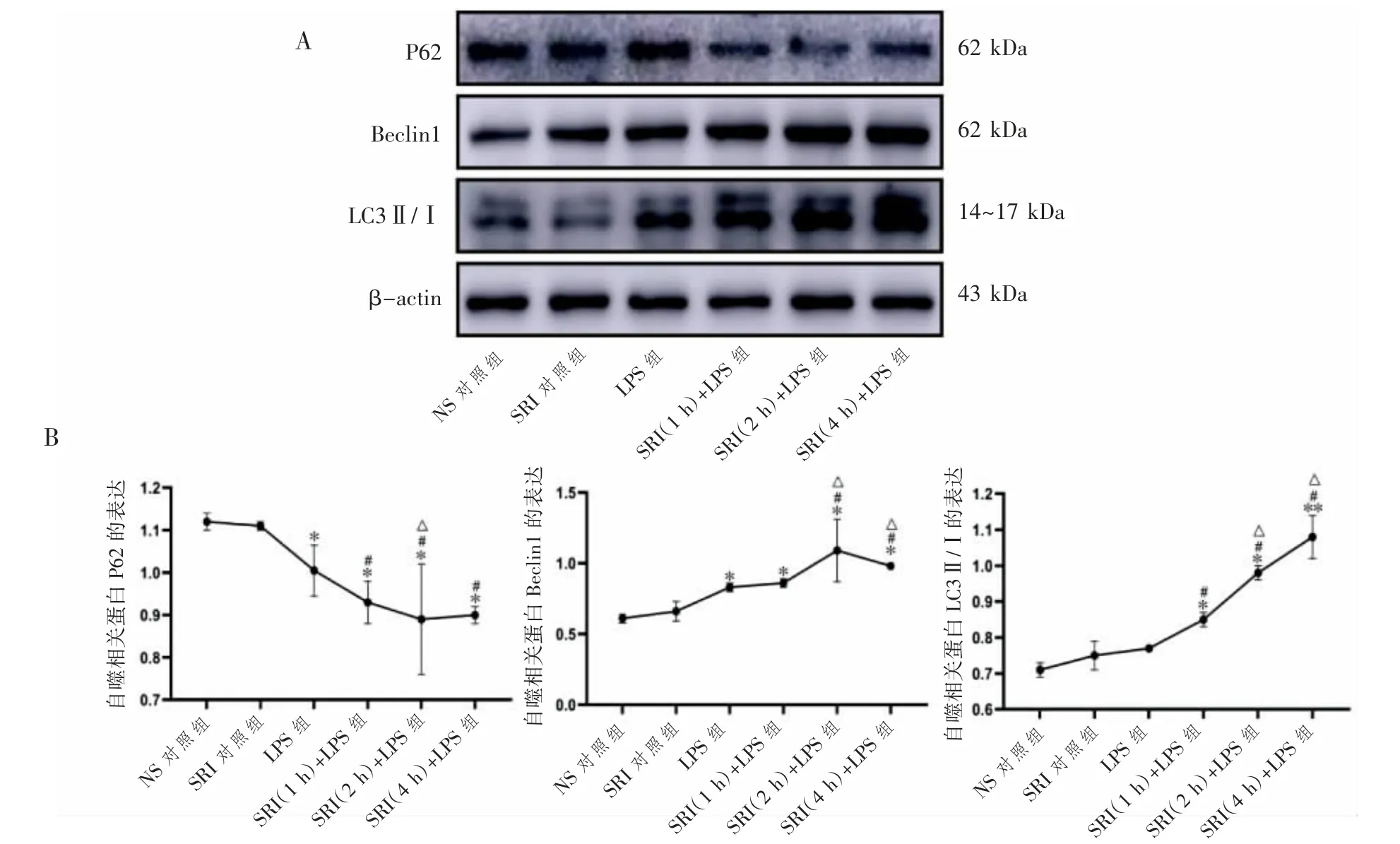
图3 SRI对LPS诱导ALI小鼠自噬相关蛋白P62、Beclin1、LC3Ⅱ/Ⅰ表达的影响
2.4 SRI对小鼠肺组织LC3蛋白表达的影响
免疫组织化学方法检测小鼠肺组织LC3蛋白的表达,LC3主要分布于胞质中,阳性表达为深浅不一的棕褐色,如图4A所示LC3蛋白的阳性表达,NS对照组阴性表达为蓝色,SRI干预ALI小鼠后,LC3蛋白表达量高于NS对照组和LPS组。与NS对照组相比,LPS组LC3表达升高,而SRI(1 h、2 h、4 h)+LPS组与LPS组相比LC3蛋白表达升高,与SRI(1 h)+LPS组相比,SRI(2 h)+LPS组LC3蛋白表达升高(P均<0.05),但与SRI(4 h)+LPS组差异无统计学意义(P>0.05),见图4B。
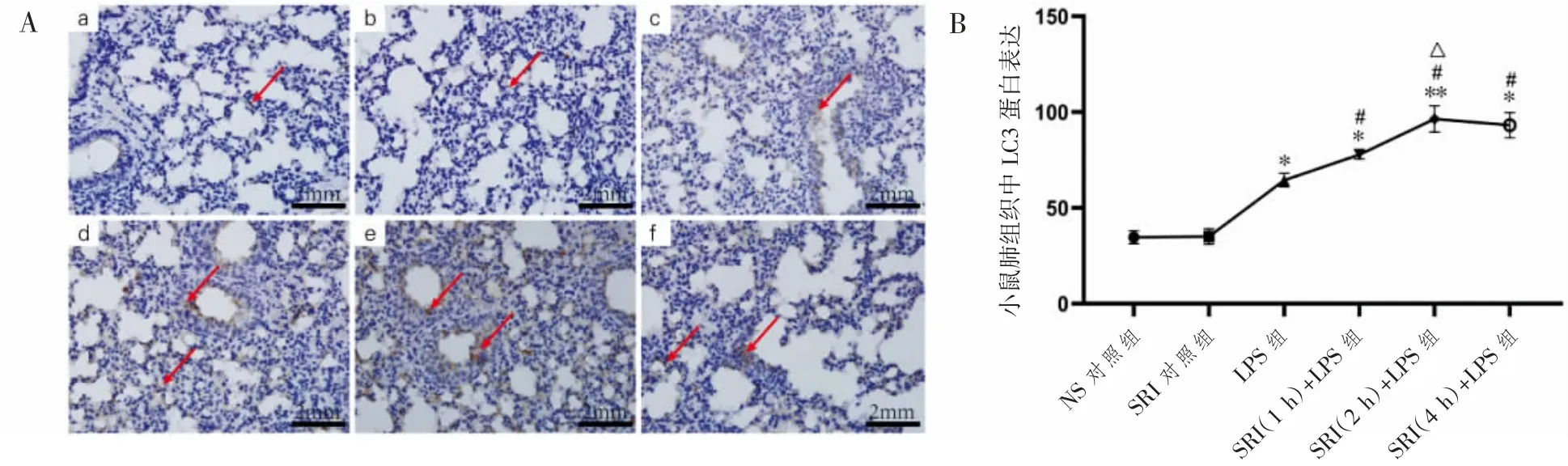
图4 SRI对LPS诱导ALI小鼠肺组织LC3表达的影响
3 讨论
ALI是以炎症爆发为特征的肺部疾病,导致严重的低氧血症、高碳酸血症、弥漫性浸润和不良的肺顺应性[14]。SRI的同体异构物苦参碱可通过多种途径在不同细胞中诱导自噬反应的提高[15-16],然而有关SRI调控自噬的研究国内外鲜有报道,其对机体免疫功能的影响研究也甚少。因此本课题探讨SRI调控自噬对内毒素性肺损伤的保护作用,明确SRI抗内毒素的药理机制,为治疗内毒素血症引发的危重疾病提供科学依据。
LPS通过刺激多种炎症信号通路导致各种炎症因子过度释放诱导产生ALI,TNF-α、IL-1β与IL-6是ALI启动的重要炎症因子[17]。有文献表明LPS诱导的ALI相关炎症因子异常增高[18],本研究结果显示,与NS对照组相比,LPS处理后各组小鼠肺组织病理明显加重,血清炎症因子TNFα、IL-1β、IL-6分泌增加,表明内毒素性ALI小鼠模型构建成功。氧化SRI和氧化苦参碱对小鼠ALI具有一定的保护作用[19-20],本研究发现SRI不同时间预处理后均有效缓解小鼠肺损伤且降低炎症因子TNF-α、IL-1β、IL-6的产生,因此SRI可能通过减少炎症因子分泌从而抑制LPS引起的ALI。本研究进一步探讨了SRI、自噬和ALI三者的关系。
细胞自噬存在于几乎所有真核细胞中,通常被认为是细胞在面对众多应激源时维持正常生理功能的一种反应,在生理过程和许多疾病发病机制中发挥重要作用[21]。目前自噬相关的重要标记物有Beclin1、LC3、P62等,Beclin 1可与P13K形成复合物,调控相关自噬蛋白质定位于前自噬体[22];LC3是检测自噬发生的标志性蛋白,自噬形成时,LC3会通过泛素样反应与磷脂酰乙醇胺结合转变为膜型LC3Ⅱ,LC3Ⅱ/Ⅰ比值的大小可估计自噬水平的高低[23-24],研究结果显示LPS可诱导自噬相关蛋白LC3Ⅱ/Ⅰ、Beclin1的表达,推测可能是由于机体受到LPS攻击后产生的一种自我保护性反应,而SRI处理后能提高LPS诱导的ALI小鼠模型中LC3Ⅱ/Ⅰ的蛋白比值和Beclin1蛋白活化水平,降低P62蛋白表达[25],这表明SRI可通过促进ALI小鼠发生自噬反应,调控自噬相关蛋白表达。促进自噬能够减轻ALI和气道炎症,降低P62蛋白的表达,上调LC3在肺组织中的表达[8],这与本研究的实验结果一致。自噬与炎症有着密切的关系,自噬过程涉及许多自噬相关蛋白,这些蛋白可以吞噬并杀死病原体以保护细胞免受病原体的侵袭,并抑制炎症小体和炎症因子的分泌。综上所述,SRI可能通过在体内促进细胞自噬抑制炎症因子TNF-α、IL-1β、IL-6的分泌从而缓解肺损伤。
虽然本实验表明SRI可以通过促进自噬减轻LPS诱导的小鼠ALI以及减少炎症因子的分泌,从而发挥保护作用。然而,Wang等[26]通过ALI小鼠模型发现,细胞自噬的过度激活也是导致ALI的一个重要机制,抑制细胞过度自噬能起到减轻肺部损伤的作用。部分药物可通过抑制自噬减轻ALI,如血管紧张素转换酶2(ACE2)可通过抑制自噬减轻炎症对肺组织起到保护作用[27];内酯素通过调节自噬因子的表达,激活PI3K/AKT信号通路,降低肺泡上皮细胞凋亡率和ALI自噬水平,最终保护肺组织免受损伤[28]。这可能是由于不同药物靶点与作用机制不同从而导致促进或者抑制自噬减轻ALI,这种对细胞自噬的双向调控为防治ALI提供新的方向。
本研究认为SRI可以通过促进自噬减轻LPS诱导的小鼠ALI以及减少炎症因子的分泌,从而发挥保护作用。有研究表明,通过调控自噬保护ALI的作用可能与Toll样受体4(toll-like receptor 4,TLR4)、雷帕霉素靶蛋白mTOR信号通路有关[29-30],因此,今后将探讨SRI调控自噬对ALI发挥保护作用是否涉及上述通路,并进行相关实验验证。

