阿替普酶治疗急性脑梗死患者临床转归的影响因素
王 伟,宫秀群,余 亮
(1.南京大学医学院附属盐城第一医院/盐城市第一人民医院神经内科,江苏 盐城 224001;2.淮南市第一人民医院神经内科,安徽 淮南 232001)
急性脑梗死(acute cerebral infarction,ACI)是常见的临床急症,主要是由血栓或栓塞性动脉闭塞所引起的局部脑组织血流供应不足,导致局灶性神经功能障碍。随着社会经济的发展和生活方式的改变,脑梗死的发病率逐年上升,流行病学调查显示[1],我国每年新发卒中约240 万人,年卒中相关死亡人数约110 万人,幸存者中3/4 遗留不同程度的残疾。溶栓治疗是脑梗死超早期最有效的治疗手段,阿替普酶是最常用的溶栓药物,其可促进血管再通,挽救缺血半暗带,恢复神经功能,改善患者预后。然而仍有部分患者溶栓后遗留一定程度的残疾。本研究结合2018 年10 月-2019 年9 月我院收治的139 例急性脑梗死患者临床资料,分析阿替普酶静脉溶栓后的临床转归及影响因素,以期为该类患者临床诊疗提供参考依据。
1 对象与方法
1.1 研究对象 选取2018 年10 月-2019 年9 月淮南市第一人民医院神经内科收治的急性脑梗死患者139 例作为研究对象。根据发病3 个月后临床转归情况分为转归良好组和转归不良组。纳入标准:①符合急性脑梗死的诊断标准;②年龄18~80 岁;③在发病4.5 h 内开始阿替普酶静脉溶栓治疗,阿替普酶的剂量为标准剂量(0.9 mg/kg,上限90 mg)。排除标准:①发病3 个月内有头部外伤史、急性脑梗死病史、心肌梗死病史;②近3 个月内有头颅外伤史,近3 周有胃肠道或泌尿道出血史,近2 周行大型外科手术;③近1 周有不易压迫部位的动脉穿刺;④合并严重心、肝、肾功能不全;⑤收缩压>180 mmHg 或舒张压>110 mmHg(药物干预后仍未达标);⑥已知为出血体质或口服抗凝药,48 h 内接受过肝素治疗,且凝血酶原时间高于实验室正常上限,血小板<100×109/L,血糖<2.7 mmol/L;⑦急性脑梗死伴癫痫发作者;⑧颅内出血性疾病。本研究方案通过医院伦理委员会批准,研究对象或监护人知情同意并签署知情同意书。
1.2 方法 收集患者临床资料,包括年龄、性别、血压(舒张压、收缩压)、高血压史、糖尿病史、高脂血症史、冠心病史、心房颤动史、脑梗死病史、吸烟史、饮酒史及实验室指标(总胆固醇、甘油三酯、低密度脂蛋白、随机血糖、空腹血糖、肌酐、尿素氮、尿酸、谷丙转氨酶、谷草转氨酶、中性粒细胞计数、淋巴细胞)、基线NIHSS 评分、溶栓时间窗及发病到治疗时间。NIHSS 评分:使用美国国立卫生院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评估急性脑梗死患者的病情严重程度,评分范围为0~42 分,评分越高表明患者神经受损越严重。根据患者临床转归情况分为转归良好组和转归不良组。临床转归:使用改良Rankin 量表(Modified Rankin Scale)评价临床转归,转归良好:0~2 分,转归不良:>2 分。
1.3 统计学方法 使用SPSS 19.0 统计学软件对进行数据处理。正态分布的计量资料以()表示,两组间比较采用独立样本t检验,非正态分布的计量资料以[M(P25,P75)]表示,两组间比较采用Mann-WhitneyU检验。计数资料以[n(%)]表示,两组间比较采用X2检验。采用多因素Logistic 回归分析影响阿替普酶静脉溶栓患者3 个月转归的独立危险因素,计算优势比(odds ratio,OR)和95%的可信区间(confidence interval,CI)。以P<0.05 表示差异有统计学意义。
2 结果
2.1 影响阿替普酶溶栓临床转归的单因素分析 共纳入139 例急性脑梗死患者在发病4.5 h 内接受了阿替普酶静脉溶栓治疗,年龄18~80 岁,平均年龄(68.01±13.48)岁;男86 例(61.87%),女53 例(38.13%);其中转归良好71 例(51.08%),转归不良68 例(48.92%),两组年龄、收缩压、随机血糖、空腹血糖、中性粒细胞计数、基线NIHSS 评分、溶栓时间窗比较,差异有统计学意义(P<0.05);两组其余指标比较,差异无统计学意义(P>0.05),见表1。
表1 影响阿替普酶溶栓临床转归的单因素分析[,M(P25,P75)]

表1 影响阿替普酶溶栓临床转归的单因素分析[,M(P25,P75)]
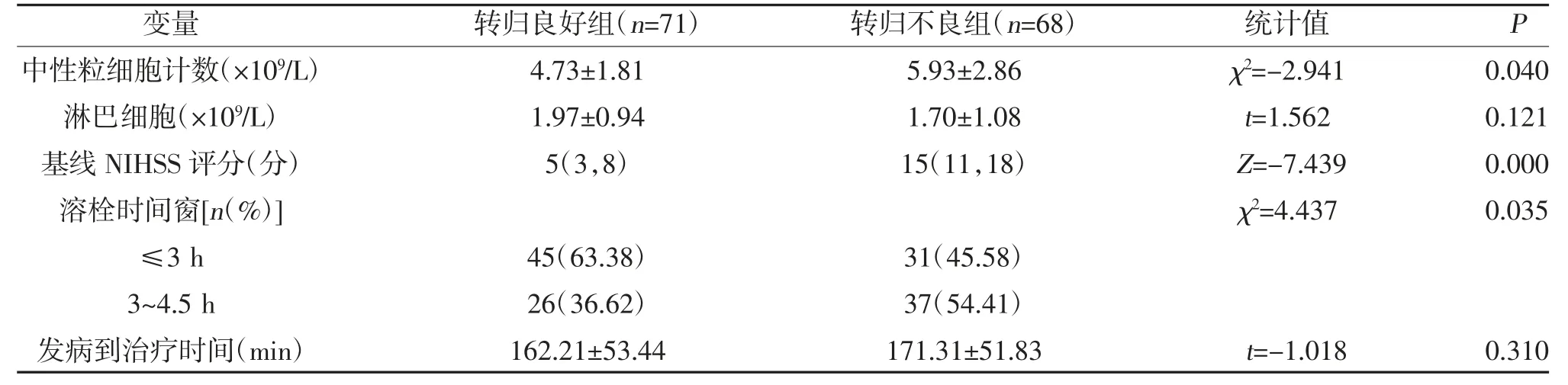
表1 (续)
2.2 影响阿替普酶溶栓临床转归的多因素Logistic回归分析 将年龄、收缩压、随机血糖、空腹血糖、中性粒细胞计数、基线NIHSS 评分、溶栓时间窗为自变量,临床转归作为因变量进行多因素Logistic 回归分析,结果显示基线NIHSS 评分、空腹血糖、中性粒细胞计数是急性脑梗死患者3 个月转归的独立危险因素,见表2。

表2 影响阿替普酶溶栓临床转归的多因素Logistic 回归分析
3 讨论
急性脑梗死最有效的治疗方法是在发病的超早期进行溶栓治疗。阿替普酶作为最重要的溶栓药物,其有效性已被临床广泛证明。然而由于个体的年龄、性别、既往病史、发病时间等的异质性,导致患者的预后存在差异。探讨阿替普酶静脉溶栓的影响因素,在急性脑梗死的超早期进行评估和干预,有利于改善患者远期预后。本研究结果显示,139 例急性脑梗死患者在发病4.5 h 内接受了阿替普酶静脉溶栓治疗,其中转归良好71 例(51.08%),转归不良68 例(48.92%),两组年龄、收缩压、随机血糖、空腹血糖、中性粒细胞计数、基线NIHSS 评分、溶栓时间窗比较,差异有统计学意义(P<0.05);且多因素Logistic回归分析显示,基线NIHSS 评分、空腹血糖、中性粒细胞计数是急性脑梗死患者3 个月转归的独立危险因素。
NIHSS 评分是使用最广泛的卒中评价量表,包括意识水平、运动功能、感觉、共济运动、言语等项目,不仅反映了卒中的严重程度,也是卒中转归的重要因素。研究表明[2],不论是溶栓还是非溶栓治疗,患者3~6 个月的预后随着NIHSS 评分的增高而显著降低。尽管患者来院时的NIHSS 评分无法干预,但可根据严重程度进行患者的分层管理,降低并发症及死亡率。如静脉溶栓仅能增加1%的重度卒中(NIHSS 评分>21 分)患者获益,而病死率增加2.1%[2]。本研究发现溶栓前的NIHSS 评分与3 个月后的临床转归有关,且为独立危险因素,即NIHSS评分越高,患者神经功能缺损越严重,转归越差。Mistry EA 等[3]研究发现,脑梗死患者死亡率随NIHSS评分升高而增加,死亡患者的NIHSS 评分显著高于存活患者,提示NIHSS 评分轻、中度的患者溶栓获益更多。然而NIHSS 评分仍存在一些局限性,如梗塞累及后循环的患者可能仅有躯干共济失调、视力下降、霍纳氏综合征和记忆障碍等症状,此时NIHSS评分甚至可能为0 分[4]。除了NIHSS 评分外,对患者的评估需要结合性别、年龄、发病时间、个人史、既往史等做出综合判断。
脑缺血后某一动脉供血区血流下降,在缺血区不同部位的缺血程度不同,血流量最低部位缺血最为严重,称为梗死核心区。由于侧支循环的存在和建立,核心区周围的血流量尽管已经降低到可能导致脑细胞膜电位衰竭,但未达到神经元死亡的阈值,此区域称为缺血半暗带。随着时间的延长,缺血半暗带的脑血流量逐渐减少,最终造成此部分脑组织不可逆的死亡。如果能够及时干预、恢复此区域的脑血流量,缺血半暗带的脑组织仍可能存活,这是脑梗死超早期溶栓的理论基石。既往研究证实[5,6],急性脑梗死发生3 h 内给予阿替普酶静脉溶栓治疗可改善患者临床结局,但因溶栓时间窗窄,院前、院内延误及患者或家属的顾虑等多种因素导致静脉溶栓的比例较低。《中国急性缺血性脑卒中诊治指南2018》[5]将急性脑梗死的溶栓时间窗扩大到4.5 h。本研究结果发现,3 h 以内的溶栓转归优于3~4.5 h,去除混杂因素后时间不是影响临床转归的独立危险因素。尽管3~4.5 h 溶栓仍会有益处,仍需尽快启动溶栓治疗,因越早溶栓获益越大[7],缩短DNT 时间是改善临床转归的有效途径之一。
年龄是脑梗死的危险因素之一,与年轻患者相比,老年患者的脑梗死会造成更为严重的神经功能障碍。调查发现[8],脑梗死30 d 内的死亡率在45~64岁、65~74 岁和75 岁及以上人群中分别为15%、18%和36%。Muruet W 等[9]调查了脑梗死患者的长期生存率,结果发现不论NIHSS 评分如何,>75 岁年龄组患者的年死亡率是75 岁以下年龄组的2~4 倍。高龄患者的临床转归更差,可能与伴发其他疾病如动脉粥样硬化、房颤、糖尿病等风险增加有关[10]。
急性期血压升高被认为与不良预后有关,血压升高可能反映了先前存在有高血压病及相关并发症,同时血压过高会增加脑水肿及脑出血风险。盘爱花等[11]研究报道,静脉溶栓治疗后血压未干预组患者的血清炎症因子IL-6、IL-8、TNF-α 更高,合并更多的并发症,且3 个月预后更差。尽管降低血压对心脑血管病的一级、二级预防的都有明确的益处,但在脑梗死急性期的降压对预后的作用尚未确定。有研究表明[12,13],急性期强化降压治疗并不能改善急性脑梗死的远期预后,可能是强化降压加重了半暗带的损伤。Bangalore S 等[14]研究发现,收缩压低于或高于150 mmHg 均会增加患者住院时间、残疾程度及死亡率,收缩压与预后呈J型或U型关系,然而降低收缩压可减少溶栓后出血并发症,提示调控脑梗死后血压的最佳区间可能还需要更多的研究。
动脉粥样硬化是心脑血管疾病的病理生理基础,炎症因素参与动脉粥样硬化的发生发展。中性粒细胞通过向动脉粥样硬化处募集、损伤内皮细胞功能、分泌颗粒蛋白诱导单核细胞进入动脉粥样硬化处,激活吞噬细胞并促进泡沫细胞形成,增加粥样斑块易损性,进而参与动脉粥样硬化的发生、发展[15]。中性粒细胞还是急性脑梗死后参与脑组织损伤的主要白细胞亚型,其数量反映炎症的活跃程度[16,17]。急性脑梗死早期中性粒细胞计数与脑梗死严重程度和梗死体积呈正相关[18]。本研究发现,转归不良组中性粒细胞较良好组显著增高,且中性粒细胞计数是急性脑梗死患者3 个月转归的独立危险因素。脑梗死发生后,中性粒细胞被迅速招募到缺血部位,通过释放氧自由基、蛋白酶和白三烯导致组织损伤[19],高血糖可显著增强中性粒细胞在缺血组织周围的浸润,引起更加严重的脑损伤[20]。有研究尝试通过减少中性粒细胞的生成、降低在动脉粥样斑块处的募集、抑制中性粒细胞对血小板的激活等方面减轻中性粒细胞参与的病理生理过程[21,22],但中性粒细胞是人体防御功能的重要组成部分,对其干扰可能会导致严重的副作用,需谨慎寻找特异性靶点,以尽可能降低不良反应。
此外,入院后空腹血糖与溶栓后临床转归有关。目前已有研究证实[23],急性脑梗死患者无论是否患有糖尿病,血糖水平的升高均会加重脑组织损伤和神经功能障碍,增加病死率。另有研究发现[24],高血糖患者接受溶栓治疗后血管再通时间延迟,且与溶栓后症状性颅内出血、死亡事件及其他不良事件相关。高血糖不仅可直接损伤缺血脑组织,还可通过降低血管再通几率、减少缺血再灌注疗效、增加再灌注损伤等方面影响患者预后[25]。高血糖可影响多个病理生理途径,如高血糖损伤内皮功能[26]、干扰凝血和纤溶途径通路[27]、损害微血管反应性影响再灌注、增加血脑屏障通透性加重脑水肿等。尽管高血糖增加溶栓患者不良预后,然而现有的RCT 研究发现积极控制血糖未能使溶栓患者获益且可能增加低血糖的风险[28],可能与RCT 研究中患者的低血糖发生率高、启动降糖时间延迟等因素有关,未来需进一步改进研究方案以得到更可靠的结论。
综上所述,基线NIHSS 评分、空腹血糖、中性粒细胞计数是急性脑梗死患者静脉溶栓转归不良的独立危险因素。但因本研究是单中心回顾性研究,纳入样本量较小,未对患者进行长时间随访,需行长期、多中心、大样本前瞻性研究进一步证实该结论的可靠性。

