碱激发偏高岭土-矿渣对氯离子的固化能力及其影响因素
谷上海,黄敦文,杨翼玮,吕毅刚,2,彭 辉,2
(1.长沙理工大学 土木工程学院,湖南 长沙410114;2.长沙理工大学 桥梁工程安全控制教育部重点实验室,湖南 长沙410114)
氯盐侵蚀引起的混凝土内部钢筋锈蚀的现象是混凝土结构的主要病害和耐久性退化的重要成因.混凝土对氯离子的物理吸附和化学结合行为已经被大量研究所证实[1-4].扩散进入混凝土内部的氯离子,一部分存在于混凝土孔隙溶液中,这部分氯离子对混凝土中的钢筋产生严重的锈蚀作用;另一部分被混凝土的固相成分(如水化产物)和孔结构表面物理吸附(主要指C-S-H的吸附)或化学结合(主要指Cl-与AFm类相结合形成Friedel’s盐和Kuzel’s盐),对钢筋不产生锈蚀危害.因此,确定氯离子的固化能力对于准确评估氯盐侵蚀条件下钢筋混凝土的使用寿命具有重要影响.
地聚物(Geopolymer)是具有火山灰活性(或潜在火山灰活性)的硅铝酸盐类矿物在碱激发作用下发生反应生成的一种新型无机聚合物材料[5-6],可部分代替水泥制备低碳混凝土,其对氯离子的固化能力和机制也受到了广泛的关注.Ismail等[7]认为碱激发矿渣/粉煤灰地聚物对氯离子的固化主要是反应产物的物理吸附,而不是化学结合.他们认为,C-A-S-H凝胶具有物理吸附氯化物的能力,不会改变矿物结构;而多孔的N-A-S-H凝胶在其表面吸附氯化物,高氯化物的孔溶液蒸发后将存在NaCl沉淀.Lee等[8]认为N-A-S-H凝胶的氯离子结合能力高于C-A-S-H凝胶.粉煤灰在碱激发水泥中的掺入导致氯化物在N-A-S-H凝胶中的物理吸附变大,其表面积更大.
关于碱激发水泥是否存在化学结合问题,目前尚未形成统一认识.Brough等[9]认为碱激发水泥的氯离子固化过程中没有形成Friedel’s盐.Ismail等[7]研究了氯离子固化后发现,碱激发矿渣/粉煤灰砂浆中没有形成Friedel’s盐,主要是因为没有水滑石相[10].但Ke等[11]发现,在NaCl溶液浸泡后的Na2CO3激发的矿渣中,发现了Friedel’s盐的两个多晶型物(菱形水铝钙石和单斜水铝钙石),意味着Na2CO3激发的矿渣存在对氯离子的化学结合.其作用机制为层间离子的表面吸附和置换作用,即水滑石相和钙矾石相可以有效地吸收具有不同初始[Cl-]/[OH-]比的高碱性溶液中的氯离子[12].
对于水泥混凝土,游离氯离子与结合氯离子之间的关系可以用结合等温线来描述[13].Tang和Nilsson[14]研究水泥净浆和砂浆的氯离子固化能力和结合等温线,发现外部氯离子浓度小于0.01 mol/L时,Freundlich等温线具有较好的拟合程度;外部氯离子浓度大于0.05 mol/L时,Langmuir等温线拟合效果更好.Zibara[15]研究水泥净浆在氯离子浓度为0.1~3.0 mol/L范围内的氯离子结合等温线时认为Freundlich等温线较Langmuir等温线拟合效果更好.Hirao等[2]研究水泥净浆的氯离子结合能力时认为Freundlich等温线对于化学结合氯离子(AFm相结合氯离子形成Friedel’s盐)具有较好的拟合效果,而Langmuir等温线对于C-S-H凝胶的物理吸附具有较好的拟合效果.与水泥混凝土相比,关于地聚物中游离氯离子与结合氯离子之间相关性的研究还较为匮乏且分歧较大,Yang等[16]研究粉煤灰基地聚物的氯化物扩散系数时发现游离氯离子与固化氯离子之间呈线性关系.Ye等[17]也发现碱激发矿渣中的游离氯离子与固化氯离子几乎呈线性关系.但Zhang等[18]则认为碱激发矿渣/粉煤灰中游离氯离子与固化氯离子的关系用Langmuir等温线描述较好.
确定氯离子的固化能力、固化机制、以及游离氯离子/结合氯离子间的关系,对于确定氯离子在地聚物中的传输行为,从而准确预测钢筋地聚物混凝土结构的耐久性能具有重要意义.鉴于此,本文采用等温吸附平衡法和XRD表征方法研究碱激发偏高岭土/矿渣复合凝胶体系地聚物净浆(Alkali-activated metakaolin-slag paste, AAMS)的固化氯离子能力,分析不同氯离子浓度下矿渣掺量和激发剂模数等因素对AAMS固化氯离子能力的影响.
1 试验材料及方法
1.1 原材料和试件配比
偏高岭土(MK)为内蒙古KAOPOZZ系列高活性偏高岭土,由高岭土在700 ℃煅烧24 h得到.粒化高炉矿渣(Slag)由华新湘钢水泥公司提供,属于高活性酸性矿渣.P·O 42.5普通硅酸盐水泥(PC)由湖南坪塘南方水泥有限公司生产.偏高岭土、矿渣和硅酸盐水泥的化学组成见表1.硅酸钠原液来自河北桥东区力天化工有限公司,外观为透明黏稠液体,成分为Na2O、SiO2和H2O,组成比重为39.9%、8.35%和51.75%.氢氧化钠、过氧化氢、氯化钠和硝酸银均采用上海埃彼化学试剂有限公司生产.其中氢氧化钠为分析纯,纯度≥96%,外观为白色结晶片状;过氧化氢用于除去浸泡液中可能存在的S2-,纯度≥30%;氯化钠为分析纯,纯度≥99.5%;硝酸银为分析纯,纯度≥99.8%.试验全程均采用去离子水.
试验主要考察矿渣掺量、激发剂模数和浓度对碱激发偏高岭土/矿渣固化氯离子能力的影响.参数水平的确定基于文献[19] 的结果,充分考虑各个水平和它们的耦合作用对AAMS固化氯离子的作用.选用的参数水平为:矿渣掺量为0%、40%、60%和100%;激发剂模数为1.0、1.2、1.4、1.6和1.8;激发剂浓度为20%、25%、30%、35%和40%.并设置水灰比为0.4和0.6的硅酸盐水泥净浆试件作为对照组,具体配比见表2.试件为φ50 mm×50 mm的圆柱体.

表1 胶凝材料的化学成分/%Tab.1 Chemical composition of binding materials /%

表2 试件配合比Tab.2 Mix proportion of specimens
1.2 试样制备和处理
为防止水分蒸发,试件表面用保鲜膜包裹密封,在标准养护箱中养护28 d后取出试件.为了获得真实的氯离子固化量,应避免碳化和过热的影响.将养护28 d后的试样进行砂纸打磨,去除试样表面层,以避免可能发生的早期碳化,将剩下的部分压碎并用分样筛收集粒径在0.25~2.0 mm范围内的试样颗粒[14].将试样颗粒置于存有硅胶的真空干燥箱中,在(20±0.5)℃干燥5 d,真空度为-0.1 MPa,除去大部分水分.然后,将样品放入存有硅胶的干燥器中并同时放入生石灰以除去干燥器内空气中的CO2,继续干燥7 d[14,20],即获得试验分析的样品.
1.3 H2O2除去氯化钠浸泡液中的S2-
经由预试验发现,掺有矿渣的AAMS的氯离子浸泡液通过瑞士Metrohm 848 Titrino plus电位滴定仪进行滴定时,滴定曲线下降后上升(下降段出现上升峰),滴定现象为灰黑色沉淀,与硝酸银溶液滴定氯离子试验结果不符(如图1).通过对浸泡液和滴定产物分析知,出现的干扰离子可能为S2-.作者经试验发现,滴定前将待测的浸泡液酸化并添加1 mL的过氧化氢在60 ℃的温度下搅拌3分钟,可以很好地除去干扰离子对滴定曲线和结果的影响(如图2),测得真实的氯离子量(取用已浸泡掺有矿渣试样的去离子水作为待测液,通过对待测液氧化处理前后的滴定曲线和结果进行对比分析,可以验证干扰离子是否已除尽).
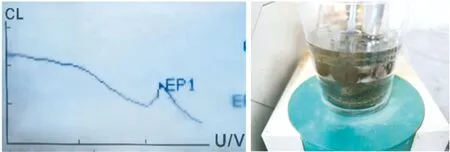
图1 未经过氧化除杂的待测液的电位滴定结果Fig.1 Potential titration results of the solution to be tested without oxidation and impurity removal

图2 氧化除杂后的待测液的电位滴定结果Fig.2 Potentiometric titration results of the solution to be tested after oxidation and impurity removal
1.4 测试分析方法
本文试验采用Tang和Nilsson[14]提出的测试硅酸盐水泥净浆吸附氯离子性能的等温吸附平衡法.具体操作包括:称量约25 g样品(精确至0.000 1 g)放入100 mL的塑料杯中,然后,用移液管移取50 mL的NaCl溶液置于杯中以浸泡样品.NaCl溶液中的Cl-浓度为0.1、0.3、0.5、0.7、1.0、2.0和3.0 mol/L,这是因为海水中Cl-的典型浓度约为0.6~0.7 mol/L[21],而在广泛使用的氯化物加速试验中,NaCl溶液的浓度约为0.5~2 mol/L[22-23];为考察高浓度Cl-环境下试样对Cl-的吸附能力,本文试验进一步将最大Cl-浓度取为3 mol/L.由于地聚物中的孔溶液具有高碱度(约1.0 mol/L NaOH)和高离子强度[24-25],NaCl溶液用1.0 mol/L NaOH溶液配置以防止在浸泡过程中碱从地聚物样品中浸出[14],即不同浓度的NaCl溶液具有相同的OH-浓度,且[Cl-]/[OH-]比率范围为0.1~3.0.之后,将杯口密封并储存在室温(20±0.5 ℃)中,定期摇晃(每3天震荡1分钟),持续1个月,以使Cl-扩散到样品颗粒中进而达到吸附平衡.根据已有氯离子固化性能研究的文献[14,26-27]和作者的初步试验,在最初的12 d内可以达到吸附平衡(如图3).

图3 吸附平衡与时间的关系Fig.3 Relation between adsorption equilibrium and time
因此,一个月的时间足以使各种样品达到吸附平衡.吸附平衡后,浸泡液经过适当稀释,使用校准后的0.01 mol/L AgNO3溶液通过瑞士Metrohm 848 Titrino plus电位滴定仪对达到吸附平衡后的浸泡液进行电位滴定测定其Cl-浓度.
样品达到吸附平衡后,可以认为浸泡液中Cl-浓度的降低是由于样品对Cl-的固化作用.知道Cl-的初始和最终浓度,浸泡液的体积和样品的干燥质量后,可以使用以下公式计算结合的Cl-含量为
(1)
式中:Cb:总的Cl-结合量(物理吸附与化学结合),mg/g;V:浸泡液的体积,为50 mL;C0:浸泡液的初始Cl-浓度,mol/L;C1:浸泡液吸附平衡后的Cl-浓度,mol/L;Wd:样品的干燥质量,g;35.45是Cl-的摩尔质量.
Wd可以根据样品经过真空干燥和干燥器干燥后的质量与样品在105 ℃的烘箱中烘至恒重后的质量差值计算得出[18].公式如下.
Wd=Wv(1-δv)
(2)
式中:Wv:经过真空干燥和干燥器干燥后的质量,g;δv:经过真空干燥和干燥器干燥后样品的可蒸发水分含量.
将浸泡后的样品颗粒在存有硅胶和生石灰的真空干燥箱中真空干燥3 d后,将样品颗粒研磨后通过20 μm的分样筛,采用X射线衍射技术分析氯盐浸泡后地聚物的晶相变化.粉末样品在10~55°范围内连续扫描,步宽为0.02°,扫描速度为4°/min.
2 试验结果与分析
氯离子固化会影响氯离子的传输规律,进而影响碱激发偏高岭土/矿渣的耐久性能.本节采用等温吸附平衡法和XRD表征方法研究矿渣掺量、激发剂模数和激发剂浓度对AAMS固化氯离子性能的影响,并与水灰比(w/c)为0.4和0.6的水泥净浆的氯离子固化性能对比.
2.1 PC净浆的氯离子固化能力
图4描绘了不同水灰比的硬化PC净浆在氯盐溶液中浸泡30 d后游离氯离子(Free chloride, Ce)与结合氯离子(bound chloride, Cb)之间的关系.由图4可看出,随着总氯离子浓度增大,PC净浆固化氯离子的能力和游离氯离子浓度都有所增大,这是因为随着外部氯离子浓度的增大,使得水泥水化产物C-S-H凝胶和AFm相接触氯离子的可能性增加,这两种水化产物分别可对氯离子进行物理吸附和化学结合.另一方面,PC净浆固化氯离子能力随着水灰比的增大而提高,这是由于水灰比可以提高水泥的水化程度,并导致微孔尺寸增大,从而提高对氯离子的吸附能力[2,28].水泥产物C-S-H凝胶对氯离子的物理吸附能力可由Langmuir等温线拟合,而AFm相对氯离子的化学结合(生成Friedel’s盐)能力可由Freundlich等温线拟合[2].由图4可看出,与Freundlich等温线相比,Langmuir等温线的拟合优度更大,这表明本文试验中水泥净浆的氯离子固化能力以C-S-H凝胶对氯离子的物理吸附为主,与北欧标准试验方法NT BUILD 492中的结论相同[22].
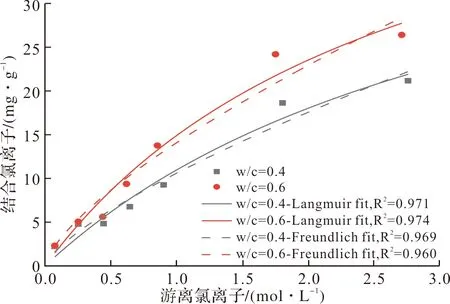
图4 PC净浆的Cl-等温吸附曲线比较Fig.4 Comparison of chloride ion binding isothermal adsorption curves of PC slurry
图5给出了不同水灰比的PC净浆和其在1.0 M NaCl溶液中达到吸附平衡后的XRD图谱.由图5可看出,吸附平衡后出现了新的物相Friedel’s盐(Ca2Al(OH)6Cl·2H2O, PDF#42-0558).Pa-padakis等[29]认为Friedel’s盐可通过吸附沉淀(氯离子与铝酸三钙相结合)或离子交换(具有很高电负性的氯离子置换出AFm相中的OH-)机制形成.因此,这里Friedel’s盐的形成表明了水泥净浆对氯离子的化学结合能力的存在.

图5 PC净浆在1.0 M氯化钠溶液吸附前后的XRD图谱Fig.5 XRD patterns of PC slurry before and after adsorption on 1.0 M NaCl solution
2.2 碱激发偏高岭土/矿渣硬化浆体(AAMS)的氯离子固化能力
2.2.1 AAMS对氯离子固化的拟合曲线
表3列出了Linear、Freundlich和Langmuir等温线的拟合参数.由表3中的拟合优度(R2)可看出,在本文所考察的Cl-浓度范围(0.1~3.0 mol/L)中,游离氯离子和结合氯离子之间的关系使用 Langmuir等温线可以更好地拟合,这可能归因于AAMS对氯离子的固化作用是以物理吸附为主,而化学结合具有相对较小的作用[7].

表3 PC和AAMS的Linear、Freundlich和Langmuir 等温线的拟合参数Tab.3 Fitted parameters for Langmuir、Freundlich and Langmuir isotherms for PC and AAMS
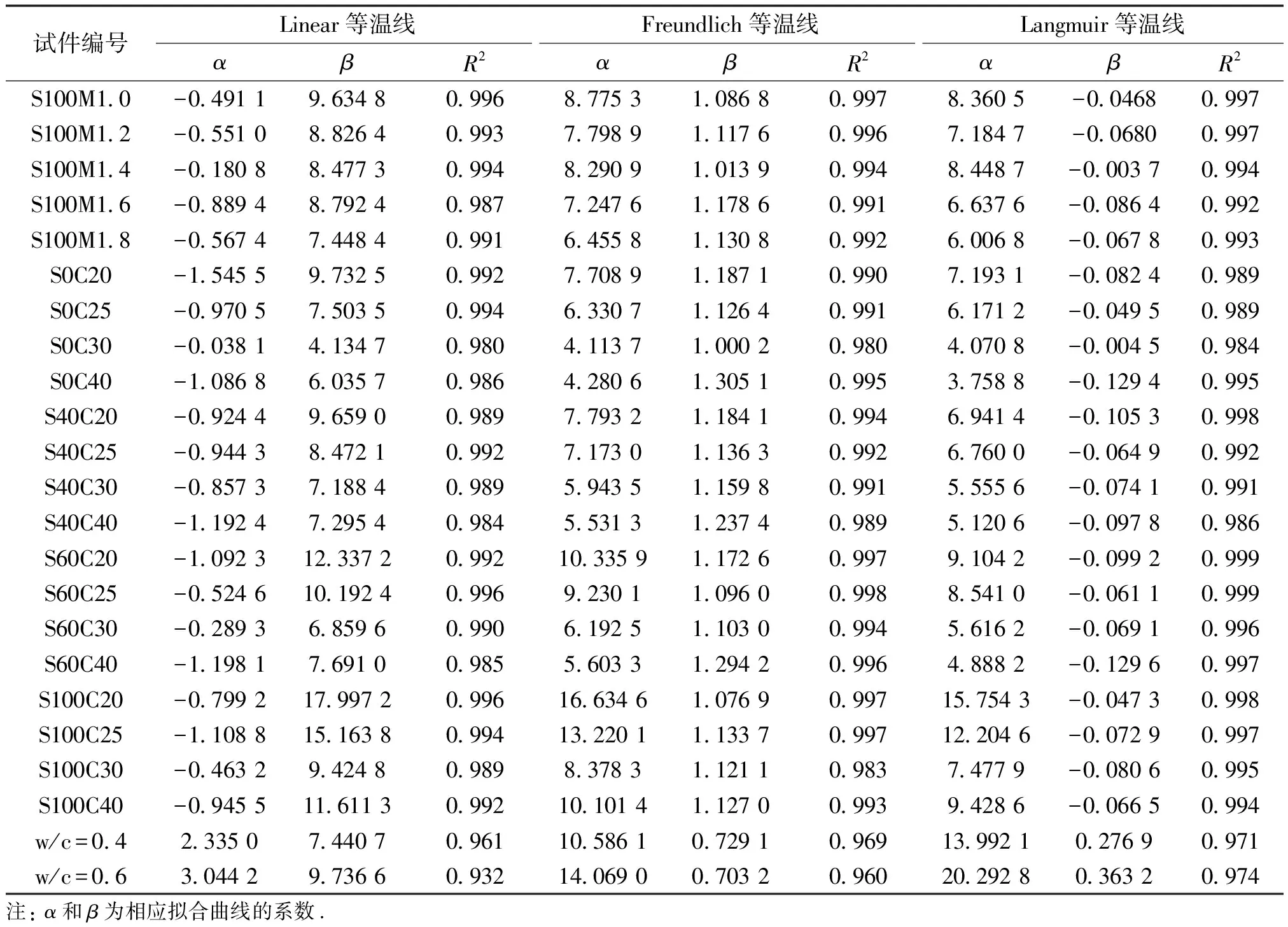
续表3
2.2.2 矿渣掺量对氯离子固化能力的影响
图6描绘了具有不同矿渣掺量的AAMS和水灰比为0.4的PC净浆在氯化钠溶液中吸附平衡后的氯离子固化等温线.
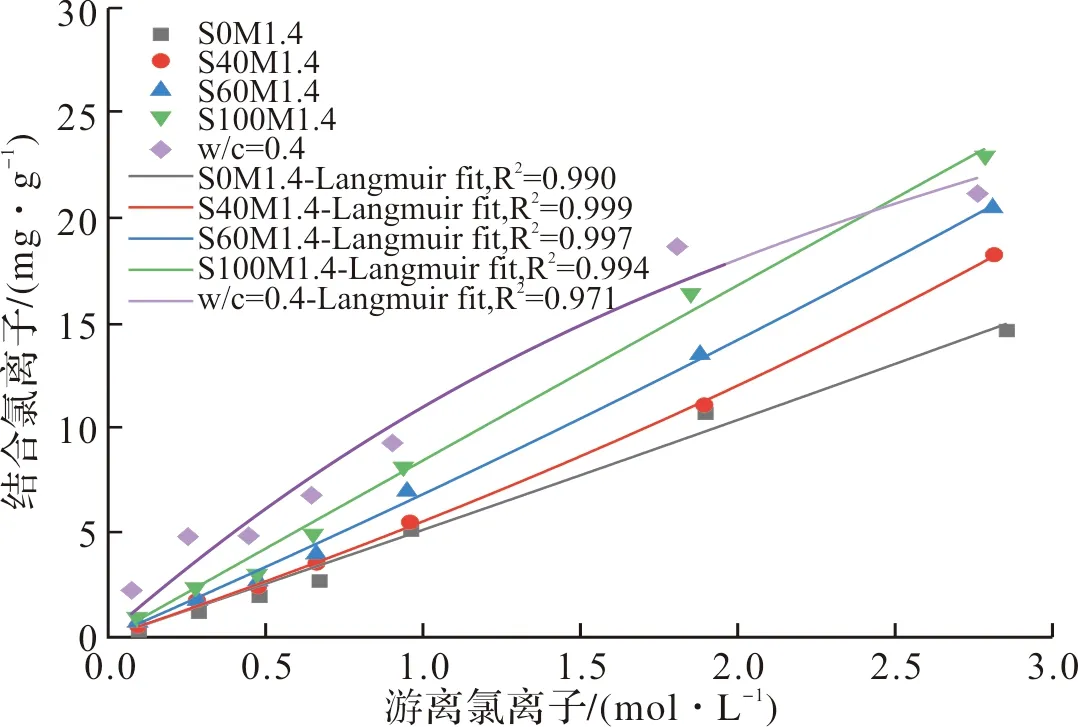
图6 AAMS和PC净浆的Cl-等温吸附曲线Fig.6 Chloride ion binding isotherms adsorption curves of AAMS and PC slurry
由图6可看出,总体上AAMS,包括未掺矿渣的碱激发偏高岭土,对氯离子的固化量显著低于PC净浆.但矿渣掺入对碱激发偏高岭土的固化氯离子能力有较好的提升效果;且随矿渣掺量的增大,固化氯离子的能力不断提高.这是因为矿渣掺入后生成的C-(A)-S-H凝胶在碱性溶液中呈带正电的表面,这意味着可对表面带负电的OH-和Cl-进行物理吸附[11],且C-(A)-S-H的氯离子结合能力随着Ca/Si比的增加而增加,这是由于Ca/Si比的增加提高了C-(A)-S-H凝胶表面的正电位[30];并随着矿渣掺量的增大,生成的C-(A)-S-H凝胶量不断提高,可进一步提高对氯离子的吸附[31].此外,矿渣的掺入可以提高偏高岭土原料的溶解,进而提高碱激发偏高岭土/矿渣复合凝胶体系的反应水平[32],生成更多的N-A-S-H凝胶,而N-A-S-H凝胶与氯离子的物理吸附量的提高有关[33].
在AAMS中,氯离子的固化量主要受到氯离子浓度的影响.较低的[Cl-]/[OH-]比将导致较低的表面电荷密度和较薄的扩散层,从而减少了留存在扩散层中的氯离子量[17],进而影响AAMS固化的氯离子量.另一方面,由图6可看出,虽然在NaCl溶液浓度较低时(<0.7 mol/l),AAMS对氯离子的固化量远低于PC净浆;而在NaCl溶液浓度较高时(>1.0 mol/L),AAMS对氯离子的固化速率大于PC对氯离子的固化速率,且与PC的固化速率逐渐下降相比,AAMS的固化速率随着NaCl溶液浓度的增大而逐渐提高,并在NaCl溶液浓度为2.0~3.0 mol/L之间,AAMS对氯离子的固化量超过了PC净浆.这可能是因为在低NaCl溶液浓度的境况下,PC对氯离子的固化作用有物理吸附与化学结合两种,其中化学结合的氯离子量较大且不容忽视[34];而在高NaCl溶液浓度的境况下,PC对氯离子的物理吸附与化学结合量逐渐达到了饱和.由AAMS对氯离子的固化表现来看,在低NaCl溶液浓度(<0.7 mol/L)的境况下,AAMS对氯离子的固化能力远低于同浓度下PC的氯离子固化量;当NaCl溶液浓度高达1.0 mol/L以上时,AAMS对氯离子的固化量表现出了极大的提升[30].表明AAMS固化氯离子的潜力在高浓度NaCl溶液的境况下得到了充分的体现,这与已有文献[17,35]中的研究结论一致.
图7描绘了AAMS和其在氯化钠溶液中吸附平衡后的XRD衍射图谱.由图7可看出,矿渣掺入后在AAMS的XRD衍射图中检测到了C-S-H(PDF#15-0641)的存在,但峰强较弱.含矿渣的AAMS在氯化钠溶液中浸泡后,由于NaCl等晶体峰型较强C-S-H凝胶在XRD衍射图中难以体现.同时,C-S-H凝胶是碱激发偏高岭土试件中所不具有的,而C-S-H凝胶在水泥净浆中对氯离子的固化发挥了重要作用[20,34],这为矿渣掺入后AAMS固化氯离子能力获得显著提高提供了重要依据.此外,AAMS在氯化钠溶液中浸泡后的矿物相变化较小,未发现Friedel’s盐和其他含氯物相的形成,仅多出了Halite(NaCl, PDF#70-2509)的晶型[35].这表明AAMS对氯离子的固化主要归因于C/N-A-S-H和C-S-H凝胶的物理吸附.多出的Halite晶型意味着C/N-A-S-H凝胶的外表面上可能物理吸附了大量的氯离子[24],这可能是C/N-A-S-H凝胶中的羟基(OH-)基团由Cl-取代所致[11].
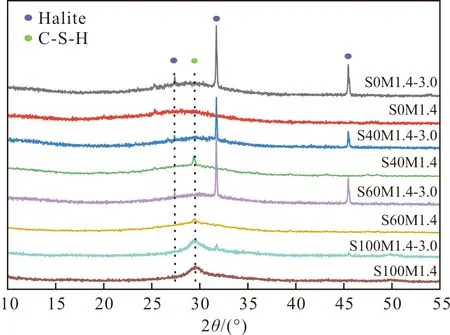
图7 AAMS在氯化钠溶液中吸附前后的XRD图谱Fig.7 XRD patterns of AAMS before and after adsorption in NaCl solution
上述结果表明:AAMS对氯离子的固化能力总体弱于PC净浆,其固化机制主要为C/N-A-S-H和C-S-H凝胶的物理吸附;矿渣的掺入对于AAMS固化氯离子的能力有显著的提升效果;NaCl(>1.0 mol/L)溶液浓度越高,AAMS的固化氯离子能力越强,在NaCl溶液浓度大于1.0 mol/L时,AAMS对氯离子的固化量超过PC净浆.
2.2.3 激发剂模数对氯离子固化能力的影响
图8、9描绘了具有不同激发剂模数的AAMS在氯化钠溶液中吸附平衡后的氯离子固化等温线和XRD衍射图.由图8(a)可见,对于碱激发偏高岭土而言(S0组),激发剂模数较低时,其对氯离子的固化能力较差.这一方面是因为激发剂模数较低时(MS=1.0)会导致碱激发产物凝胶的沸石相转变,进而固化Cl-的凝胶量减少.在含偏高岭土且模数较低(MS=1.0)AAMS的XRD衍射图中检测到了沸石Zeolite X(Na2Al2Si2.5O9·6.2H2O, PDF#38-0237)和八面沸石Faujasite-Na((Na2Ca)0.075(Al0.3Si0.7)O2(H2O), PDF#76-0843)的存在,反映其结晶度较高,生成的这两种沸石相不太可能与氯离子发生化学键结合[36].Zhang and Shi等[37]也发现较低模数的激发剂会导致碱激发产物的沸石相转变.而高模数的AAMS的XRD衍射图中以无定形相为主,未看到明显的沸石晶型.另一方面,模数较低的激发剂碱性较强,碱激发反应后多余的OH-会与Cl-之间产生吸附竞争[11],进而降低对Cl-的固化.上述两方面可能是低模数的碱激发偏高岭土固化氯离子能力较弱的原因.
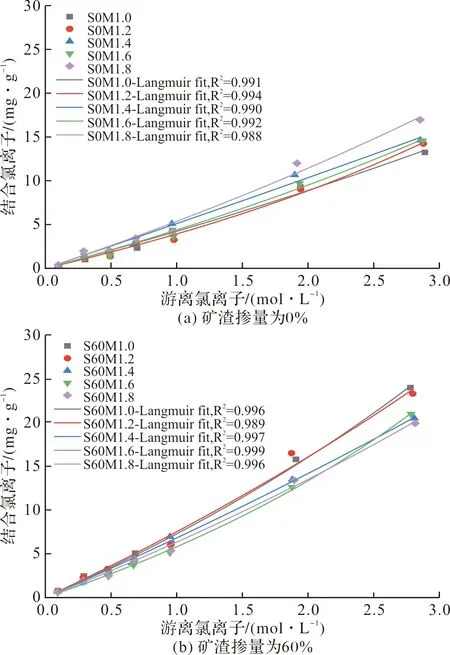
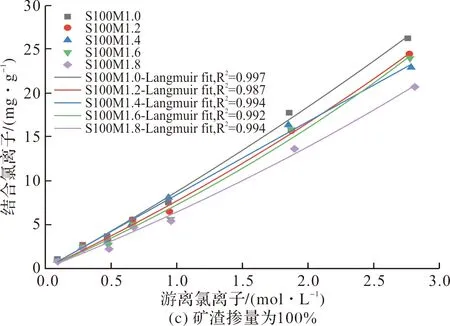
图8 矿渣掺量为不同模数的AAMS的Cl-等温吸附曲线Fig.8 Chloride ion binding isothermal adsorption curves for different modulus of AAMS with slag dosage
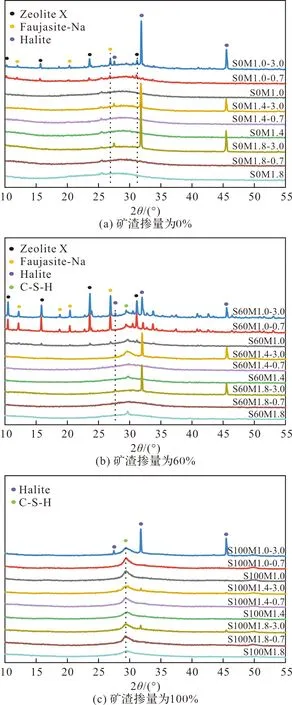
图9 矿渣掺量为不同模数的AAMS在氯化钠溶液中吸附前后的XRD图谱Fig.9 XRD patterns before and after adsorption of different modulus of AAMS in NaCl solution with slag dosage
由图8(b)和(c)可见,对于AAMS而言,激发剂模数较高时,其对氯离子的固化能力较差,且随着矿渣掺量的增大,较低激发剂模数的AAMS固化的氯离子量在不断增大.彭晖等[19]的研究表明,在各矿渣掺量下,碱激发偏高岭土的反应水平均随激发剂模数的增大而降低,同时,矿渣的掺入对于碱激发偏高岭土的反应水平具有促进作用,且在其所用的碱激发条件下,不同矿渣掺量的碱激发偏高岭土/矿渣中的矿渣原料几乎完全参与反应.因此,矿渣掺入和较低的激发剂模数意味着较多的C/N-A-S-H和C-S-H凝胶的生成量,而凝胶量的增加为吸附Cl-提供了更多的接触位点,进而提高了对Cl-的固化量.
2.2.4 激发剂浓度对氯离子固化能力的影响
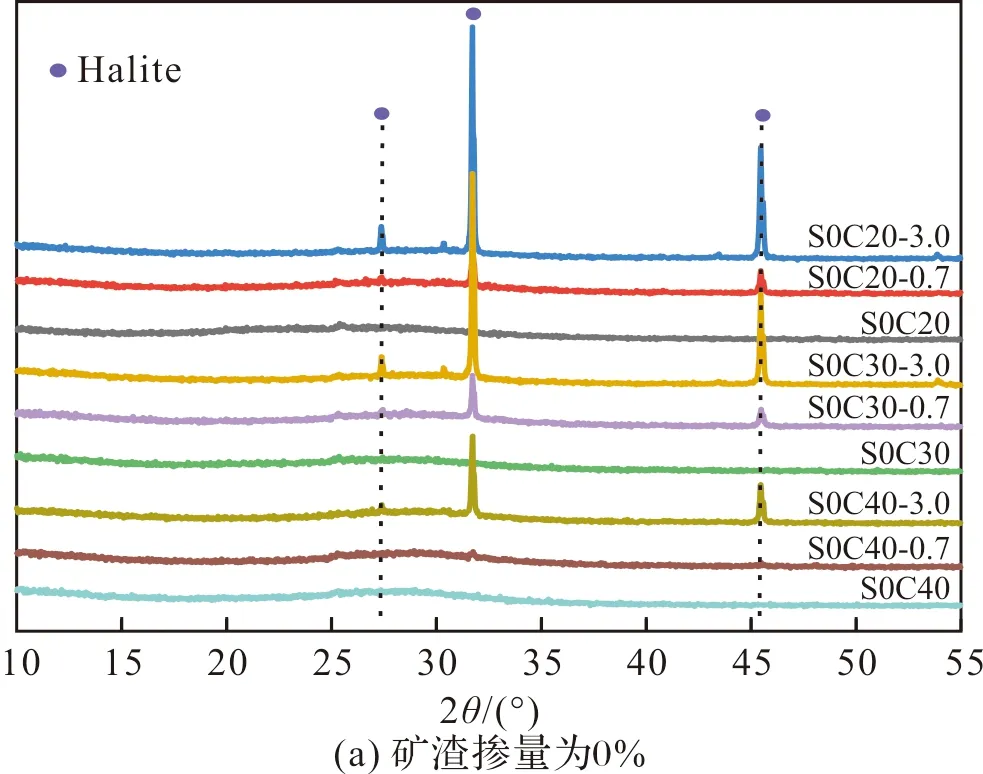
图10、11描绘了具有不同激发剂浓度的AAMS在氯化钠溶液中吸附平衡后的氯离子固化等温线和XRD衍射图.由图10(a)可看出,对于碱激发偏高岭土而言(S0组),激发剂浓度较低(C20和C25)时,其对氯离子的固化能力较好;当激发剂浓度为30%时,碱激发偏高岭土对氯离子的固化效果最差.这可能是在低浓度的碱激发条件下,碱激发偏高岭土的反应水平较低,凝胶产物减少.同时,低浓度的碱激发条件下,孔溶液中的OH-浓度较小,而固化的氯离子量会随着OH-浓度的减少而增加[38].上述结果的出现可能是这二者耦合作用造成的结果.
由图10(b)和(c)可看出,随着矿渣掺量的增大,低浓度的激发剂对AAMS固化氯离子的能力也越好,尤其是S100C20对氯离子的固化能力最好.由图11可看出,浓度为20%的AAMS的XRD图谱中检测到了C-S-H凝胶相的存在,而C-S-H凝胶相未在其他更大浓度的AAMS中检测出来,如前所述,C-S-H凝胶可以提高对氯离子的固化能力.此外,在S100C20-3.0的XRD图谱中检测出了Friedel’s盐(PDF # 42-0558)的存在,表明S100C20对氯离子的固化主要归因于C-S-H凝胶的物理吸附以及Friedel’s盐的化学结合,这可能是S100C20对氯离子固化效果最好的原因之一.在未浸泡氯化钠溶液的S100C20中未能检测出Friedel’s盐的前驱体AFm相,可能是因为碱激发矿渣中的AFm相衍射峰被C-(A)-S-H凝胶衍射峰掩盖所致;Wang和Scrivener[39]以及Bernal等[40]均在研究硅酸钠激发矿渣时通过SEM、EDS、DTA等表征技术确定了AFm相的存在,但是在XRD图谱中AFm相的峰因被无定形的C-S-H凝胶叠加掩盖而难以观察到.当激发剂浓度增大时,未能检测到Friedel’s盐结晶相,这可能是较大的激发剂浓度促使矿渣溶出的Al元素参与C-(A)-S-H凝胶相的形成而不是AFm相的形成,相关机制还需进一步研究.故而,较低浓度(C20和C25)的AAMS对氯离子的固化能力强于较高浓度(C30、C35和C40)的AAMS对氯离子的固化能力.


图10 矿渣掺量为不同浓度的AAMS的Cl-等温吸附曲线Fig.10 Chloride ion binding isothermal adsorption curves for different concentrations of AAMS with slag dosage
3 结论
本文采用等温吸附平衡法和XRD表征方法研究矿渣掺量、激发剂模数以及激发剂浓度对AAMS固化氯离子能力的影响,并与水灰比(w/c)为0.4和0.6的水泥净浆的氯离子固化性能对比,得到以下结论:
(1)相较于线性和Freundlich等温曲线,Langmuir等温线能更好地描述AAMS吸附平衡后的游离氯离子与结合氯离子之间的关系,这应是因为AAMS对氯离子的固化以物理吸附为主.XRD分析结果表明AAMS固化氯离子后没有新的物相生成,证实了AAMS的固化氯离子机制主要是物理吸附;
(2)碱激发偏高岭土的氯离子固化能力较PC差,但矿渣掺入使得AAMS具有较碱激发偏高岭土更强的固化氯离子能力,且随矿渣掺量的增大,对于氯离子的固化能力不断提高.这应是矿渣掺入会形成C-S-H、C-A-S-H凝胶,从而提高了碱激发反应产物对氯离子的物理吸附能力.另一方面,吸附效果受NaCl溶液浓度的影响,尤其对高浓度(>1.0 mol/L)NaCl溶液的吸附更加敏感;
(3)对于碱激发偏高岭土而言,激发剂模数较低时,其对氯离子的固化能力较差.主要归因于低模数的碱激发产物的沸石相转变以及碱激发反应后多余的OH-与Cl-之间的吸附竞争.对于AAMS而言,激发剂模数较高时,其对氯离子的固化能力较差,且随着矿渣掺量的增大,较低激发剂模数的AAMS固化的氯离子量不断增大.这应是矿渣掺入和较低的激发剂模数作用下生成了较多的C/N-A-S-H和C-S-H凝胶,为Cl-的吸附提供了更多的接触位点,进而提高了对Cl-的固化量;
(4)随矿渣掺量的增大,低浓度的激发剂对AAMS固化氯离子的能力也越好,尤其是S100C20对氯离子的固化能力最好.除低浓度的激发剂OH-浓度较低的原因外,还归因于在XRD中检测到低浓度(C20)的AAMS的C-S-H凝胶相(可对氯离子进行物理吸附)以及S100C20-3.0的Friedel’s盐(可对氯离子进行化学结合)的存在,这二者对于AAMS固化氯离子的能力起主要作用.

