1株优良酿酒酵母的分离鉴定及特性分析
陈秀秀,孙洪浩,孙小涵,吕福军
(辽宁波尔莱特农牧实业有限公司,辽宁沈阳 110000)
酵母饲料是利用活性酵母菌的新陈代谢和繁殖菌体,经过发酵和干燥等特殊工艺制成的含有活菌和酵母细胞代谢产物的安全、无污染、无抗药性的优质饲料。目前可用作饲料微生态制剂的酵母菌主要为酿酒酵母(Saccharomyces cerevisiae)和 产 朊 假 丝 酵 母(Candida utilis)。其中,酿酒酵母在饲料生产中获得了广泛的研究和应用。李秀丽等[1]研究发现,饲料中添加酿酒酵母复合物可提高肉牛日增重和饲料表观消化率。王斌星等[2]研究发现,饲料中添加酿酒酵母发酵液可显著提高断奶仔猪生长性能,能够促进小肠发育,提高小肠黏膜免疫功能,可达到与抗生素相当的效果。孙喆等[3]研究表明,饲料中添加酿酒酵母培养物可改善肉仔鸡的生长性能,提高肉仔鸡的免疫功能。
酿酒酵母为单细胞微生物,属于真菌类,是兼性厌氧菌[4]。酵母细胞富含营养物质,包括氨基酸、矿物质、维生素以及硒、铬、铁、锌等微量元素。酵母细胞壁的主要成分为β-葡聚糖和甘露寡糖,酵母细胞中还富含多种消化酶,如蛋白酶、淀粉酶、纤维素酶和植酸酶等[5-7]。此外,酵母细胞代谢产物包含多种化合物,如酯类、高级醇类、有机酸类、酚类和脂肪酸衍生物等[8-9]。酿酒酵母类产品能够有效改善动物消化道微生态平衡,提高机体免疫力,增强抗氧化能力,提高饲料消化率,增强饲料适口性,提高动物生产性能[10-13]。本研究以酿酒酵母PL-J的产气能力、耐高糖、耐低pH值、抑菌性、热稳定性和耐胆盐能力为指标,对酿酒酵母PL-J的特性进行评价,旨在为其在饲料生产中的应用提供参考。
1 材料与方法
1.1 试验材料
蜂蜜来自沈阳自养蜂场。麦芽汁培养基、麦芽汁琼脂培养基购自青岛海博生物技术有限公司;细菌基因组提取试剂盒购自北京天根生化科技有限公司。
1.2 菌株分离鉴定
1.2.1 分离纯化
(1)富集培养:精确称量1 mL样品,置于50 mL麦芽汁培养基中,30℃200 r/min恒温振荡培养24 h,划线于麦芽汁琼脂平板,30℃倒置培养48 h。
(2)纯化培养:挑取疑似单菌落划线于麦芽汁琼脂培养基平板,30℃倒置培养24 h,重复3次以上平板划线,分离纯化的菌株-80℃保存。
1.2.2 形态观察与序列鉴定
(1)形态学观察:挑取疑似单菌落进行美蓝染色,观察真菌形态及出芽形成状态。
(2)序列鉴定:细菌基因组提取试剂盒提取细菌总DNA,引 物NL1:5'-GCATATCAATAAGCGGAGGAAAAG-3'和NL4:5'-GGTCCGTGTTTCAAG-ACGG-3'进行PCR扩增。
26S rDNA的PCR扩增体系(30μL):Super Mix 15μL、上游引物1μL、下游引物1μL、模板DNA 1μL、ddH2O 12μL。
PCR反应程序:96℃5 min;96℃20 s,56℃20 s,72℃30 s,35个循环;72℃10 min,16℃保存。
PCR产物经1%琼脂糖凝胶电泳后,将有目的条带的PCR产物送至北京六合华大基因科技有限公司进行测序。
将所得序列与Genbank中序列进行Blast分析比较,以26S rDNA基因序列同源性A>99%为鉴定标准,采用MEGA6.0软件构建系统发育树。
1.3 酿酒酵母PL-J的培养
酿酒酵母PL-J活化后接种于麦芽汁种子培养基,30℃200 r/min培养18 h,按3%接种量转接至发酵培养基,30℃200 r/min培养24 h,培养期间每隔2 h取一次样,测定660 nm处吸光度值及pH值,绘制24 h生长曲线及pH值曲线。
1.4 产气能力鉴定
采用杜氏管发酵法,取1 mL酵母菌发酵液加入有杜氏小管的9 mL麦芽汁培养液,30℃恒温静置培养,定时观察酵母菌株产气情况。结果记为“+”“++”“+++”“++++”,分别表示产气达到杜氏小管的1/4、1/2、3/4、全部。
1.5 高糖耐受性试验
菌种活化后按3%接种量分别加入含有葡萄糖浓度在100、200、300、400、500、600和700 g/L的麦芽汁培养基中,对照组(NC)为正常培养基,30℃200 r/min培养24 h,取发酵液按10倍逐级稀释至所需稀释度,选取2个适当稀释度,每个稀释度3个重复,吸取不同稀释度菌悬液100μL,涂布于麦芽汁琼脂平板培养,30℃培养24 h后计数。
1.6 耐低pH值试验
菌种活化后按3%接种量分别加入pH值为1.0、1.5、2.0、2.5、3.0、4.0和5.0的麦芽汁培养基中,NC组为培养基自然pH值,30℃200 r/min培养24 h,取发酵液按10倍逐级稀释至所需稀释度,选取2个适当稀释度,每个稀释度3个重复,吸取不同稀释度菌悬液100μL,涂布于麦芽汁琼脂平板培养,30℃培养24 h后计数。
1.7 抑菌活性
取发酵液10 000 r/min下离心5 min,取上清液,过滤。调整指示菌大肠杆菌和金黄色葡萄球菌细菌浓度吸光值约为0.05,试验组为4 mL指示菌液加1 mL试验菌液;对照组(NC)为4 mL指示菌液加1 mL生理盐水,测定初始吸光度。两组37℃200 r/min充分振荡共培养3 h,分别测定各试管液体在600 nm处吸光度值,计算抑菌率。
式中:A空为对照组振荡培养3 h后的吸光度;A空0为对照组初始的吸光度;A样为试验组振荡培养3 h后的吸光度;A样0为试验组初始的吸光度。
1.8 高温耐受性试验
菌种活化后按3%接种量接种于麦芽汁培养基中,分别于37、45、50和55℃过夜培养,NC组30℃培养。按10倍逐级稀释至所需稀释度,选取2个适当稀释度,每个稀释度3个重复,吸取不同稀释度菌悬液100μL,涂布于麦芽汁琼脂平板培养,30℃培养24 h后计数。
1.9 耐胆盐试验
菌种活化后按3%接种量加入含有0.03%、0.10%、0.30%、0.50%和1.00%胆盐浓度的麦芽汁培养液中,NC组为正常培养基。30℃200 r/min培养24 h后,取发酵液按10倍逐级稀释至所需稀释度,选取2个适当稀释度,每个稀释度3个重复,吸取不同稀释度菌悬液100μL,涂布于麦芽汁琼脂平板培养,30℃培养24 h后计数。
1.10 20 L发酵罐放大培养
酿酒酵母PL-J接种于麦芽汁种子培养基中,30℃200 r/min下培养18 h,获得种子液;按3%接种量转接至10 L发酵培养基,发酵条件为30℃、转速150~400 r/min、通气量为0.12~0.50 m3/h条件下,于20 L发酵罐中培养16 h制得发酵液,采用平板计数法记录菌数。
1.11 数据统计与分析
试验数据采用SPSS 17.0软件进行统计学处理,参数组间比较采用t检验。结果以“平均值±标准差”表示。
2 结果与分析
2.1 酵母菌株PL-J的菌落形态(见图1)
由图1可知,酿酒酵母PL-J菌落呈圆形凸起且边缘整齐,乳白色,出芽生殖。
2.2 酿酒酵母PL-J的26S rDNA系统发育树(见图2)
将所得序列与Genbank中序列进行Blast分析比较,以26S rDNA基因序列同源性A>99%为鉴定标准,采用MEGA6.0软件构建系统发育树,见图2。
由图2可知,该菌PL-J与NCBI公布的酿酒酵母的同源性达到100%,将该分离菌鉴定为酿酒酵母。将酿酒酵母PL-J保藏在中国普通微生物菌种保藏管理中心,保藏号:CGMCC No.24059。
2.3 酵母菌株PL-J的生长曲线及pH值曲线(见图3)
由图3可知,PL-J菌株在6 h进入对数生长期,18 h进入平台期;pH值在24 h时由最初的6.02降至3.88,表明酿酒酵母PL-J在发酵过程中产有机酸。
2.4 酿酒酵母PL-J的产气能力试验结果(见表1)
由表1可知,PL-J发酵17 h后产气达到满管,菌株发酵周期较短。
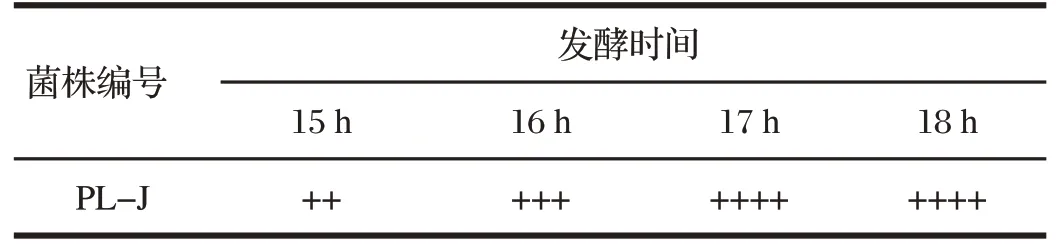
表1 酿酒酵母PL-J的产气能力试验结果Tab.1 Results of gas production capacity of Saccharomycescerevisiae PL-J
2.5 酿酒酵母PL-J的高糖耐受性试验结果(见表2)
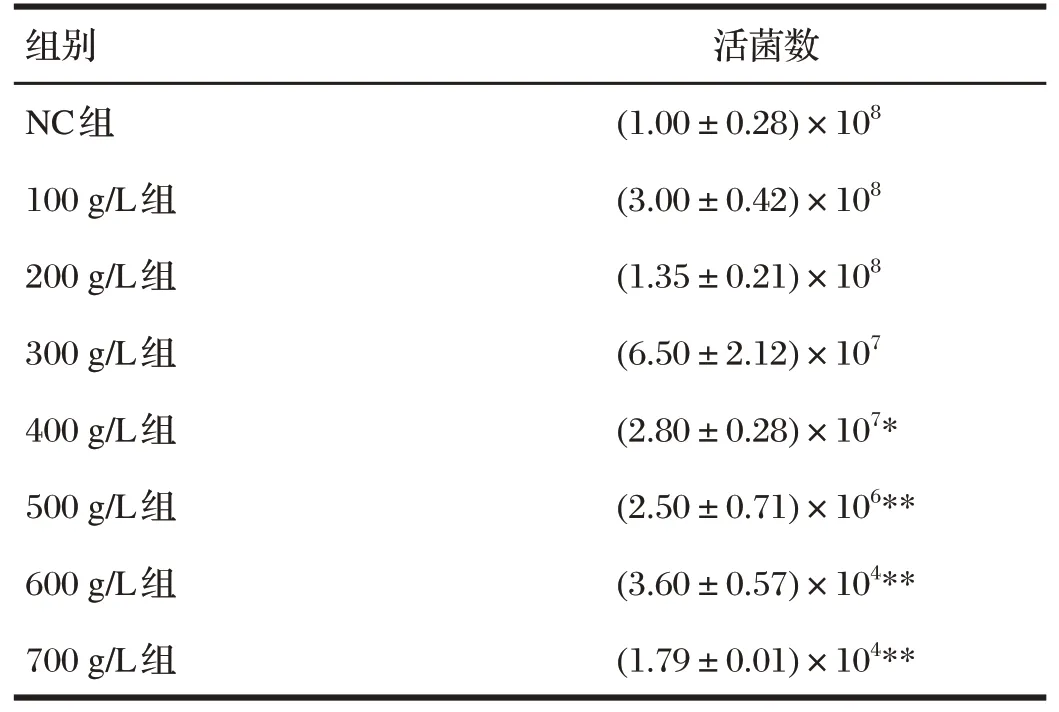
表2 酿酒酵母PL-J的高糖耐受性试验结果Tab.2 Result of glucose tolerance of Saccharomycescerevisiae PL-J单位:CFU/mL
由表2可知,与NC组相比,葡萄糖浓度100~300 g/L的3组活菌数差异均不显著(P>0.05);400 g/L组活菌数显著降低(P<0.05),500 g/L组、600 g/L组和700 g/L组活菌数均极显著降低(P<0.01)。其中葡萄糖浓度700 g/L组活菌数最低,为1.79×104CFU/mL。
2.6 酿酒酵母PL-J的耐低pH值试验结果(见表3)
由表3可知,与NC组相比,pH值3.0~5.0各组的活菌数差异不显著(P>0.05),pH值1.0、1.5、2.0、2.5时活菌数极均显著降低(P<0.01)。其中pH值为1.0时活菌数最低,为1.40×104CFU/mL。

表3 酿酒酵母PL-J的耐低pH值试验结果Tab.3 Result of low pH tolerance of Saccharomycescerevisiae PL-J单位:CFU/mL
2.7 酿酒酵母PL-J的抑菌活性(见表4)
由表4可知,PL-J菌株对共培养的大肠杆菌和金黄色葡萄球菌的抑菌率分别是57.3%和68.4%,均超过50%。

表4 酿酒酵母PL-J的抑菌活性Tab.4 Inhibitory activity of Saccharomycescerevisiae PL-J单位:%
2.8 酿酒酵母PL-J的高温耐受性试验结果(见表5)
由表5可知,酿酒酵母PL-J在37~50℃范围内均可生长,55℃时活菌数为0。

表5 酿酒酵母PL-J的高温耐受性试验结果Tab.5 Result of thermal stability of Saccharomycescerevisiae PL-J单位:CFU/mL
与NC组相比,温度为37℃时活菌数差异不显著(P>0.05),45、50℃时活菌数均极显著降低(P<0.01),其中以50℃时最低,为2.67×106CFU/mL。
2.9 酿酒酵母PL-J的耐胆盐试验结果(见表6)
由表6可知,与NC组相比,胆盐浓度为1.00%时,活菌数显著下降(P<0.05);胆盐浓度在0.03%~0.50%范围内时,酿酒酵母PL-J活菌数差异均不显著(P>0.05),表明在此胆盐浓度范围内时,酿酒酵母PL-J完全耐受。
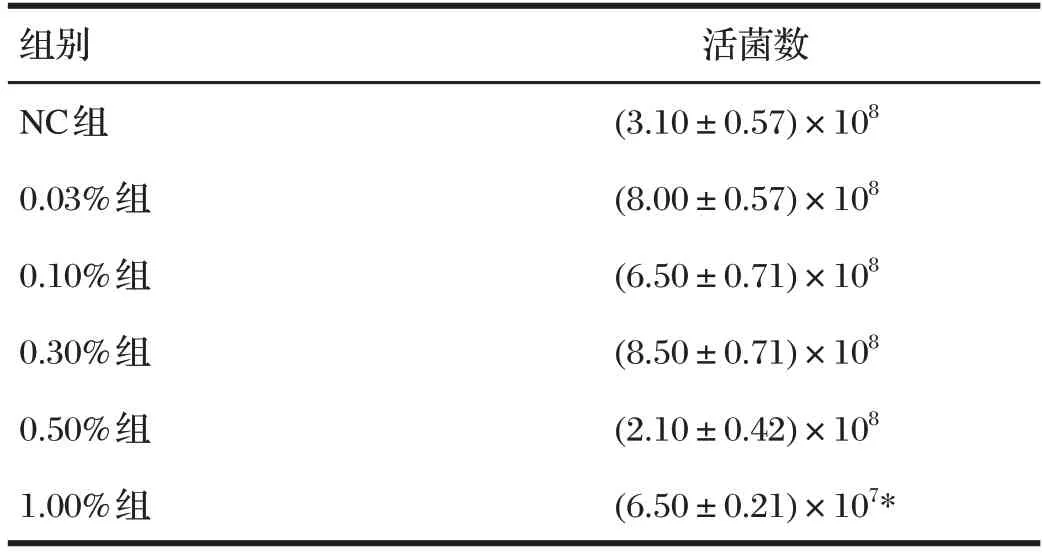
表6 酿酒酵母PL-J的耐胆盐试验结果Tab.6 Result of bile tolerance of Saccharomycescerevisiae PL-J单位:CFU/mL
2.10 酿酒酵母PL-J 20 L罐放大培养最优参数(见表7)
酿酒酵母PL-J 20 L罐放大培养的最优参数见表7;发酵结束后,采用平板计数法计菌数,结果显示,菌量可达到2.0×109CFU/mL。

表7 酿酒酵母PL-J 20 L罐放大培养最优参数Tab.7 Optimum parameters of amplification culture in 20 L fermentor of Saccharomycescerevisiae PL-J
3 讨论
酵母菌除具有优良的天然特性外,还具有耐酸和耐高糖等高抗逆性。酵母菌耐酸以及可生长pH值范围较宽的特性是在动物消化道内起作用的前提。因此,耐酸酵母菌在饲用酵母的应用方面具有一定优势。本研究中,耐低pH值试验结果表明,酿酒酵母PL-J适应pH值范围广,在pH值1~5的条件下均可生长。Vilela等[14]研究发现,酿酒酵母在pH值2.0~5.0之间的条件下均可生长,与本研究结果基本相似。
高浓度糖导致的高渗压力是酿酒酵母生产中常遇到的问题,筛选耐高糖的酵母对生产具有重要价值。本研究结果显示,酿酒酵母PL-J可以在葡萄糖含量100~700 g/L条件下生长。薛军侠等[15]研究表明,14株野生酿酒酵母菌可耐受50%葡萄糖浓度不耐受60%葡萄糖浓度。薛梅等[16]研究表明,甜高粱酿酒酵母菌可在葡萄糖浓度为700 g/L的条件下生长,800 g/L条件下不生长,与本试验结果基本一致。
因饲料加工过程中需要高温制粒,选育耐高温酵母菌对于在饲料工业中应用酵母类产品具有一定意义。大量研究结果表明,多数酵母菌种最高耐受温度为45℃,在50℃条件下基本不生长[17-19]。本研究中的高温耐受性试验结果表明,酿酒酵母PL-J经过50℃处理后,仍有106CFU/mL活菌。酵母菌的抑菌活性是通过代谢产物如乙醇、乳酸、亚硫酸盐等具有杀菌作用的小分子物质以及肽类、吡嗪衍生物类和未知抗生素、杀菌素糖蛋白而产生的[20-22]。本研究以大肠杆菌和金黄色葡萄球菌作为指示菌,结果显示,PL-J菌株对共培养的大肠杆菌和金黄色葡萄球菌的抑菌率分别是57.3%和68.4%,说明酿酒酵母PL-J具有一定的抑菌作用。
益生菌是先通过胃酸环境后进入小肠,在肠内发挥益生作用,小肠中胆盐对菌体产生抑制作用。小肠内胆盐浓度范围是0.03%~0.30%,是影响菌株存活率的重要因素。在本研究中胆盐浓度在0.03%~0.50%范围内,酿酒酵母PL-J活菌数与NC组相比差异不显著,表明在此胆盐范围内酿酒酵母PL-J完全耐受。
4 结论
酿酒酵母PL-J具有良好的热稳定性和产气能力,耐高糖、耐低pH值、耐胆盐,可为后续的应用如发酵饲料提供优良的菌种来源。

