作物根系活力检测方法改进与优化
周欢 刘昌森 周辰炎 范良苗 唐凡 胡欣朦 王佩玉 徐建明 杨文杰


摘要:通过试验条件的优化,建立一种植物根系活力的批量快速检测方法。以小麦、黄瓜以及玉米根系为试验材料,针对乙酸乙酯-甲醇混合液配比、浸提温度及浸提时间3个因素设计正交试验,优化根系活力的检测条件。结果表明,在试验影响因素中,影响程度从大到小依次为浸提温度>乙酸乙酯-甲醇混合液配比>浸提时间。浸提液中乙酸乙酯与甲醇的比例为2 ∶1,浸提温度为60 ℃,浸提时间为20 min,三苯基甲臜提取率最高。本研究提出的植物根系活力的最佳浸提方案,具有三苯基甲臜的浸出效率高、重现性好、操作简便等特点,此法更适合批量样本根系活力的快速检测。
關键词:根系活力;氯化三苯基四氮唑法;三苯基甲臜提取率;快速热浸提法;正交试验
中图分类号:S311 文献标志码: A
文章编号:1002-1302(2022)09-0191-04
植物根系十分庞大,能够适应自然而不断进化发展,不但具有吸收水分和无机盐及固定植株的功能,而且对输导、合成、储藏和转化多种有机物质有关键的作用[1]。根系活力是一个表征植物根系的重要生理参数[2],能够表明植物根系的吸收与合成能力,其强弱是制约作物生长发育、产量形成以及肥料利用率等生理指标的关键因素[3]。因此,建立一种快速、简便的根系活力检测方法,对于大批量样本根系活力的快速检测具有较为重要的实践意义。目前,根系活力的检测有多种方法,比如氯化三苯基四氮唑法[4]、α-奈胺法[5]、根系伤流法[3]、甲烯蓝法[6]等。对比之下,氯化三苯基四氮唑法检测根系活力具有快速简便、结果准确且重现性好等特点,由此得到最为广泛的应用[7]。对于传统的研磨法,由于需要研磨、冲洗、过滤、定容等步骤,操作较为繁琐,耗时较长,不利于大批量样本根系活力的检测。同时,由于研磨、过滤等环节,往往导致三苯基甲臜的损失,致使样本中三苯基甲臜的提取率降低,从而影响试验结果的可靠性。此外,对于已报道的浸提法,虽然避免了传统研磨法操作繁琐、提取率较低的缺点,但三苯基甲臜的提取过程一般需要4~6 h或更长的时间,而且单一的甲醇或二甲基亚砜提取液对三苯基甲臜的提取效率尚不令人满意。因此,有必要对植物根系活力检测方案进行进一步的优化和改进,以期获得更高效、更便捷的根系活力检测方法。针对现有技术中存在的问题,针对浸提液配比、浸提温度及浸提时间3个影响因素,通过正交试验优化根系活力的检测条件,建立一种简便高效的植物根系活力的检测方法。
1 材料与方法
1.1 试验材料、试剂与仪器
小麦品种淮麦33、黄瓜品种津研4号及玉米品种苏玉31均由江苏徐淮地区淮阴农业科学研究所提供。所有试剂均为国药分析纯。主要仪器:TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司)、生化培养箱(上海一恒科学仪器有限公司)。
1.2 试验方法
1.2.1 不同浸提液对三苯基甲臜提取率的比较 分别称取小麦、黄瓜及玉米的根尖样品0.5 g,清洗干净并吸干表面水分,利用氯化三苯基四氮唑方法[8-9]检测各样品材料的根系活力,三苯基甲臜的提取分别以甲醇、二甲基亚砜、乙酸乙酯及乙酸乙酯-甲醇混合液(体积比1 ∶1)为浸提液,37 ℃浸提6 h,并分别以不同样品及相应浸提液充分提取(根尖样品变为白色)的三苯基甲臜的含量作为对照。
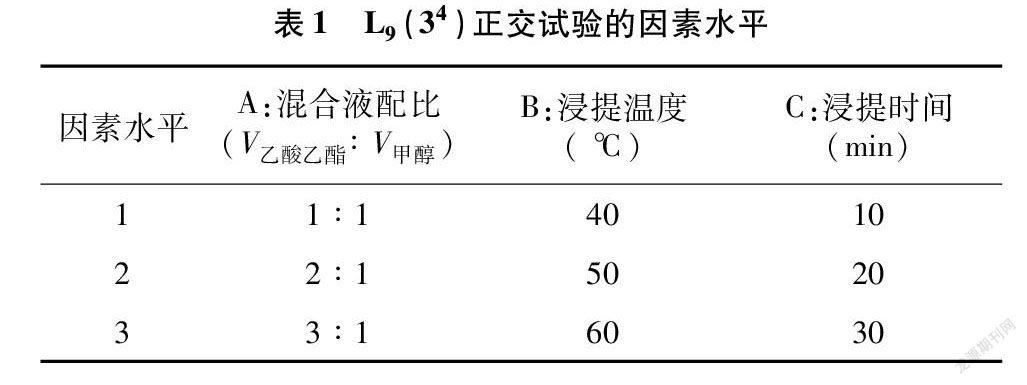
1.2.2 正交试验设计 采用L 9(34)正交试验,以小麦、黄瓜以及玉米根系为试验材料,优化浸提方案,具体因素水平见表1。将混合液配比(A)、浸提温度(B)、浸提时间(C)3个因素分为9组,每组重复3次。
1.2.3 三苯基甲臜的提取 第1步:绘制氯化三苯基四氮唑标准曲线。首先,取0.4% 氯化三苯基四氮唑溶液0.2 mL,并放入少许保险粉置于容量瓶中,充分摇匀后可产生红色且不溶于水的三苯基甲臜,然后用乙酸乙酯进行定容至10 mL。其次,找5个不同的10 mL容量瓶,并取上述溶液0.25、0.50、1.00、1.50、2.00 mL放置其中,用乙酸乙酯进行定容得到标准液,其三苯基甲臜含量分别为25、50、100、150、200 μg。最后,以空白为对照,记录485 nm波长下的吸光度(D 485 nm),绘制氯化三苯基四氮唑标准曲线。横坐标为标准液中的三苯基甲臜含量,纵坐标为吸光度。
第2步:根系处理。称取根尖样本0.5 g,冲洗干净后用吸水纸吸干根尖样本表面的水分。然后将5 mL 0.4% 氯化三苯基四氮唑溶液和5 mL 1/15 mol/L 磷酸缓冲液(pH值7.0)置于10 mL小烧杯中,使样本在37 ℃恒温箱、暗处理条件下充分反应,1 h后立即加入1 mol/L硫酸2 mL,终止反应。上述操作重复进行5次。空白对照组,除先加入 1 mol/L 硫酸2 mL,后加入根系以外,其他操作步骤与上述相同。
第3步:快速热浸提。将已显色的根系分别转入盛有甲醇、二甲基亚砜、乙酸乙酯及乙酸乙酯-甲醇混合液(体积比1 ∶1)的10 mL刻度试管中。将上述刻度试管置于37 ℃水浴锅中浸提6 h后,用与之相对应的浸提液再次定容。
第4步:数据整理。以空白试验为对照,485 nm波长下检测吸光度,根据上述所作的标准曲线,代入线性回归方程,计算出氯化三苯基四氮唑的还原量(mg)。再根据公式:氯化三苯基四氮唑还原强度[mg/(g·h)]=氯化三苯基四氮唑还原量(mg)/[根鲜质量(g)×时间(h)],求出其氯化三苯基四氮唑还原强度。与空白试验相比,求出不同浸提液对三苯基甲臜的提取率。然后,针对乙酸乙酯-甲醇混合液配比、浸提温度及浸提时间3个因素设计正交试验(表1),优化浸提最佳方案。最后,采用最佳浸提方案比较甲醇、二甲基亚砜、乙酸乙酯、乙酸乙酯-甲醇混合液的提取率。
2 结果与分析
2.1 不同浸提液中三苯基甲臜吸收光谱的比较
分别对甲醇、二甲基亚砜、乙酸乙酯及乙酸乙酯-甲醇混合液等4种不同试剂的三苯基甲臜溶液,在400~600 nm的波长范围内进行光谱扫描,获得并比较4种浸提液的吸收光谱曲线(图1)。从各浸提液的吸收光谱可见,以上试验所用各溶剂的吸收光谱的最大吸收峰均在485 nm。因此,可以通过分光光度法在波长485 nm下对以上各浸提液的三苯基甲臜溶液进行比色测定。
2.2 不同浸提液的三苯基甲臜提取率比较
由表2可知,在小麦和黄瓜供试根系样本中,二甲基亚砜对三苯基甲臜提取率均显著高于甲醇(P<0.05)。在玉米供试根系样本中,二甲基亞砜对三苯基甲臜提取率显著高于乙酸乙酯(P<0.05)。而乙酸乙酯-甲醇混合液对3种供试根系样本的三苯基甲臜提取率均显著高于其他单一浸提液(P<0.05)。
2.3 正交设计试验结果
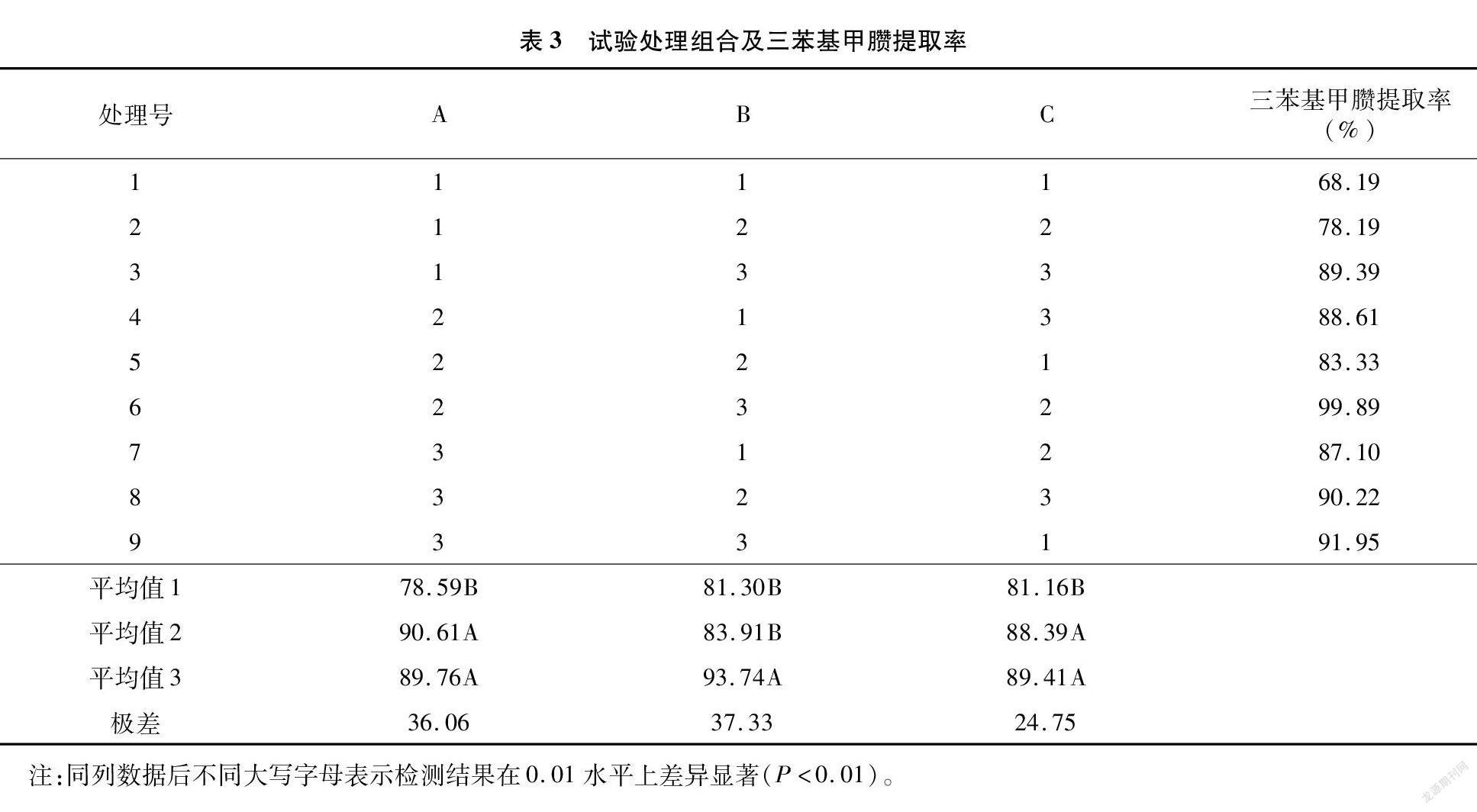
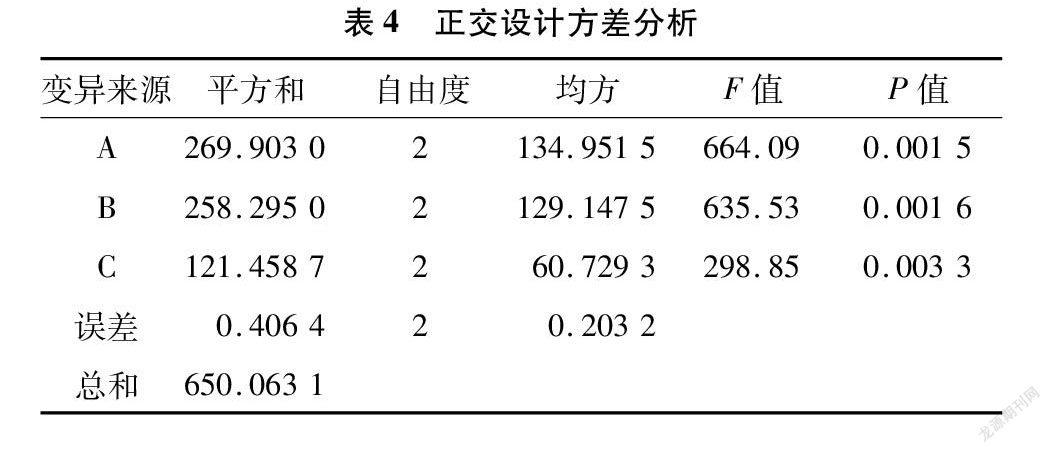
由表3可以看出,B因素极差最大,其次为A因素和C因素。由正交设计方差分析(表4)可知,A因素、B因素和C因素的不同水平之间差异极显著(P<0.01)。结合表3和表4可知,3个因素对三苯基甲臜的提取率均有显著影响,其影响程度顺序从大到小依次为B>A>C,主要因素B取最好的水平3,而其他因素则根据时间、成本等方面综合考虑选取适当水平。由此得到最佳浸提方案组合为A 2B 3C 2,即浸提液混合配比为2 ∶1、浸提温度为 60 ℃、浸提时间为20 min,此时三苯基甲臜提取效果最佳。
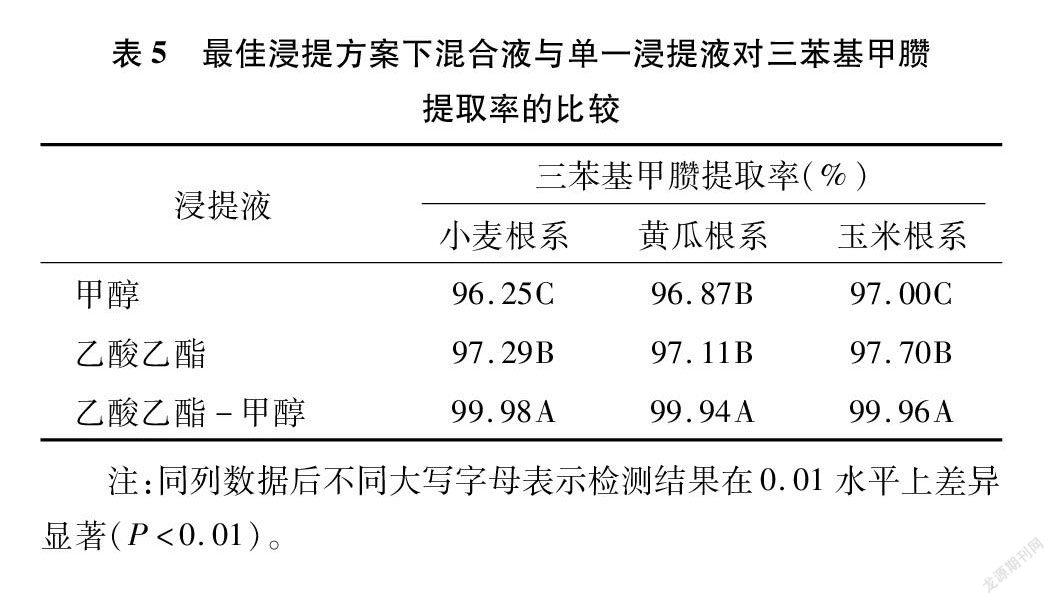
2.4 最佳浸提方案下不同浸提液对三苯基甲臜提取率的比较
在最佳浸提方案处理下,进一步对混合浸提液与单一浸提液对三苯基甲臜的提取率进行了比较研究,结果显示,乙酸乙酯-甲醇混合液提取三苯基甲臜的效果极显著优于单一浸提液(P<0.01)(表5)。
3 讨论与结论
传统的乙酸乙酯研磨法是一种广泛应用于科研和教学试验的根系活力检测方法[4],但此法操作环节多且繁琐,耗时较长,同时,研磨、过滤等环节又极易造成试验误差,从而导致检测结果的偏离。研究表明,利用有机溶剂浸泡处理过的根尖样本,对三苯基甲臜提取显示出了较大的优势[10]。在此基础上,前人对2-甲氧乙醇、乙酸乙酯、甲醇及二甲基亚砜等不同试剂的浸提效果进行了比较研究[8-10]。本试验从2020年6月开始,在江苏省淮安市丁集镇和袁集乡开展田间试验,2021年4月正式结束。研究结果显示,乙酸乙酯-甲醇混合液的浸提效果显著优于单一的浸提液。究其原因,可能是由于甲醇较强的组织细胞穿透力与乙酸乙酯较高的三苯基甲臜溶解度的有机结合和协同作用,显著提高了样本中三苯基甲臜的溶出率。
虽然浸提法较好地避免了传统研磨法中繁琐的操作环节,但浸提时间一般都在6 h以上,检测效率不够理想,这一缺陷在大批量样本根系活力的检测中表现的更为突出。由于三苯基甲臜较为稳定,因此,在一定范围内提高浸提的温度,可以加快对三苯基甲臜的提取[11]。本研究利用正交设计对乙酸乙酯-甲醇混合液浸提法检测根系活力的条件进行了优化,通过小麦、黄瓜和玉米等试验材料的比较研究,建立了一种根系活力的快速热浸提法,此法具有高效快速、重现性好、操作简便等优点,更利于大批量样本根系活力的检测。这对于根系活力的相关研究及教学试验的开展都具有非常重要的作用[2]。但其可靠性尚需在更为广泛的科研实践中加以验证。此外,本试验只针对乙酸乙酯-甲醇混合液进行了浸提条件的优化研究,其他混合浸提液对三苯基甲臜的浸提效果尚有待进一步探究。
为了优化浸提法根系活力的检测条件,首先,通过4种浸提液对三苯基甲臜提取效率的比较研究显示,乙酸乙酯-甲醇混合液提取率最高。在此基础上,利用正交试验设计,进一步针对混合液配比、浸提温度及浸提时间3个影响因素对浸提方案进行了优化。结果显示,以上3个因素对根系三苯基甲臜的提取均有极显著影响(P<0.01),而且在乙酸乙酯-甲醇混合液配比为2 ∶1、浸提温度为60 ℃的条件下浸提20 min时,三苯基甲臜提取率最高。由此,建立了一种快速热浸提方法,以克服无法进行大批量样本检测的缺点。
参考文献:
[1]王 宁,田晓莉,段留生,等. 缩节胺浸种提高棉花幼苗根系活力中的活性氧代谢[J]. 作物学报,2014,40(7):1220-1226.
[2]朱秀云,梁 梦,马 玉. 根系活力的测定(TTC法)实验综述报告[J]. 广东化工,2020,47(6):211-212.
[3]郭士伟,夏士健,朱虹霞,等. 水稻根系活力测定方法及超级稻两优培九生育后期根系活力研究[J]. 土壤,2012,44(2):308-311.
[4]张 雄. 用“TTC”法(红四氮唑)测定小麦根和花粉的活力及其应用[J]. 植物生理学通讯,1982(3):48-50.
[5]张成良,姜 伟,肖叶青,等. 水稻根系研究现状与展望[J]. 江西农业学报,2006,18(5):23-27.
[6]王云礼,陈香艳,唐洪杰.不同玉米品种的根系活力与产量性状关系的初步研究[J]. 农业科技通讯,2015(4):68-72.
[7]李德华,贺立源,刘武定. 玉米根系活力与耐铝性的关系[J]. 中国农学通报,2004,20(1):161-164.
[8]白宝璋,金锦子,白 崧,等. 玉米根系活力TTC测定法的改良[J]. 玉米科学,1994,2(4):44-47.
[9]郑 坚,陈秋夏,金 川,等. 不同TTC法测定枫香等阔叶树容器苗根系活力探讨[J]. 浙江农业科学,2008,49(1):39-42.
[10]白宝璋,陈凤云,付菊华. 向日葵根系活力TTC测定法的改良[J]. 中国油料,1988(3):57-60.
[11]姚 黎,杨重法,王玲蕊.温度对甜瓜根系物质积累分配及其吸收能力的影响[J]. 北方园艺,2019(23):57-62.

