不同药剂对宁夏葡萄霜霉病田间药效及对葡萄果面微生物群落的影响
杨波 姜彩鸽 宋双 张华普 张怡



摘要:为筛选对宁夏葡萄霜霉病防治有效、环境友好型的药剂以及明确施药后葡萄果面微生物群落的结构,采用田间药效试验和Illumina高通量测序的方法,比较7种药剂对葡萄霜霉病的田间防效及施药后葡萄果面真菌和细菌群落组成、结构以及多样性。结果表明,7种药剂中47%春雷王铜对葡萄霜霉病的防治效果最好,在调查的3个时间段中,防效均在82.17%~91.56%之间,其次防效较好的是生物源农药0.3%苦参碱,防效均在80%以上。不同药剂处理后葡萄果面微生物的优势属种主要有枝孢属、链格孢属、线黑粉酵母属、马赛菌属和鞘氨醇单胞菌属等,但各处理间微生物的丰富度、多样性、均匀度、结构相似性存在明显差异,微生物物种多样性较高、分布均匀的组分别为EU组和PO组,而微生物丰度较高的组分别为PO组和BS组;基于加权UniFrac距离矩阵的主坐标分析(PCoA)发现PO组、PF组和MA组之间真菌群落结构组成相似,而细菌群落组成结构相似的组分别为KC组、EU组和CK组。通过对不同药剂的田间防效及施药后葡萄果面微生物群落结构和多样性的初步研究,对微生物群落结构、种类和多样性有了一定的了解,为防治宁夏葡萄霜霉病提供了理论依据,及揭示施药后葡萄果面微生物多样性,提高葡萄酒品质提供了理论支持。
关键词:葡萄;葡萄霜霉病;药剂筛选;微生物多样性;主坐标分析
中图分类号:S436.631.1+9 文献标志码: A
文章编号:1002-1302(2022)09-0103-08
葡萄霜霉病 (grape downy mildew)是由葡萄生单轴霜霉(Plasmopara viticola)引起的一种世界性专性寄生病害,各葡萄产区均有发生,严重危害葡萄产量和品质[1-2],制约着葡萄产业高质量、可持续发展。宁夏回族自治区(简称宁夏)因独特的地理位置及适宜葡萄生长的气候特点,被公认为是我国酿酒葡萄的最佳产地[3]。随着宁夏葡萄酒产业的欣欣发展,葡萄种植面积也在逐年增加,葡萄霜霉病作为宁夏葡萄产区最主要的病害,严重影响着葡萄种植业和葡萄酒酿造业[4]。目前,在葡萄霜霉病的防治中,药剂防治是最直接有效的防治方法,但随着化学药剂“3R”问题的日趋严重,化学药剂对环境破坏等问题凸显,化学农药造成的食品安全事件、农药残留超标事件时有发生,已经不能适应现代葡萄产业的发展、不能保证葡萄生产的正常进行,新型高效环保的杀菌剂及合理安全的用药技术在葡萄生产中迫切需求。
葡萄霜霉病的生物防治近些年成为研究的热点之一,已开发与筛选出一些对葡萄霜霉病有效的生物药剂[5]。芽孢杆菌(Bacillus spp.)是国内外开发微生物源农药的重要资源,因其低毒、低污染的特点,在生物防治中得到广泛研究和应用[6-7],是目前较为理想的微生物农药,研究较多的是枯草芽孢杆菌。陈浩等研究发现枯草芽孢杆菌B-FS01在室内和田间,对葡萄霜霉病均具有优良的防效[8]。岳宪化等报道,哈茨木霉菌可湿性粉剂对葡萄霜霉病具有较好的防效[9]。臧超群等分离的细菌菌株SY286对葡萄霜霉病有较好的防治效果,有望在葡萄霜霉病的生物防治中发挥更大作用[10]。但对宁夏葡萄产业来说,防治霜霉病的药剂仍相对单一,且化学药剂居多,生物药剂防治葡萄霜霉病研究明显不足,是制约该地区葡萄产业绿色、健康、高质量、可持续发展的瓶颈。
宁夏葡萄产业多为酿酒葡萄,种植面积达到3.28万hm2,是全国最大的酿酒葡萄集中连片种植区,年产葡萄酒1.3亿瓶,出口20多个国家和地区,综合产值达到了261亿元。据报道,酿酒葡萄浆果表面微生物包括丝状真菌、酵母菌、细菌,优势菌群酵母菌、乳酸菌和醋酸菌是葡萄酒風味物质形成的关键菌群[11-12]。但由于种植模式、葡萄品种、杀菌剂、温湿度等的显著差异,导致微生物(尤其土著菌群)种类和数量有明显差异[13]。近年来,国外相关学者在天然土著菌群对葡萄酒风味品质影响方面做了大量的研究工作,相关研究成果充分表征了土著菌群在酿酒过程中起到的关键作用及对香气物质富集与酒品整体风味呈现的影响力[14]。杀菌剂作为影响葡萄果面微生物群落的关键因子,Cˇade等研究表明,杀菌剂的使用使酿酒葡萄在成熟过程中土著菌群种类和群体数量大幅减少,不使用杀菌剂的酿酒葡萄表面优势菌群为假丝酵母属(Candida)、德巴利(氏)酵母(Debaryomyces)、接合酵母属(Zygosaccharomyces)、葡萄有孢汉逊酵母(Hanseniasporauvarum)[15]。因此,掌握和了解施用生物杀菌剂后葡萄果面微生物的多样性,对葡萄霜霉病的防治以及葡萄酒的品质都具有重要意义。
本研究通过田间药效试验,比较7种生物源杀菌剂对葡萄霜霉病的田间防治效果,以期为宁夏地区防治葡萄霜霉病筛选出防效较好的生物杀菌剂,解决化学药剂污染等问题。以及分析施用不同生物菌剂后葡萄果面真菌、细菌的群落组成、结构以及多样性,旨在为研究使用不同杀菌剂防治葡萄霜霉病对酿酒品质的影响提供理论依据。
1 材料与方法
1.1 试验材料
试验共选择6种植物源、微生物源农药及1种环境友好型高效肥料为试验研究对象,药剂分别为1 000亿个孢子/g枯草芽孢杆菌可湿性粉剂,山东省乳山韩威生物科技有限公司生产;5%多抗霉素水剂,山东省乳山韩威生物科技有限公司生产;0.3%苦参碱水剂,北京三浦百草绿色植物制剂有限公司生产;47%春雷王铜可湿性粉剂,山东省乳山韩威生物科技有限公司生产;0.3%丁子香酚可溶液剂,南通神雨绿色药业有限公司生产;3亿CFU/g哈茨木霉可湿性粉剂,美国拜沃生物技术有限公司生产;亚磷酸钾,宁夏荣和绿色科技有限公司生产。
1.2 试验方法
1.2.1 田间药效试验 试验于2020年7月进行,试验地点位于宁夏回族自治区宁夏农垦玉泉营农场葡萄园内,该地为霜霉病常年发病区,风沙土壤,在病害发病前期进行药剂防治试验。
1.2.2 试验设计及调查方法 试验设8个处理,分别为1 000亿个孢子/g枯草芽孢杆菌(BS)、5%多抗霉素(PD)、0.3%苦参碱(MA)、47%春雷王铜(KC)、0.3%丁子香酚(EU)、3亿CFU/g哈茨木霉(TR)、亚磷酸钾(PF)处理,以清水作对照(CK)。每个处理30棵葡萄树,每10棵树为1个小区,每个处理重复3次,共24个小区,随机区组排列。
于葡萄霜霉病发病前第1次施药,施药方式为喷雾,用电动喷雾器分别将7种药剂及清水均匀喷施到葡萄叶片的正反面,以药液不下淌为止,施药前进行葡萄霜霉病病害等级调查,后期再喷施2次,每隔7 d喷1次,共喷3次。第3次药后14、21、28 d进行调查,每株树调查10张叶片,采用9 级分级法调查发病情况,葡萄霜霉病叶片分级标准:0 级,无病斑;1级,病斑面积占整个叶片面积的5%及以下;3级,病斑面积占整个叶片面积的6%~25%;5级,病斑面积占整个叶片面积的26%~50%;7级,病斑面积占整个叶片面积的51%~75%;9级,病斑面积占整个叶片面积的76%及以上。计算病情指数,求出防效,并对各小区的防效进行方差分析,用最小显著极差法(LSR法)进行多重比较。公式[16]如下。
病情指数=∑(各级发病叶片数×相应发病级数)/(调查总叶片数×9)×100;
防治效果=[1-(喷药前空白区病情指数×喷药后处理区病情指数)/(喷药后空白区病情指数×喷药前处理区病情指数)]× 100%。
1.2.3 样品采集及处理 葡萄果实采收前采集各处理小区葡萄2~3串,进行保鲜处理后送至天津诺禾致源生物信息科技有限公司进行16S 扩增子测序,送样编号如表1所示。
1.2.4 基因组DNA的提取 采用十六烷基三甲基溴化铵(CTAB)法提取总基因组DNA。DNA在1%琼脂糖凝胶上检测其浓度和纯度。根据浓度,使用无菌水将DNA稀释至 1 ng/μL。
1.2.5 细菌16Sr RNA、真菌内源转录间隔区(ITS)区域的扩增测序 取适量的样本 DNA 于离心管中,使用无菌水稀释样本至 1 ng/μL,以稀释后的基因组DNA为模板,根据测序区域18S V3-V4 选择特异引物 341F (5′-CCTAYGGGRBGCASCAG-3′)与806R (5′-GGACTACNNGGGTATCTAAT-3′),真菌ITS1区域采用真菌特异引物ITS 1F(5′-CTTGGTCATTTAGACGAAGTAA-3′)和ITS 2R(5′-GCTGCGTTCTTCATCGATGC-3′)进行PCR 扩增 。PCR扩增程序:98 ℃预变性1 min;98 ℃变性30 s,50 ℃退火 30 s,72 ℃延伸30 s,反应30个循环;72 ℃延伸 5 min。-20 ℃保存。
PCR产物使用 2%浓度的琼脂糖凝胶进行电泳检测后使用 GeneJET 试剂盒纯化回收目标条带。使用TruSeqDNA PCR免费样品制备试剂盒生成测序文库。使用TruSeq TM DNA Sample Prep Kit(Illumina,CA,USA)构建PE文库,使用Illumina Nova Seq进行上机测序,测序长度为250 bp。测序工作由天津诺禾致源生物信息科技有限公司完成。
1.2.6 测序数据处理 根据双末端测序序列(PE reads)之间的重叠(Overlap)关系,将测序得到的双端序列数据拼接成一条序列(Tags),同时对reads的质量和拼接的效果进行质控过滤。利用软件Flash v1.2.7通过 Overlap对每个样品的reads进行拼接,得到的拼接序列即原始 Tags数据(Raw Tags);使用 Trimmomatic v0.33軟件,对拼接得到的 Raw Tags进行过滤,得到高质量的Tags数据 (Clean Tags);使用UCHIME v4.2软件,鉴定并去除嵌合体序列,最终得到有效数据(Effective Tags)。
1.2.7 多样性和群落结构分析 默认以 97%的一致性对Clean Reads进行操作分类单元(OTUs)聚类,然后通过与数据库 Silva132(细菌)和UNITE(真菌)分类学数据库对OTU进行分类学注释。分析微生物群落结构差异并绘制差异 OTU韦恩图、非加权组平均法(UPGMA)聚类树及属水平上物种相对丰度柱形图。α多样性指数采用Qiime软件进行计算,包括OTU指数、 Chao1 指数、Shannon指数、Simpson指数和ACE指数。Chao1指数和ACE指数侧重于体现群落的丰富度,而Shannon指和Simpson指数数则综合考虑群落的丰富度和均匀度。多样品比较分析主坐标分析(PCoA)图以及聚类分析的群落组成热图采用R软件(v2.15.3)进行绘制,PCoA基于由样本组成计算得到的距离矩阵进行特征向量降维排序,从均一化的 OTU矩阵中计算加权和未加权的UniFrac距离矩阵,其中加权考虑物种的丰度,未加权则没有对物种丰度进行加权处理。
2 结果与分析
2.1 田间药效试验结果
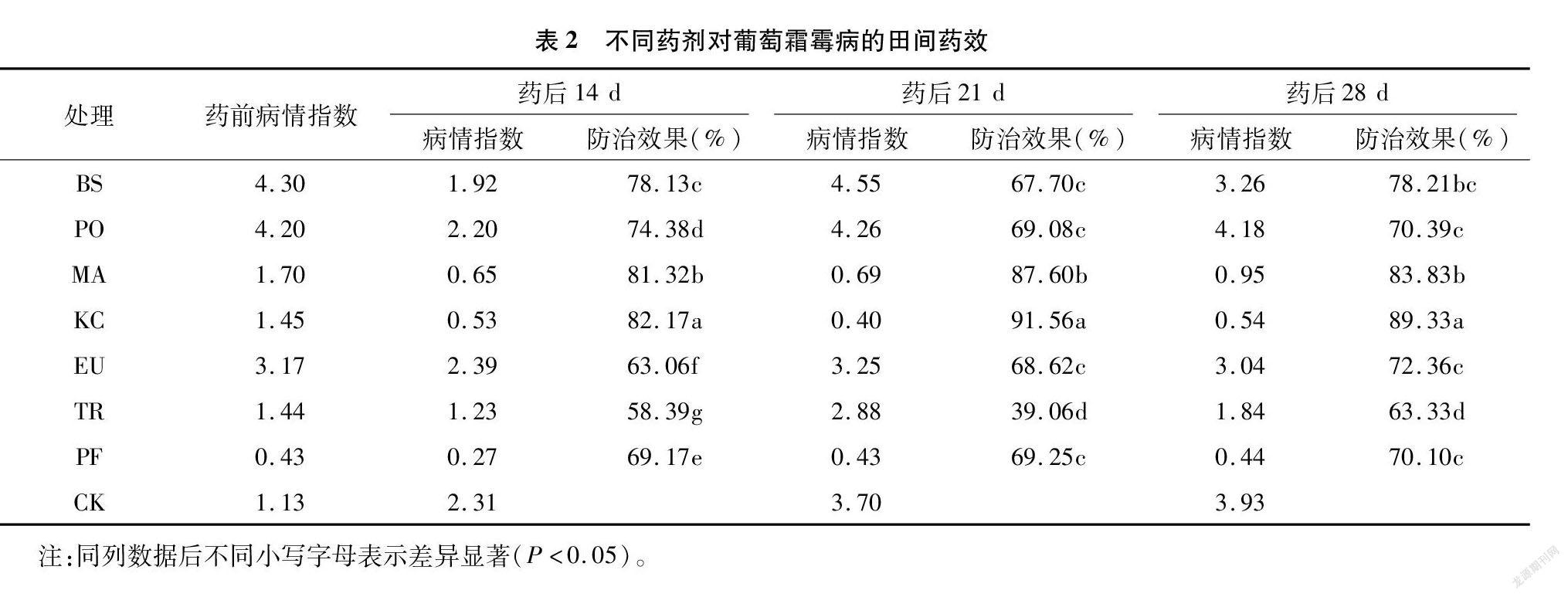
由表2可以看出,不同药剂对葡萄霜霉病的田间防效存在明显差异。在3次药后14 d时,各处理防效之间均无明显差异,但47%春雷王铜的防效最高,为82.17%,其次是防效为81.32%的0.3%苦参碱,而3亿CFU/g哈茨木霉的防效最低,为58.39%;从药后21 d来看,各处理间存在显著的差异性,47%春雷王铜的防效最高,为91.56%,明显高于其余6种药剂的防效,0.3%苦参碱的防效次之,为87.60%,3亿CFU/g哈茨木霉的防效最低,仅为39.06%,防治效果明显低于其他几种药剂;从药后28 d的防治效果看,47%春雷王铜的防治效果仍然是最高的,为89.33%,0.3%苦参碱次之,防效为83.83%,高于其他5种药剂的防效,3亿CFU/g哈茨木霉的防效依然是7种药剂中防效最低的,为63.33%,显著低于其他6种药剂的防效。
综合比较7种药剂对葡萄霜霉病的防治效果可以看出,47%春雷王铜和0.3%苦参碱对葡萄霜霉病具有良好的防治效果,在调查的3个时间段中,防治效果在81.32%~91.56%之间,可在实际生产中合理使用上述杀菌剂防治葡萄霜霉病。
2.2 不同药剂处理对果面微生物群落的影响
2.2.1 不同药剂处理对葡萄果面微生物群落结构
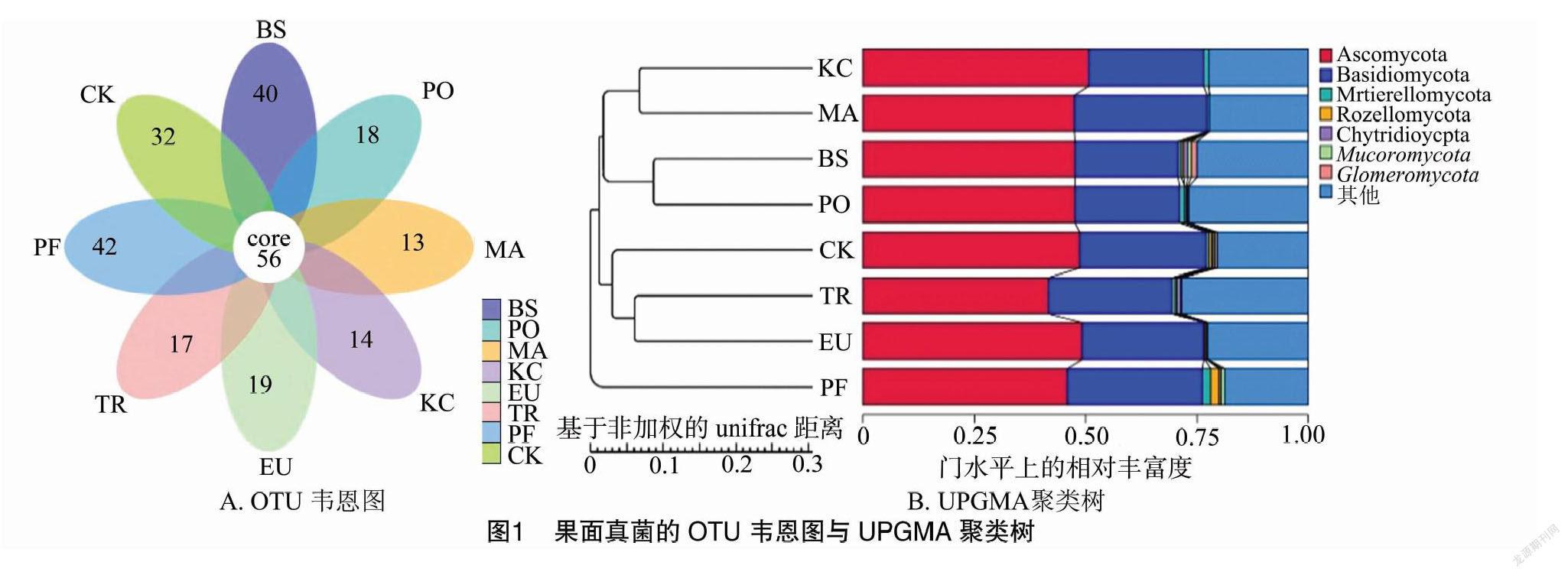
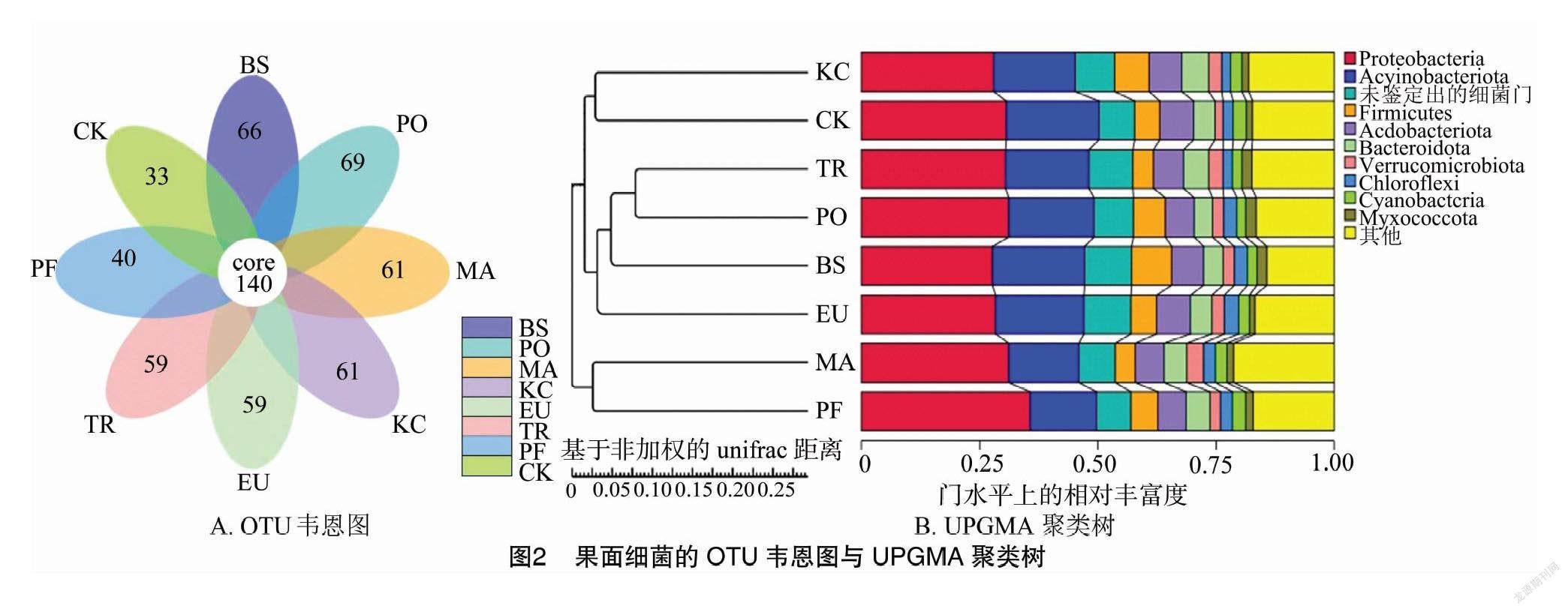
组成分析 为分析不同生物药剂处理下果面微生物的群落结构,研究不同处理间的相似性,本研究通过对样本以Binary Jaccard 距离矩阵进行UPGMA等级聚类,构建了8个样本的聚类树,并且根据聚类得到的OTU分析不同样本间共有及特有的OTU,绘制成韦恩图,如图1和图2所示。根据图1-A可以看出,真菌中共有OTU为56个,8种药剂处理下的果面真菌的OTU存在明显差异,其中PF组特有42个差异OTU,BS组特有40个差异OTU,MA组的特有OTU最少,为13个;从图2-A可以看出,细菌中共有OTU为140个,不同处理果面细菌共有OTU明显多于真菌,其中PO组特有69个差异OTU,是8个处理中差异OTU最多的,BS组特有66个差异OTU,差异OTU最少的组为CK,有33个。
选取不同药剂处理下各样品组在属分类水平上相对丰富度排名前10的物种绘制物种相对丰度柱形图,以便查看各样品组中相对丰度较高的优势物种及其所占比例(图3)。从图3-A排名前10(Top10)的真菌属中可以看出,BS样品组优势菌属有枝孢属(Cladosporium)、链格孢属(Alternaria)、线黑粉酵母属(Filobasidium)、掷孢酵母属(Sporobolomyces)等;PO和MA样品组优势菌属有枝孢属(Cladosporium)、链格孢属(Alternaria)、线黑粉酵母属(Filobasidium)、短柄霉属(Aureobasidium)等;KC样品组优势菌属有枝孢属(Cladosporium)、链格孢属(Alternaria)、茎点霉属(Phoma)、线黑粉酵母属(Filobasidium)等;EU样品组优势菌属有枝孢属(Cladosporium)、链格孢属(Alternaria)、线黑粉酵母属(Filobasidium)、(Vishniacozyma)等;TR样品组优势菌属有枝孢属(Cladosporium)、链格孢属(Alternaria)、线黑粉酵母属(Filobasidium)、短柄霉属(Aureobasidium)等;PF样品组优势菌属有枝孢属(Cladosporium)、线黑粉酵母属(Filobasidium)、链格孢属(Alternaria)、孢汉逊酵母属(Hanseniaspora)等;CK样品组优势菌属有枝孢属(Cladosporium)、链格孢属(Alternaria)、線黑粉酵母属(Filobasidium)、短柄霉属(Aureobasidium)等。综合各处理样品组可以看出,葡萄果面真菌中枝孢属(Cladosporium)、链格孢属(Alternaria)、线黑粉酵母属(Filobasidium)为优势物种且相对丰度较高。
从图3-B排名前10的细菌属中可以看出,BS样品组优势菌属有马赛菌属(Massilia)、链球菌属(Streptococcus)、鞘氨醇单胞菌属(Sphingomonas)等;PO样品组优势菌属有马赛菌属(Massilia)、假单胞菌属(Pseudomonas)、鞘氨醇单胞菌属(Sphingomonas)等;MA样品组优势菌属有马赛菌属(Massilia)、鞘氨醇单胞菌属(Sphingomonas)、弧形菌属(Vibrio)等;KC样品组优势菌属有链球菌属(Streptococcus)、弧形菌属(Vibrio)、短杆菌属(Curtobacterium)等;EU样品组优势菌属有弧形菌属(Vibrio)、链球菌属(Streptococcus)、马赛菌属(Massilia)等;TR样品组优势菌属有马赛菌属(Massilia)、链球菌属(Streptococcus)、鞘氨醇单胞菌属(Sphingomonas)等;PF样品组优势菌属有链球菌属(Streptococcus)、弧形菌属(Vibrio)、马赛菌属(Massilia)等;CK样品组优势菌属有马赛菌属(Massilia)、鞘氨醇单胞菌属(Sphingomonas)、链球菌属(Streptococcus)等。综合各处理样品组可以看出,葡萄果面细菌中除了2个未鉴定出的属外,在其余8个属中,马赛菌属(Massilia)和鞘氨醇单胞菌属(Sphingomonas)为优势物种且相对丰度较高。
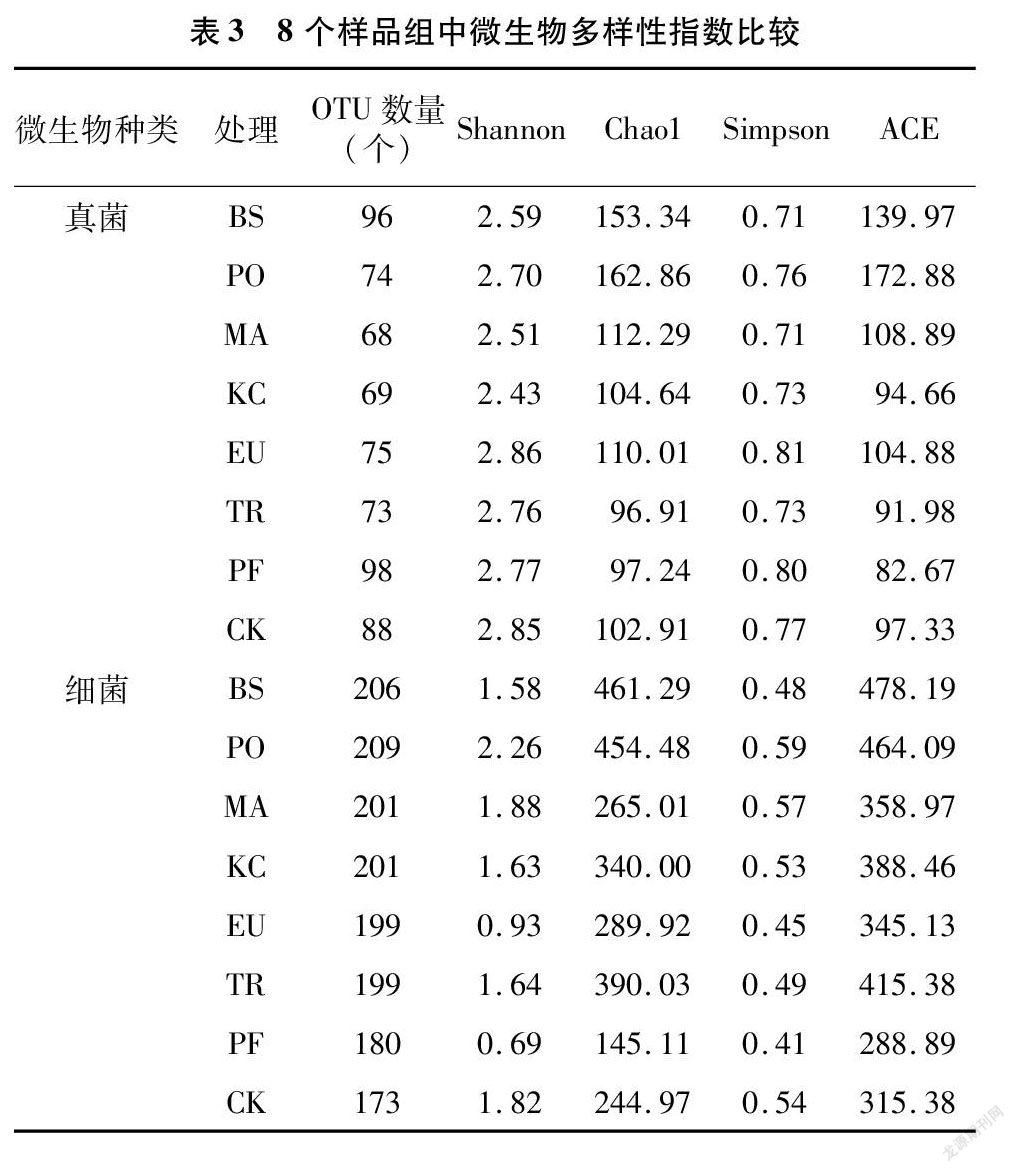
2.2.2 不同药剂处理对葡萄果面微生物多样性分析 α多样性主要关注局域均匀生境下的物种数量,因此也被称为生境内的多样性。而OTU数量、Chao1指数、Shannon指数、Simpson指数和ACE指数均是Alpha多样性指数,以表征样品中物种分布的丰富度、多样性和均匀度,并且可以直观展示测序深度和数据量情况。从表3可以看出,不同处理中真菌群落和细菌群落的OTU数量存在明显差异,而各处理中细菌群落的OTU数量明显高于真菌的OTU数量。Chao1指数和ACE指数越大,表明群落的丰富度越高,Shannon指数和Simpson指数越高,表明群落的多样性越高,物种分布越均匀。从真菌群落看,样品EU组的Shannon指数和Simpson指数均最高,分别为2.86和0.81,说明样品EU组果面真菌多样性较高,物种分布较均匀;Chao1指数和ACE指数最大的为样品PO组,分别为162.86和172.88,其次是样品BS组的153.34和139.97,说明样品PO组和BS组真菌群落的丰度较高。从细菌群落看,样品PO组的Shannon指数和Simpson指数均最高,分别为2.26和0.59,其次是样品MA组,分别为1.88和0.57,说明样品PO组和MA组果面细菌多样性较高,物种分布均匀;样品BS组的Chao1指数和ACE指数均最大,分别为461.29和478.19,其次是样品PO组的454.48和464.09,说明这2个样品组果面中细菌群落的丰度较高。本试验中,样本测序深度值均在95%以上,说明测序覆盖率较高,测序深度良好,测序结果合理可靠。
2.2.3 不同药剂处理对葡萄果面微生物群落结构相似性分析 基于加权UniFrac 距离的 PCoA 分析了不同药剂处理后微生物群落结构相似性。真菌群落结构分析结果(图4-A)显示,PC1 和 PC2 解释率分别为 61.84% 和9.39%,BS、CK、EU分布于第一、第二、第四象限,三者距离较远,而PO、PF、MA在中心位置,说明 BS、EU和CK之间真菌群落结构组成差异较大,而PO、PF、MA之间真菌群落结构组成相似。细菌群落结构分析结果(图4-B)显示,PC1 和 PC2 解释率分别为54.72%和17.66%,BS和TR均分布于第一象限,说明BS和TR之间细菌群落组成结构相似,KC、EU和CK则分布于第四象限,说明这3组之间细菌群落组成结构相似,而PO分布于第二象限,MA分布于第三象限,与其他几组距离较远,结构差异较大。
3 结论与讨论
葡萄霜霉病主要危害葡萄叶片,但对新梢、叶柄、花序、穗轴、果柄和果实等幼嫩组织也会造成危害[17]。葡萄种植业中霜霉病的防治主要采用化学防治措施,常用的化学药剂包括氨苯甲基酰胺类[18]、氨基甲酸酯类、吗啉类[19]、甲氧基丙烯酸酯类等药剂[20-21],但由于近些年化学药剂的单一、盲目使用,导致葡萄霜霉病病菌对大多数的药剂都出现了不同程度的抗药性,防治效果显著降低,而化学药剂的过量、频繁使用,又导致了葡萄农药残留、环境污染等一系列安全和环保问题。近些年,随着人们生活水平的不断提高,对健康绿色食品的要求也越来越高,加之国家大力支持和鼓励植物病害的防治要朝绿色环保方向发展,因此,筛选对环境友好、安全、高效的生物杀菌剂对防治葡萄霜霉病,提高葡萄品质具有重要的意义。
因生物防治具有高效、环保、安全、无副作用等优点,是植物病害防治的发展趋势。植物内生真菌、细菌、芽孢杆菌、木霉菌都是生物防治的研究热点,吉沐祥等研究发现黄麻链霉菌NF0919 菌株和枯草芽孢杆菌 DJ-6 WP 对葡萄霜霉病具有一定防效,认为这2株菌株具备一定的生防潜力与开发的价值[22];康兴娇等研究发现甲基营养型芽孢杆菌T3对葡萄霜霉病病菌具有强烈的抑制作用,并具有较好的防治效果[23];曹辉等在葡萄霜霉病生物防治试验中发现,哈茨木霉菌可湿性粉剂对葡萄霜霉病的防效较好,且适宜使用浓度为300倍液[24]。本研究中也对3亿CFU/g哈茨木霉可湿性粉剂的田间防效进行了研究,但其防治效果较差。包岩在4种药剂对葡萄霜霉病的防治效果试验中认为,0.3%丁子香酚可溶性液剂对葡萄霜霉病具有显著的防效,防效达到83.8%[25],而本研究中0.3%丁子香酚可溶性液剂对葡萄霜霉病的防效最高为72.36%,防效一般,导致防治效果存在差异可能是由于不同的地理环境、气候等因素造成的;曹依静等在研究1%苦参碱水乳剂防治葡萄霜霉病试验中表明,该生物药剂可有效防治葡萄霜霉病的发生,防效达90%以上,防效明显高于常规杀菌剂 70%丙森锌和80%代森锰锌[26],本研究结果与之一致,在本研究中0.3%苦参碱水剂对葡萄霜霉病的防效仅次于47%春雷王铜。春雷王铜属于复合型低毒杀菌剂,具有保护和治疗双重作用,被广泛用于防治各种由真菌、细菌引起的病害,如核桃细菌性黑斑病[27]、黄瓜靶斑病[28]、生姜青枯病[29]等,针对不同作物不同病害其防治效果也存在显著差异,本研究中47%春雷王铜防治葡萄霜霉病防效最好,防效在82.17%~91.56%之间,明显优于其他生物药剂,说明47%春雷王铜可作为防治宁夏葡萄霜霉病的低毒、环保型药剂使用。
微生物群落对葡萄酒的风味及品质都有很大影响,其中酵母菌又是葡萄酒酿造的关键因素,直接决定了葡萄酒的风味及感官品质。而杀菌剂的使用又能够改变葡萄果面微生物群落结构,只有了解不同杀菌剂使用后葡萄果面微生物群落结构,才能保证葡萄酒的口感以及风味。近些年,对葡萄根际土壤、叶片、浆果表面等的微生物群落结构研究的较多,马勉娣等在对酿酒葡萄“赤霞珠”叶内生真菌多样性研究中发现,链格孢属和黑孢属为优势属,认为酿酒葡萄赤霞珠叶片内生真菌菌群丰富,存在一定的宿主专一性,但多样性偏低[30]。王志恒等在研究宁夏贺兰山东麓酿酒酵母分离筛选及菌株鉴定试验中,共鉴定出克鲁维毕赤酵母(Pichia kluyveri)、美极梅奇酵母(Metschnikowia pulcherrima)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、酿酒酵母(Saccharomyces cerevisiae)、大隐球酵母(Cryptococcus magnus)共5种酵母菌[31]。魏玉洁等在应用高通量测序技术研究新疆产区葡萄果实、叶片及果园土壤微生物多样性中检测到了酵母属(Saccharomyces)真菌,认为该菌可以将葡萄浆果中的糖转化成乙醇、CO 2及其他代谢产物[32],在葡萄汁發酵过程中生成并释放多种香气物质,同时还对葡萄果实表面的细菌有一定的生物抑制作用[33],而相比于真菌,除少数乳酸菌外,大多数细菌微生物对葡萄酒来说都是有害菌,会不同程度对葡萄酒的品质造成影响,如变形菌门(Proteobacteria)的醋酸菌在酿酒中属于典型的有害菌[34]。因此,在酿造过程的各个阶段都应该尽可能避免或减少细菌侵染。有关使用杀菌剂后对葡萄果面微生物群落结构影响的报道较少,国外Noguerol-Pato等选用了10种不同杀菌剂处理过的酿酒葡萄,对酵母菌群落进行了比较分析,发现普通表面酵母群落生物量均低于用杀菌剂处理的葡萄,而且研究发现杀菌剂还降低了酵母菌的发酵能力、乙醇生产量和香气物质含量[35]。本研究中对使用7种杀菌剂后的果面微生物群落结构进行了研究发现,葡萄果面真菌中枝孢属(Cladosporium)、链格孢属(Alternaria)、线黑粉酵母属(Filobasidium)为优势物种且相对丰度较高;葡萄果面细菌中马赛菌属(Massilia)和鞘氨醇单胞菌属(Sphingomonas)为优势物种且相对丰度较高。
本研究对7种低毒、生物型农药进行了田间药效试验,发现47%春雷王铜和0.3%苦参碱对葡萄霜霉病具有良好的防治效果,在调查的3个时间段中,防治效果在81.32%~91.56%之间,可在实际生产中合理使用上述杀菌剂防治葡萄霜霉病。并通过对施药后葡萄果面微生物群落结构及多样性进行了初步研究,对其真菌和细菌的群落结构、种类和多样性都有了一定的了解,为安全、高效、环境友好地防治葡萄霜霉病提供了理论依据,及为揭示施药后葡萄果面微生物多样性,提高葡萄酒品质提供了理论支持。
参考文献:
[1]Jeffers J N R,Plank J E V D. Plant diseases:epidemics and control[J]. The Statistician,1965,15(1):90.
[2]Boso S,Santiago J L,Martínez M C. Resistance of eight different clones of the grape cultivar Albario to Plasmopara viticola[J]. Plant Disease,2004,88(7):741-744.
[3]沙月霞,王国珍,樊仲庆,等. 宁夏贺兰山东麓不同葡萄品种对霜霉病的抗性鉴定[J]. 果树学报,2007,24(6):803-809.
[4]杨璐嘉,初炳瑶,邓 杰,等. 宁夏葡萄霜霉病菌致病型鉴定及葡萄品种抗性评价[J]. 植物保护学报,2020,47(6):1321-1332.
[5]吉沐祥,吴琴燕,王建华,等. 10种生物和化学杀菌剂防治葡萄霜霉病的药效评价[J]. 农学学报,2017,7(3):17-23.
[6]Li Y,Han L R,Zhang Y Y,et al. Biological control of apple ring rot on fruit by Bacillus amyloliquefaciens 9001[J]. The Plant Pathology Journal,2013,29(2):168-173.
[7]Wang L Y,Xie Y S,Cui Y Y,et al. Conjunctively screening of biocontrol agents (BCAs) against Fusarium root rot and Fusarium head blight caused by Fusarium graminearum[J]. Microbiological Research,2015,177:34-42.
[8]陈 浩,胡梁斌,唐春平,等. 枯草芽胞杆菌B-FS01对葡萄霜霉病的防治效果[J]. 植物保护,2011,37(6):194-197.
[9]岳宪化,胡夫防,段丽峰,等. 哈茨木霉菌防治葡萄霜霉病试验[J]. 中国果树,2014(2):54-56.
[10]臧超群,赵奎华,刘长远,等. 生防细菌SY286的筛选及其对葡萄霜霉病的防治效果研究[J]. 中国生物防治学报,2014,30(3):402-407.
[11]Barata A,Malfeito-Ferreira M,Loureiro V.The microbial ecology of wine grape berries[J]. International Journal of Food Microbiology,2012,153(3):243-259.
[12]Gilbert J A,van der Lelie D,Zarraonaindia I.Microbial terroir for wine grapes[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(1):5-6.
[13]高飞飞,肖 婧,郑晓吉,等. 影响新疆酿酒葡萄浆果体表菌群结构研究进展[J]. 中国酿造,2016,35(12):1-4.
[14]Domizio P,Romani C,Comitini F,et al. Potential spoilage non-Saccharomyces yeasts in mixed cultures with Saccharomyces cerevisiae[J]. Annals of Microbiology,2011,61(1):137-144.
[15]Cˇade N,Zupan J R,Raspor P.The effect of fungicides on yeast communities associated with grape berries[J]. FEMS Yeast Research,2010,10(5):619-630.
[16]蔡 明. 寡聚酸碘和氨基寡糖素對冰葡萄霜霉病的田间防治效果[J]. 农药,2020,59(7):525-527.
[17]梁春浩,臧超群,安福涛,等. 葡萄霜霉病菌拮抗放线菌PY-1发酵条件优化[J]. 中国生物防治学报,2015,31(6):921-929.
[18]张 鑫,赵晓军,周建波. 太原市郊区黄瓜霜霉病菌对甲霜灵的抗药性检测[J]. 植物保护,2008,34(5):152-154.
[19]纪明山,张 敬,祁之秋,等. 黄瓜霜霉病菌对烯酰吗啉抗药性研究[M]. 北京:中国农业科学技术出版社,2004,228-232.
[20]王 岩,冯明鸣,朱书生,等. 黄瓜霜霉病菌烯肟菌酯敏感基线的建立及其室内抗药性风险评估[J]. 中国农业大学学报,2006,11(5):25-29.
[21]刘 旭,杨晓畅,陶 怡,等. 葡萄霜霉病拮抗细菌的筛选、鉴定及发酵条件优化[J]. 果树学报,2015,32(4):681-688,737.
[22]Ji M X,Yao K B,Miao K,et al. Toxicity test and field control effects of 4 different fungicides on grape downy mildew[J]. Agricultural Science and Technology,2016,17(7):1654-1657,1752.
[23]康兴娇,申红妙,贾招闪,等. 葡萄霜霉病生防菌甲基营养型芽胞杆菌T3的鉴定及其防治效果[J]. 中国生物防治学报,2016,32(6):775-782.
[24]曹 辉,左红娟,石彦召,等. 葡萄霜霉病生物防治试验[J]. 农业科技通讯,2018(1):150-151.
[25]包 岩. 几种药剂对葡萄霜霉病的防治效果试验[J]. 农业开发与装备,2019(11):138.
[26]曹依静,孙共明. 1%苦参碱水乳剂防治葡萄霜霉病试验[J]. 果农之友,2014(10):6.
[27]孙 阳. 不同药剂防治核桃细菌性黑斑病田间药效试验[J]. 山东农业科学,2012,44(1):93-94.
[28]杜玉宁,查仙芳,杨金凤,等. 宁夏温室黄瓜新病害靶斑病的药剂筛选[J]. 江苏农业科学,2013,41(1):132-133.
[29]赵志祥,严婉荣,陈 圆,等. 几种杀菌剂对生姜青枯病菌的毒力测定[J]. 贵州农业科学,2015,43(9):76-78,81.
[30]马勉娣,黄治钰,张秀英,等. 酿酒葡萄“赤霞珠”叶内生真菌多样性研究[J]. 中国南方果树,2014,43(3):29-34.
[31]王志恒,刘雅琴,冯翠娥,等. 宁夏贺兰山东麓酿酒酵母分离筛选及菌株鉴定[J]. 食品研究与开发,2017,38(11):176-180.
[32]魏玉潔,邹 弯,马文瑞,等. 应用高通量测序技术研究新疆产区葡萄果实、叶片及果园土壤微生物多样性[J]. 食品科学,2018,39(6):162-170.
[33]Fugelsang K C,Edwards C G. Wine Microbiology[M]. 2nd ed. New York:Springer US,2007:44-52.
[34]屈慧鸽. 葡萄酒生产过程中醋酸菌的危害及影响因素分析[J]. 酿酒科技,2009(2):43-46.
[35]Noguerol-Pato R,Torrado-Agrasar A,González-Barreiro C,et al. Influence of new generation fungicides on Saccharomyces cerevisiae growth,grape must fermentation and aroma biosynthesis[J]. Food Chemistry,2014,146:234-241.

