桉木预水解液中半纤维素多糖分离纯化及抗氧化活性研究
李学秀 刘海棠 安永贞 刘 婧 陈 琳 金 鑫
(中国轻工业造纸与生物质精炼重点实验室,天津科技大学天津市制浆造纸重点实验室,天津,300457)
随着黏胶纤维以及纤维制品需求量的不断增加,未来几年内用于生产再生纤维的溶解浆产量也日益增多[1]。在生产溶解浆过程中会产生大量的预水解液,如何对预水解液进行合理利用成为当前研究热点。预水解液中半纤维素含量丰富,其他如木素、糠醛等含量较少,因此利用半纤维生产高附加值产品可实现预水解液的有效利用[2]。
在预水解液半纤维素进行高附加值利用时,预水解液中的杂质会阻碍其有效利用,因此需要对半纤维素进行分离和纯化[3]。离子交换柱层析法在多糖的纯化中应用十分广泛[4],离子交换柱层析常用的离子交换剂有:离子交换纤维素、离子交换葡聚糖和离子交换树脂。其机理主要是利用物质所带正负电荷的差异对管柱上的离子交换剂有不同的亲和力,通过改变淋洗液的离子强度和pH 值,使得不同性质的多糖依次从层析柱中分离出来[5]。半纤维素在众多领域均具有潜在的应用前景[6],Anmad 等人[7]从车前子壳中分离出阿拉伯聚木糖,以此为原料制备出了抗菌薄膜。陈婷等人[8]对桉木碱性过氧化性机械浆(APMP)废液中的半纤维素进行改性后发现其具有一定的生物活性。汪心娉等人[9]报道称使用低共熔溶剂选择性处理玉米秸秆,可将其中的半纤维素转化为低聚木糖。但是有关预水解液半纤维素多糖分离纯化和结构分析的研究报道较少。
本研究通过对半纤维素粗多糖分离纯化得到纯化多糖,对其单糖成分、结构表征及体外抗氧化活性进行研究,以期对预水解液的进一步研究奠定理论基础。
1 实 验
1.1 材料及试剂
桉木预水解液(PHL),山东太阳纸业股份有限公司;浓硫酸、氯化钠、无水乙醇,分析纯,天津市江天化工技术有限公司;无水甲醇,色谱纯,天津市康科德科技有限公司;DEAE-650M,生化试剂,TOSOH 公司;葡萄糖、木糖、阿拉伯糖等,色谱纯,Sigma公司。
1.2 实验仪器
7000 B气质联用仪,美国安捷伦公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任;N-1100 旋转蒸发仪,上海爱朗仪器有限公司;FTIR-650 傅里叶变换红外光谱仪,天津港东科技发展股份有限公司;H3021D 高速离心机,上海知信实验仪器技术有限公司;SCIENTZ-10N冷冻干燥机,宁波新芝生物科技股份有限公司;1530VP 扫描电子显微镜,德国LEO公司。
1.3 实验方法
1.3.1 预水解液糖组分分析
桉木预水解液原样以及酸水解后的预水解液经离心机(8000 r/min,15 min)离心除杂,过0.22µm 滤膜后稀释到一定浓度,用高效阴离子交换色谱仪测定糖含量。
1.3.2 半纤维素粗多糖的制备
将离心除杂后的桉木预水解液原样进行旋转蒸发浓缩,使用浓硫酸酸化预水解液至pH 值2.0,除去木素,静置过夜。取上清液以体积比1∶4 的比例加入无水乙醇沉淀(使无水乙醇含量达到80%),静置24 h,8000 r/min 离心15 min,收集沉淀物,真空冷冻干燥获得半纤维素粗多糖(PHLP)。
1.3.3 半纤维素粗多糖的分离纯化
将PHLP配制成浓度为1 mg/mL的溶液,取20 mL溶液加样至DEAE-650M 阴离子交换层析柱,依次用蒸馏水、0.2、0.4、0.6 mol/L 的NaCl 溶液进行梯度洗脱,每个梯度洗脱100管。使用收集器收集,每管收集5 mL。采用苯酚-硫酸法[10]检测各管的多糖含量。洗脱曲线的横坐标为洗脱管数,纵坐标为测定的多糖含量。将洗脱曲线中各峰对应管数的洗脱液合并,对收集的洗脱液减压浓缩后用去离子水透析除盐。透析完全后进行真空冷冻干燥即得到纯化后的2 种多糖PHLP-1和PHLP-2。
1.3.4 葡萄糖醛酸含量测定
釆用硫酸-咔唑法测定[11]葡萄糖醛酸含量。精确称取干燥至恒质量的葡萄糖醛酸50 mg,用蒸馏水溶解,定容于100 mL 容量瓶中。分别取0、0.1、0.2、0.3、0.4、0.5 和0.6 mL 浓度为0.5 mg/mL 的葡萄糖醛酸溶液于试管中,分别补加水至1 mL,在冰水浴中加入6 mL 浓硫酸。混匀后,在85℃下水浴20 min,冷却至室温,每管加入0.2 mL 咔唑溶液(1 g/L,用无水乙醇配制)。室温下保持2 h,在530 nm 下测定吸光度。以葡萄糖醛酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线。葡萄糖醛酸溶液标准曲线见图1。按上述操作步骤测定吸光度,从而计算葡萄糖醛酸浓度。
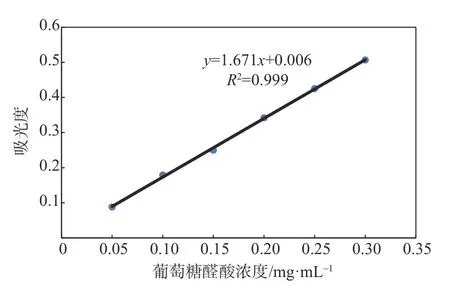
图1 葡萄糖醛酸溶液标准曲线Fig.1 Standard curve of glucuronic acid solution
1.3.5 单糖组分测定
1.3.5.1 标准单糖的衍生化[12]
分别配置1 mg/mL 的各单糖标准溶液,包括葡萄糖、鼠李糖、阿拉伯糖、木糖、甘露糖及半乳糖放入试管中。分别取0、40、80、100、250、500µL 单糖冻干。在冻干后的标准单糖样品中,分别加入50µL浓度为20 mg/mL 的甲氧基铵盐酸盐/吡啶溶液,40℃水浴80 min 后加入80µL 的N,O-双(三甲基硅基)三氟乙酰胺(BSTFA),混匀,40℃水浴80 min,然后在10000 r/min 下离心10 min,取上清液过0.22µm 滤膜后置于进样瓶,进行气相色谱-质谱联用技术(GCMS)分析。
1.3.5.2 纯化后的多糖水解及衍生化[13]
称取2 mg 多糖于反应釜中,加入5 mL 三氟乙酸(2 mol/L 三氟乙酸(TFA)),密封后120℃水解2 h,之后加入无水甲醇旋蒸除去残留TFA,最后加入2 mL去离子水,混匀,取100µL 混合液于新的离心管中,真空冷冻干燥。按照1.3.5.1标准单糖的衍生化方法处理,反应产物进行气质分析。
1.3.5.3 气相色谱-质谱联用分析条件
色谱柱为HP-5 气相色谱柱(30 cm×0.32 mm×0.25µm);进样口温度设定为250℃,检测器温度设定为240℃,流速1 mL/min;升温程序:初始温度为110℃,保持2 min,以8℃/min 速率升到160℃,再以2℃/min 速率升到230℃,最后以5℃/min 的速率升到250℃,保持2 min。载气为氮气,进样量为1µL,分流比为10∶1。
1.3.6 红外光谱(FT-IR)测定
称取纯化后的多糖至玛瑙研钵中,按照1∶100的比例加入干燥后的溴化钾做分散剂,研磨成微细粉末,然后置于模具中,以10 MPa 压力压制1 min制片,进行红外光谱测定。光谱扫描范围400~4000 cm-1,扫描32 次,分辨率为4 cm-1,扫描时扣除H2O 和CO2的背景。
1.3.7 扫描电子显微镜(SEM)观察
在金属样品台上粘贴一块导电胶用于固定样品,取适量纯化后的多糖样品置于导电胶上,用洗耳球轻轻吹去浮样,将金属样品台放入离子溅射装置中镀一层导电金膜,镀膜后用1530VP 扫描电子显微镜进行观察。
1.3.8 PHLP抗氧化活性分析
1.3.8.1 DPPH自由基清除活性测定
参考冯炘等人[14]的方法稍作修改,具体步骤为:取不同浓度的多糖溶液(0.2、0.4、0.6、0.8 和1.0 mg/mL) 和VC 溶 液 与1 mL DPPH-乙 醇 溶 液(0.1 mmol/L) 混合均匀,避光反应30 min 后测定517 nm 下的吸光度。以VC 为阳性对照。按式(1)计算1,1-二苯基-2-三硝基苯肼(DPPH)的清除率。
DPPH自由基清除率=

式中,A1为实验组吸光度;A2为样品本底吸光度;A0为空白组吸光度。
1.3.8.2 ABTS自由基清除活性测定
参考XU 等人[15]的方法稍作修改,具体为:取2,2´-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)溶液(7.4 mmol/L)30 mL 于50 mL 离心管中,加入30 mL过硫酸钾溶液(2.6 mmol/L),混合均匀,避光反应12 h。然后用蒸馏水稀释,使其在734 nm下的吸光度约为0.7±0.02,制成ABTS 反应液。取1 mL 不同浓度的多糖溶液和VC溶液(0.2、0.4、0.6、0.8和1.0 mg/mL)与4 mL ABTS 反应液混合均匀,静置10 min 后测定734 nm 下的吸光度。以VC 为阳性对照。按式(2)计算ABTS自由基清除率。
ABTS自由基清除率=

式中,B1为实验组吸光度;B2为样品本底吸光度;B0为空白组吸光度。
1.3.8.3 O2-自由基清除活性测定
参考DONG 等人[16]的方法。具体为:取4.5 mL Tris-HCl 缓冲溶液(pH 值=8.2,50 mmol/L)于试管中,加入1 mL 不同浓度的多糖溶液和VC 溶液(0.2、0.4、0.6、0.8 和1.0 mg/mL),加入0.3 mL 经25℃水浴后的邻苯三酚溶液(10 mmol/L,以10 mmol/L HCl 配制)。迅速摇匀后,25℃水浴5 min,然后加入1 mL HCl(8 mmol/L)终止反应,在320 nm 处测定吸光度。以VC 为阳性对照。按式(3)计算O2-自由基清除率。
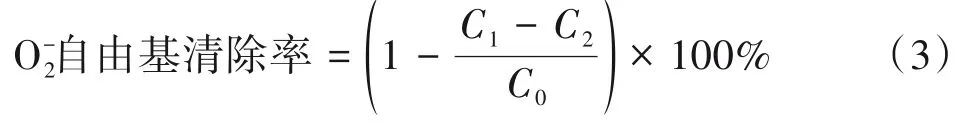
式中,C1为实验组吸光度;C2为样品本底吸光度;C0为空白组吸光度。
1.3.8.4 OH-自由基清除活性测定
参考CHEN 等人[17]的方法稍作修改,具体为:取不同浓度的多糖溶液及VC 溶液(0.2、0.4、0.6、0.8和1.0 mg/mL)于试管中,依次加入1 mL FeSO4溶液(5 mmol/L)、1 mL 水杨酸-乙醇溶液(5 mmol/L),最后加入1 mL H2O2溶液(5 mmol/L),混合均匀后,在37℃下水浴30 min。在510 nm 处测定吸光度,VC 为阳性对照。按式(4)计算OH-自由基清除率。
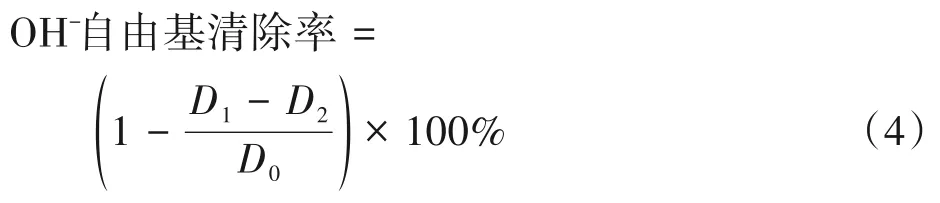
式中,D1为实验组吸光度;D2为样品本底吸光度;D0为空白组吸光度。
2 结果与讨论
2.1 预水解液糖组分分析
表1 为预水解液中糖组分的含量。由表1 可知,预水解液中单糖主要有阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖,其中以木糖为主,占单糖含量的57.6%。聚糖以聚木糖为主,占聚糖含量的65.7%。
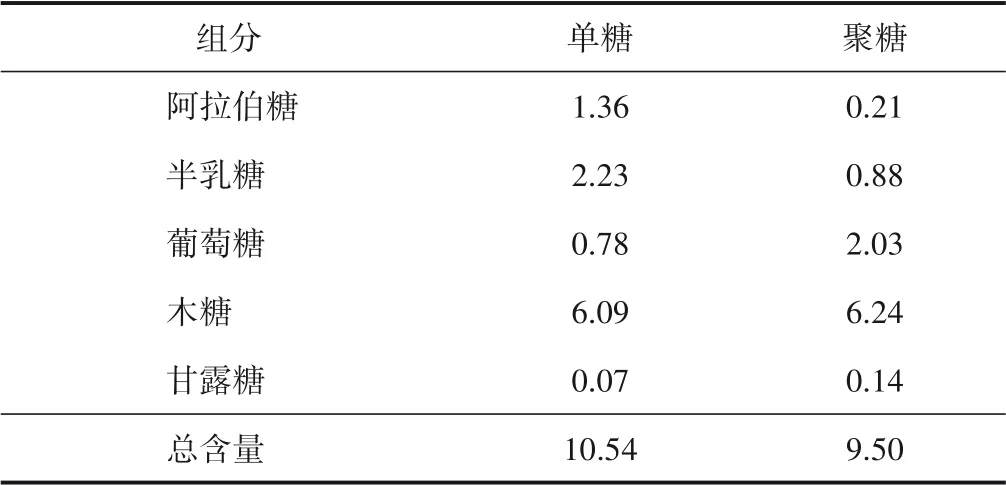
表1 预水解液中糖组分的含量Table 1 The monosaccharide and polysaccharide contents of PHL g/L
2.2 PHLP分离纯化分析
在阴离子交换层析柱中,氯化钠溶液中的阴离子(氯离子)将会与吸附在填料上的多糖竞争,而使用蒸馏水和不同浓度的氯化钠溶液洗脱则可以达到分离多糖的目的。
以DEAE-650M 离子交换层析柱对PHLP 进行分离纯化,得到洗脱曲线如图2 所示。由图2 可以看出,经蒸馏水、0.2、0.4、0.6 mol/L NaCl 溶液洗脱后,有3 个洗脱峰。第1 个洗脱峰是经蒸馏水洗脱出来的,因为这一部分糖对填料的亲和力较小,吸附能力较弱,所以最先被洗脱出来[18];而另外拥有较强吸附能力的糖组分则随着洗脱液中阴离子的逐渐增多被洗脱下来,得到第2个洗脱峰,当用0.4 mol/L的NaCl洗脱时出现了较小的洗脱峰,因其糖含量较少没有纯糖的必要,故不再进行收集。以蒸馏水和0.2 mol/L NaCl 溶液作为洗脱液洗脱下的多糖,分别为PHLP-1中性糖和PHLP-2 酸性糖[19]。测定PHLP-1 的得率为33.9%,PHLP-2 的得率为25.5%。PHLP-1 和PHLP-2的葡萄糖醛酸含量分别为0.0057、0.081 mg/mL,PHLP-2 的糖醛酸含量明显高于PHLP-1,这与洗脱液盐浓度的增加可能有极大的关系,氯化钠溶液浓度越高,洗脱下来的多糖侧链所带酸根基团越多,多糖的酸性也就越强[20]。
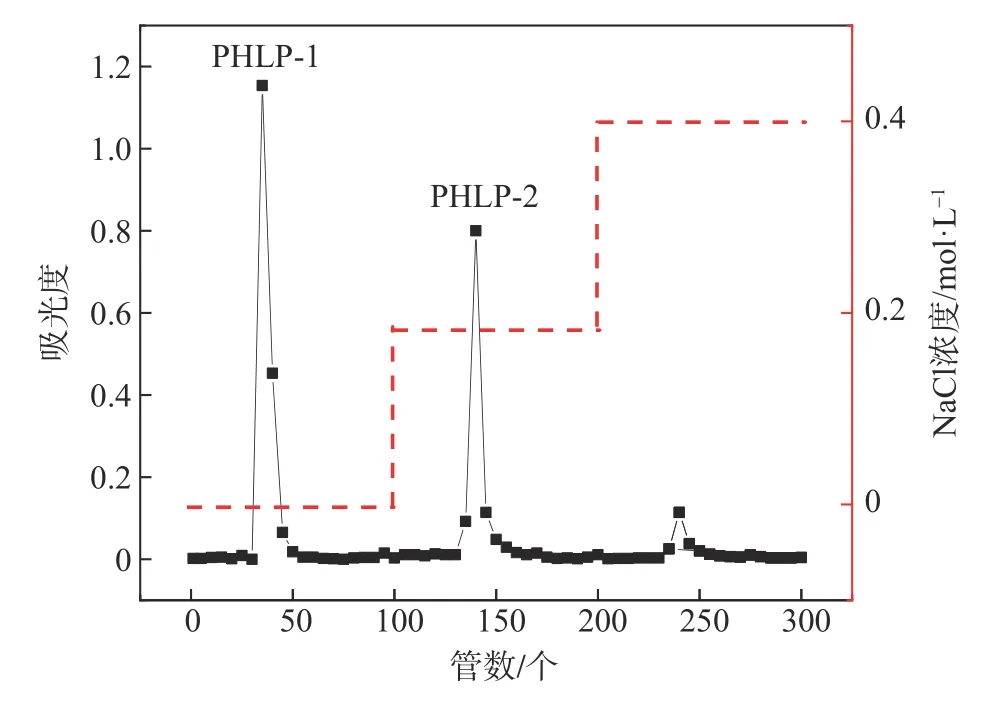
图2 多糖的DEAE-650M洗脱曲线Fig.2 Elution curve of crude polysaccharides on DEAE-650M
2.3 气相色谱-质谱联用分析
因糖类物质的极性较大,难以汽化,因此在使用气质联用分析多糖时,需要对糖进行衍生化处理,使其成为易于汽化的衍生物。本研究采用硅烷化法对5种单糖标准品进行衍生化,然后进行GC-MS 分析,结果如图3 和图4 所示。从图3 和图4 可以看出,从PHLP-1、PHLP-2中检测出5种单糖:阿拉伯糖、木糖、半乳糖、甘露糖和葡萄糖,其摩尔比分别为0.09∶1∶0.13∶0.07∶0.35和0.1∶1∶0.03∶0.09∶0.08。
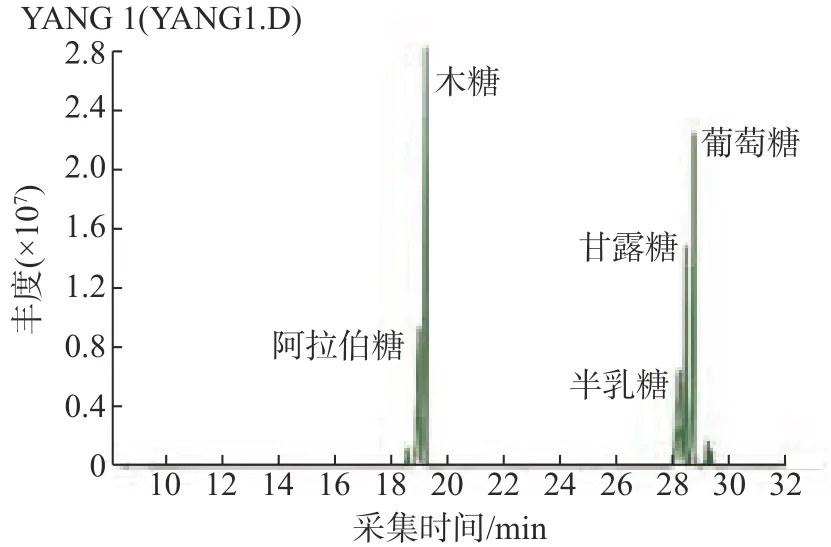
图3 单糖标准品的GC-MS色谱图Fig.3 GC-MS chromatogram of monosaccharide standard
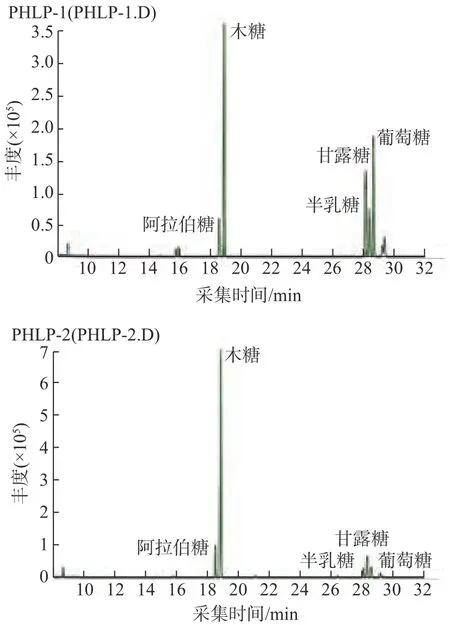
图4 多糖PHLP-1、PHLP-2的GC-MS色谱图Fig.4 GC-MS chromatogram of polysaccharides of PHLP-1,PHLP-2
2.4 红外光谱测定
图5 为PHLP-1 和PHLP-2 的FT-IR 图。如 图5 所示,PHLP-1 和PHLP-2 具有多糖的典型吸收带。3400 cm-1处为羟基伸缩振动峰,由多糖分子内或分子间的—OH 伸缩振动引起;2923 cm-1处是C—H 键的伸缩振动吸收峰;在PHLP-2 中,1735 cm-1处出现了1 个弱吸收峰,是由酯羰基(COOR)伸缩振动引起的,1600 cm-1处共有的强峰为羧酸酯振动峰,是由—COO—的伸缩振动引起,说明分子含有糖醛酸,表明PHLP-2 是酸性多糖[21];1400 cm-1处的中强峰代表羧基的存在;1120、1076、1045 及620 cm-1处出现的振动峰,是由吡喃糖的C—O—C 的特征骨架振动造成的[22];900 cm-1处的振动吸收峰,代表2 个多糖是以β-糖苷键连接的[23];但840 cm-1处左右有较弱的吸收信号,证明PHLP-1 中α-糖苷键的存在[24]。根据结果得知,PHLP-1和PHLP-2均含有吡喃环和β-糖苷键,PHLP-1 中含有α-糖苷键,PHLP-2 为没有α-糖苷键的酸性多糖。
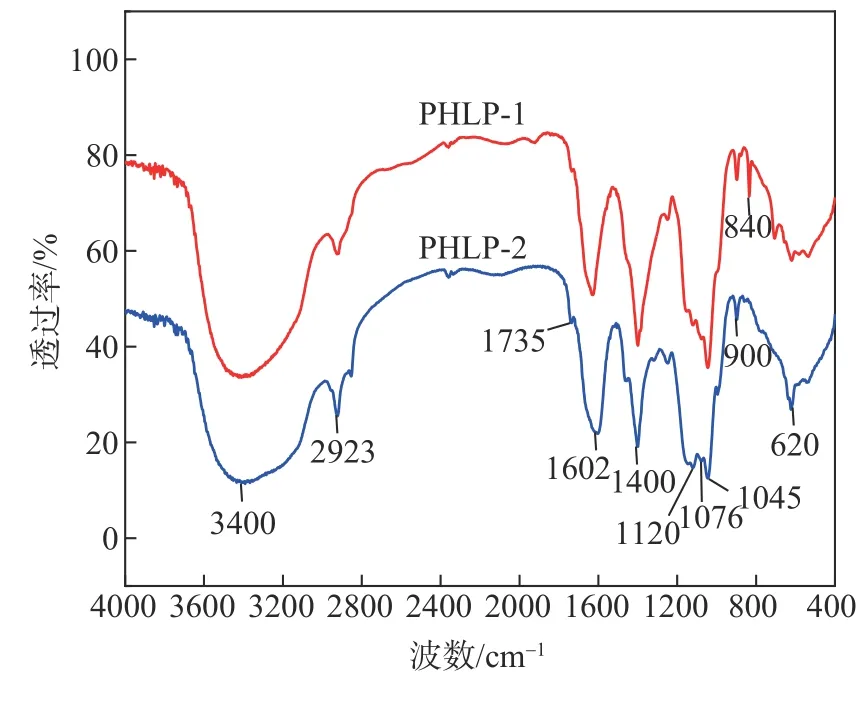
图5 PHLP-1、PHLP-2的FT-IR图Fig.5 FT-IR spectra of PHLP-1 and PHLP-2
2.5 形貌分析
图6 为多糖PHLP-1、PHLP-2 的SEM 图。从图6可以看出,PHLP-1 形态不一,比较杂乱;PHLP-2 呈疏松的碎片状结构,且表面比较光滑。SEM 图直观的说明了PHLP-1 和PHLP-2 均呈无序杂乱的结构形态。2 种多糖结构的差异性可能与其单糖组成比例不同有很大的关系[24]。

图6 多糖PHLP-1、PHLP-2的SEM图Fig.6 SEM images of polysaeeharides from PHLP-1 and PHLP-2
2.6 抗氧化活性分析
2.6.1 DPPH自由基清除活性
DPPH 自由基是一种常见的稳定自由基,常被用于评估抗氧化剂自由基清除能力[25]。DPPH 自由基在溶液中呈现深紫色,并且在517 nm左右有1个强吸收带,DPPH 自由基的清除机理是抗氧化剂提供的氢和电子,可以将DPPH 自由基还原为黄色,降低其在517 nm 处 的 吸 光 值[26]。图7 为PHLP-1、PHLP-2 及粗多糖对DPPH 自由基的清除能力。由图7 可以看出,PHLP-1 和PHLP-2 对DPPH 自由基的清除能力均随多糖浓度的提高而增强,且呈现明显的量效依赖关系。当多糖的质量浓度达到1 mg/mL 时,PHLP-1、PHLP-2 和粗多糖的DPPH 自由基清除率分别达到44.12%、47.79%和20.44%,但是它们清除DPPH 自由基的能力明显低于VC 清除DPPH 自由基的能力。其清除自由基能力强弱顺序为VC>PHLP-2>PHLP-1>粗多糖,IC50值依次为0.3×10-5、0.553、0.603、2.204 mg/mL,IC50值作为半抑制浓度,该值越小,代表自由基清除能力越强[20]。粗多糖由于其中含有的复杂成分较多,清除DPPH 自由基能力降低,影响了其抗氧化活性[27],因此清除能力低于PHLP-1 和PHLP-2。而PHLP-2 较PHLP-1 的清除自由基能力强的原因是PHLP-2为酸性多糖,其糖醛酸含量较高,可以活化异头碳上的氢原子,从而赋予其更高的抗氧化活性[28]。2.6.2 ABTS自由基清除活性
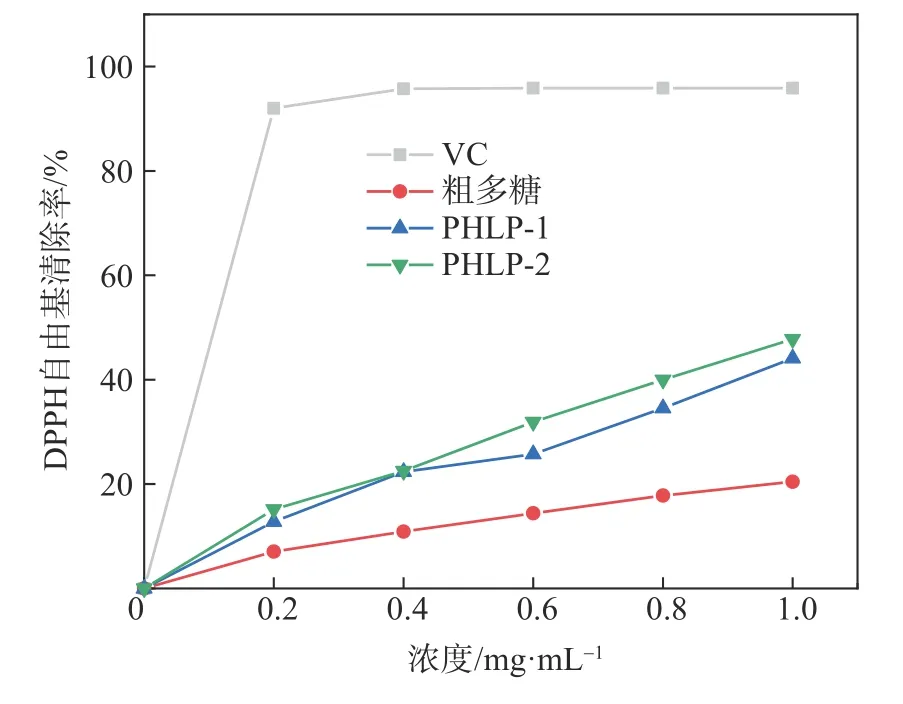
图7 PHLP-1、PHLP-2及粗多糖对DPPH自由基的清除能力Fig.7 DPPH radical scavenging activities of PHLP-1,PHLP-2 and crude polysaccharides
多糖作为供氢体可以和ABTS 自由基反应,通过反应后溶液吸光度值降低的大小,从而来判断多糖的抗氧化能力[29]。图8 为PHLP-1、PHLP-2 及粗多糖对ABTS 自由基的清除能力。由图8 可知,PHLP-1、PHLP-2 和粗多糖对ABTS 自由基具有一定的清除能力,且随着浓度的增加,清除率逐渐提高。当浓度达到1 mg/mL 时,PHLP-1、PHLP-2 和粗多糖的清除率分别达到67.62%、71.81%和31.05%,清除ABTS 自由基的能力弱于VC 清除ABTS自由基的能力。PHLP-2 对ABTS 自由基的清除能力最好,其次是PHLP-1,它们的抗氧化能力均大于粗多糖。PHLP-2、PHLP-1、粗多糖对ABTS 自由基清除浓度的IC50值依次为0.580、0.669、3.721 mg/mL。有研究[30-31]发现多糖中糖醛酸含量与自由基清除能力呈线性正相关,这与本研究的实验结果相吻合。此外Sun 等人[32]也报道了糖醛酸含量越高的黑木耳实体多糖其清除自由基的能力也越强。
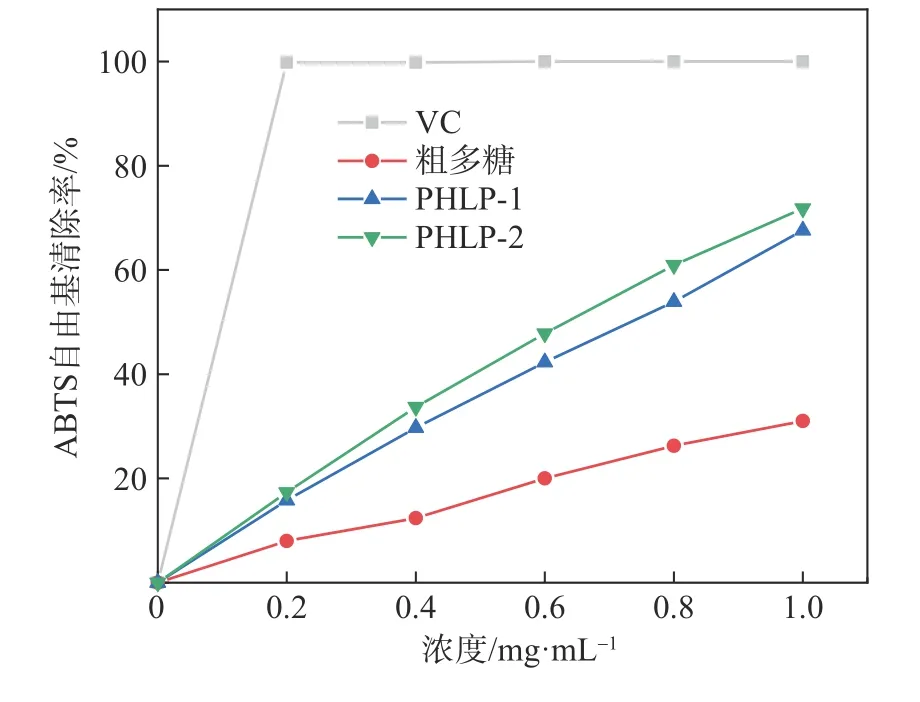
图8 PHLP-1、PHLP-2及粗多糖对ABTS自由基的清除能力Fig.8 ABTS radical scavenging activities of PHLP-1,PHLP-2 and crude polysaccharides
2.6.3 O2-自由基清除活性
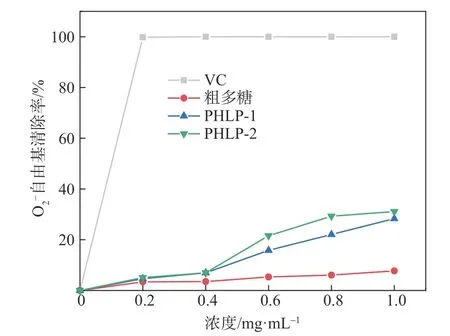
图9 PHLP-1、PHLP-2及粗多糖对O2-自由基的清除能力Fig.9 O2-radical scavenging activity of PHLP-1,PHLP-2 and crude polysaccharides
2.6.4 OH-自由基清除活性
OH-自由基是较为活泼的自由基之一,OH-自由基的存在可能会引起机体生物大分子氧化受损[36]。图10 为PHLP-1、PHLP-2 及粗多糖对OH-自由基的清除作用。由图10可知,PHLP-1、PHLP-2两种多糖组分对OH-自由基的清除能力均较弱。在1 mg/mL 时,PHLP-1、PHLP-2 和粗多糖的清除率分别为20.74%、22.70%和11.68%,明显低于同浓度下VC 的清除能力。PHLP-2、PHLP-1、粗多糖对OH-自由基清除能力 的IC50值 依 次 为6.932、7.216、89.857 mg/mL。PHLP-2 的OH-自由基清除能力略强于PHLP-1,这可能是由于PHLP-2的糖醛酸含量比PHLP-1较多,糖醛酸与反应溶液中的Fe2+螯合减少了羟基的生成[37]。
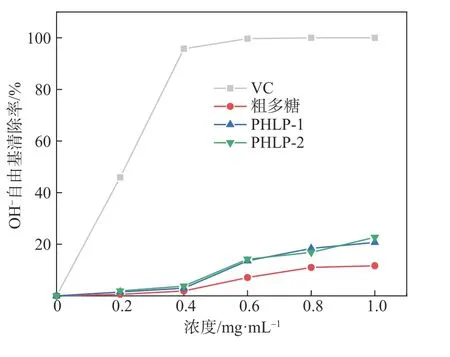
图10 PHLP-1、PHLP-2及粗多糖对OH-自由基的清除能力Fig.10 OH-radical scavenging activity of PHLP-1,PHLP-2 and crude polysaccharides
3 结 论
本研究采用醇沉法从桉木预水解液中提取半纤维素粗多糖(PHLP),并利用DEAE-650M 离子交换柱对其进行分离纯化,对纯化得到的中性多糖PHLP-1和酸性多糖PHLP-2两种组分进行分析。
3.1 单糖组分结果表明,PHLP-1 和PHLP-2 两种多糖均由阿拉伯糖、木糖、半乳糖、甘露糖及葡萄糖组成,其摩尔比分别为0.09∶1∶0.13∶0.07∶0.35 和0.1∶1∶0.03∶0.09∶0.08。
3.2 红外光谱测定表明,PHLP-1 和PHLP-2 均具有多糖典型的特征吸收峰,都含有吡喃环和β-糖苷键,并且PHLP-1 含有α-糖苷键,而PHLP-2 为不含α-糖苷键的酸性多糖。扫描电子显微镜观察PHLP-1 和PHLP-2均呈无序杂乱的结构形态。
3.3 抗氧化结果表明,PHLP-1 和PHLP-2 及粗多糖对DPPH 自由基和ABTS 自由基均具有较强的清除能力,对O2-自由基和OH-自由基的清除能力较弱,但是均呈现随质量浓度的增加清除率逐渐升高的现象,说明PHLP-1和PHLP-2具有一定的抗氧化潜力,其中PHLP-2的抗氧化活性高于PHLP-1。

