乙型肝炎病毒所致慢性肝病病人肝脏铁沉积和脂肪变性的MRI 定量研究
郭雅雯 王晓楠 曹宇 王瑞航 姚升娟 孙彤彤 倪红艳
乙型肝炎病毒(hepatitis B virus,HBV)感染是我国慢性肝炎最常见病因,病毒复制破坏肝功能加速病情进展,严重者可能出现终末期肝病而危及生命。铁代谢异常可诱发肝脏铁过载,导致氧化损伤和细胞死亡[1];脂肪变性会进一步加重肝损害,影响抗病毒治疗效果,甚至癌灶内脂肪含量与预后呈负相关[2-3]。因此,及时评估铁和脂肪水平对临床去铁治疗、纠正脂肪变性至关重要。MRI 多回波Dixon 序列是一种无创性评估脂肪含量和铁含量的检测技术,利用多峰模型实现水脂分离,可提高铁定量和脂肪定量的准确性,测量的脂肪含量和铁含量与肝脏穿刺结果具有高度一致性[4]。近年来,多回波Dixon 序列测得的R2*值常用于评估地中海贫血等病人的肝脏、心脏等脏器的铁沉积程度,质子密度脂肪分数(proton density fat fraction,PDFF)则多用于对2 型糖尿病、非酒精性脂肪肝等病人进行肝脏的脂肪含量研究,但尚缺乏对HBV 所致慢性肝病病人铁过载和脂肪变性的定量评估,而且铁代谢与肝脏脂肪变性对其肝功能的影响也少有报道。因此,本研究旨在基于多回波Dixon 序列定量评估HBV相关慢性肝病病人肝铁和脂肪的水平,并探讨R2*、PDFF 的变化与肝功能损伤之间的关系,以更好地指导临床决策。
1 资料与方法
1.1 一般资料 回顾性分析2020 年5 月—2021 年4 月在天津市第二人民医院行钆塞酸二钠(Gd-EOBDTPA)增强MRI 检查的97 例HBV 所致慢性肝病病人,包括男69 例,女28 例,年龄28~72 岁,平均年龄(51.2±10.2)岁,体质量指数(BMI)18.36~27.59 kg/m2,平均(23.6±2.3)kg/m2。其中,12 例存在肝脏铁沉积,10 例存在肝脏脂肪变性。纳入标准:①乙肝表面抗原(HBsAg)阳性>6 个月;②谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转移酶(gamma-glutamyltransferase,γ-GT)等肝功能指标持续或反复升高;③接受过超声造影或增强CT 检查。排除标准:①合并其他类型的肝病,如丙型病毒感染、自身免疫性、酒精性等因素所导致的肝病;②肥胖(BMI≥28 kg/m2)、有高脂血症、高血压、糖尿病、代谢综合征病史;③合并血液系统疾病,有既往输血史;④肝癌破裂出血、病灶内含坏死、囊变及钙化成分。根据临床诊断标准,97 例病人有44 例肝硬化(liver cirrhosis,LC)、32 例肝细胞癌(hepatocellular carcinoma,HCC)及21 例慢性乙型肝炎(chronic hepatitis B,CHB)。同期另外纳入年龄、性别和BMI 与病人组匹配的20 例正常对照者(normal control,NC),男15 例,女5 例,年龄33~68 岁,平均(49.7±14.4)岁,BMI 19.65~27.83 kg/m2,平均(23.7±1.8)kg/m2。NC 组的HBsAg 和丙型肝炎抗体(Hepatitis C virus-antibody,HCV-Ab)呈阴性,肝功能和腹部超声检查均未见异常。计算获得所有LC(即LC 组和HCC 组)病人的Child Pugh 评分。
1.2 设备与方法 采用Siemens Skyra 3.0 T MRI 设备,18 通道表面相控阵体部线圈。所有研究对象在扫描前禁食禁水4 h 以上,扫描时采取仰卧位,头先进,受检者双手置于身体两侧,扫描范围从膈顶到肝下缘。先采集三维容积内插水脂分离快速扰相(3D volumetric interpolated breath-hold examination qDixon,3D VIBE-qDixon)序列,扫描参数:TR 9.00 ms,TE 1.05、2.46、3.69、4.92、6.15、7.38 ms,FOV 450 mm×450 mm,翻转角4°,层厚3.5 mm,层面内采集像素1.4 mm×1.4 mm,带宽1 060 Hz,一次屏气期间采集全肝信息,扫描时间为13 s。随后按0.1 mL/kg体质量(相当于25 μmol/kg 体质量)注射Gd-EOBDTPA 对比剂(普美显,德国拜耳医药公司,质量浓度181.43 mg/mL),注射流率1.0 mL/s;再以相同的流率注射生理盐水30 mL。注药后分别于25 s、60 s、90 s、3 min、5 min、20 min 进行肝动脉期、门静脉期、肝静脉期、冠状移行期、移行期及肝胆期的肝脏多期动态扫描。
1.3 影像数据测量 由2 名中高年资(分别为9 年、22 年)放射科医师在Syngo MR E11 工作站上分别在3D VIBE-qDixon 获得的R2*、PDFF 后处理影像上勾画兴趣区(ROI),ROI 面积约为1 cm2。在8 个肝段上分别勾画ROI,避开病灶、大血管和胆管,测量所有肝段的R2*和PDFF,取其平均值作为肝脏的R2*和PDFF。分别记录2 名医师的测量结果用于一致性分析,并取高年资医师测量数据进行后续分析。对于HCC 病人,在病灶上勾画单个ROI,ROI 面积约为1 cm2,避开坏死、钙化及囊变成分,分别记录R2*和PDFF。3.0 T 场强下R2*>120 s-1视作铁沉积[5-6];PDFF>5%表示存在脂肪变性[7]。
1.4 诊断和分组标准 参照《慢性乙型肝炎防治指南(2019 年版)》[8]和《肝脏影像报告及数据系统(LIRADS)(2018 年版)》[9],根据病程进展的不同时期将病人分为3 组:①乙肝LC 组:MRI、CT、超声至少2种检查提示存在LC;②HCC 合并LC 组(简称HCC组),Gd-EOB-DTPA 增强MRI 考虑为HCC,并有增强CT 或超声造影支持诊断的结节(直径>2 cm),LI-RADS 评分4~5 分,同时应符合标准①;③CHB组:不符合①②者。
1.5 统计学方法 采用SPSS 26.0 软件进行数据分析。Kolmogorov-Smirnov 检验计量资料,符合正态分布的计量资料用均数±标准差(x±s)表示,非正态分布的计量资料用中位数和四分位数[M(P25,P75)]表示。2 组间比较采用配对t 检验;多组间比较采用单因素方差分析(正态分布)或Kruskal-Wallis 检验(非正态分布),组间进一步两两比较采用Bonferroni法。计数资料以例表示,多组间比较采用χ2检验。采用组内相关系数(ICC)评估2 名观测者测量结果的一致性,ICC<0.4 表示一致性较差,0.4≤ICC≤0.75表示一致性中等,ICC>0.75 表示一致性良好。采用Spearman 相关分析所有受试者肝脏R2*与PDFF 之间的相关性,以及所有LC(即LC 组和HCC 组)病人的Child-Pugh 评分与肝脏R2*、PDFF 之间的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 4 组间的基本临床资料比较 LC、HCC、CHB组分别有44 例、32 例和21 例病人,其中HCC 组共39 个病灶。4 组间性别、年龄、BMI 差异均无统计学意义(均P>0.05),详见表1。
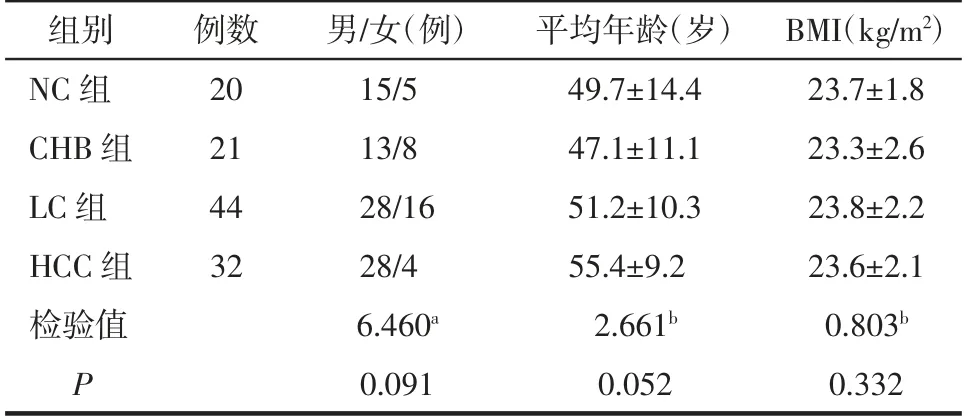
表1 4 组基本临床资料比较
2.2 2 名观测者测量结果的一致性分析 2 名观测者测量的所有受试者肝脏及肝癌病灶处PDFF 和R2*值一致性良好(均ICC>0.75),详见表2。

表2 2 名观测者测量PDFF 和R2*值的一致性分析 n=97
2.3 4 组间肝脏R2*、PDFF 的比较 4 组间肝脏R2*及PDFF 的差异均有统计学意义(均P<0.05),CHB组、LC 组和HCC 组肝脏的R2* 和PDFF 依次呈递增趋势。组间进一步两两比较显示,LC 组、HCC 组的R2*均高于NC 组(均P<0.05),HCC 组R2*高于CHB组(P<0.05);HCC 组PDFF 高于NC 组(P<0.05)。其余2 组间R2*和PDFF 的差异均无统计学意义(均P>0.05),详见表3。4 组受试者的多回波Dixon 序列影像见图1、2。

图1 肝脏最大层面及HCC 结节层面的PDFF 影像。A 图,NC,女,45 岁,肝脏呈低信号,平均PDFF 为1.33%。B 图,CHB,女,41 岁,肝脏呈低信号,平均PDFF 为2.80%。C 图,LC,男,56 岁,肝脏呈低信号,平均PDFF 为3.18%。D 图,HCC,男,57 岁,肝脏呈低信号,平均PDFF 为3.37%。肝癌结节与邻近正常肝组织未见明显差异。E 图,LC,男,37 岁,肝脏脂肪变性,肝脏呈稍高信号,平均PDFF 为5.02%。

表3 4 组肝脏R2*及PDFF 值的比较
2.4 HCC 组病灶与邻近正常肝组织R2* 和PDFF的比较 HCC 病人病灶处的R2*低于邻近正常肝组织(P<0.05),而两者PDFF 的差异无统计学意义(P>0.05),见表4。
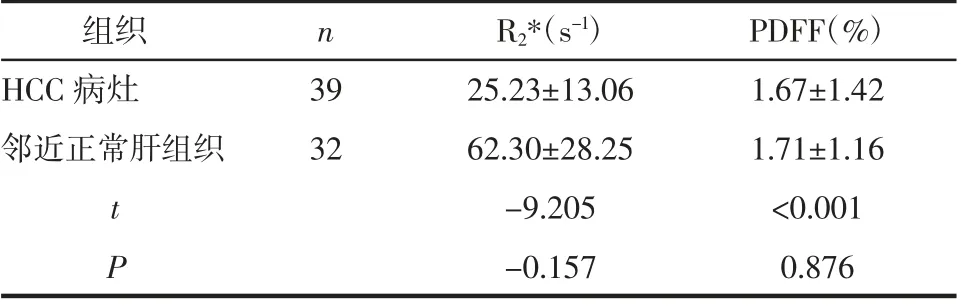
表4 HCC 组病灶与邻近正常肝组织R2*及PDFF 的比较
2.5 相关性分析 所有受试者的肝脏R2*与PDFF呈正相关(r=0.558,P<0.05),LC 病人肝脏R2* 与Child-Pugh 评分呈正相关(r=0.336,P<0.05),LC 病人肝脏PDFF 与Child-Pugh 评分无相关性(r=0.102,P>0.05),见图3。

图3 肝脏R2*、PDFF 与Child-Pugh 评分相关性散点图。A 图,所有受试者的R2*和PDFF 的相关性散点图。B、C 图分别为LC 病人Child-Pugh 评分与肝脏R2*、PDFF 相关性散点图。
3 讨论
HBV 所致慢性肝病会合并出现铁沉积和脂肪变性,本研究中的97 例病人中12 例出现肝脏铁沉积,10 例出现肝脏脂肪变性。铁和脂肪影响着肝病的进展和治疗结局,因此通过R2*和PDFF 的测量对肝脏铁浓度和脂肪含量的定量监测可提供有效信息以辅助临床诊疗。目前临床上对肝脏铁沉积程度的判断局限于血清铁蛋白的检测和病理检查,但血清铁蛋白受炎症、恶性肿瘤等因素影响,特异性差;而病理检查采样属有创性,难以被病人接受。肝脏脂肪沉积的测定受限于超声的主观评价,肝脏CT值的测量虽可反映脂肪肝的程度,但受辐射影响,重复性较差。3D VIBE-qDixon 序列所测得的R2*和PDFF 具有很好的准确性和可重复性。但目前对我国较为高发的HBV 病毒感染病人的研究较少,也缺乏对病人肝脏铁和脂肪含量与不同病理阶段、肝损伤程度相关性的研究。因此,本研究对所纳入的HBV 所致慢性肝病病人进行Gd-EOB-DTPA 增强MRI 检查,采用T1WI、T2WI、T1抑脂、T2抑脂、扩散加权成像(DWI)等常规序列进行HCC 诊断,并对其他类型结节(如局灶性结节增生、肝腺瘤、血管瘤、肝硬化异形增生结节等)以及HCC 结节内出血、坏死囊变等成分进行鉴别。本研究基于6 个回波时间的3D VIBE-qDixon 序列采用多峰脂肪模型实现水脂分离,混合多步自适应拟合和高级校正算法,一次扫描即可得到同相位、反相位、水像、脂像、R2* 和PDFF 6 种影像。R2*是T2*的倒数,由于铁的顺磁性使T2值缩短,R2*与铁浓度成正比;PDFF 是组织内三酰甘油质子密度与水和三酰甘油总质子密度的比值,代表组织的脂肪含量。既往研究[10-11]已证实,R2*和PDFF 对铁沉积和脂肪变性诊断能力较强且与肝穿刺活检结果高度一致;R2* 值和PDFF 不受炎症或纤维化的影响,2 种定量指标也不会互相影响,仅当肝脏铁沉积加重(R2*>430 s-1)时影像信号迅速衰减,从而干扰PDFF 的测量。本研究中不存在重度铁沉积病人,因此可认为测得的R2* 值和PDFF 真实可靠。考虑到纳入的病人病情程度不同,肝脏可能存在局灶性或弥漫性病理改变,本研究中勾画ROI 时在8 个肝段上各取一个1 cm2左右的ROI,反映肝脏整体的信息,在此基础上针对HCC病人的病灶勾画单个ROI 来反映局灶性变化。
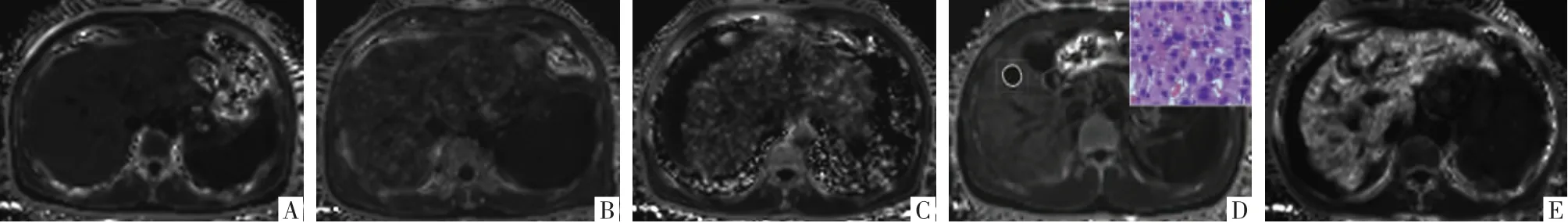
图2 肝脏最大层面及HCC 结节层面的R2*影像。A 图,NC,女,45 岁,肝脏呈低信号,平均R2*为45.02 s-1。B 图,CHB,女,41 岁,肝脏呈低信号,平均R2*为68.81 s-1。C 图,LC,男,56 岁,肝脏呈稍高信号,平均R2*为112.78 s-1。D 图,HCC,男,57 岁,肝脏呈稍高信号,邻近正常肝组织的R2*为84.17 s-1,勾画的范围为经Gd-EOB-DTPA 增强MRI 和病理同时确诊的肝癌结节,彩图为其病理图(HE,×400),部分组织肝板增厚,细胞排列紊乱,Hep-1 阳性,符合高分化HCC,其R2*为15.21 s-1。E 图,LC,男,58 岁,肝脏铁沉积,肝脏呈高信号,平均R2*为155.02 s-1。
本研究中CHB、LC 和HCC 3 组病人的肝脏R2*值呈递增趋势,LC 病人R2*与Child-Pugh 评分呈正相关,表明肝脏铁含量在HBV 相关性肝病的发生中随着疾病程度加重而增加,铁负荷可能协助病毒加重肝功能损伤。HBV 感染者中血清铁、铁蛋白较正常者升高,转铁蛋白降低,提示HBV 与铁代谢有着密切关系,病毒感染影响机体的铁稳态调控,HBV 病人铁调素表达下调,炎症刺激下促炎细胞因子上调铁蛋白表达,共同作用下诱发铁沉积[12]。Child-Pugh 评分反映LC 病人的肝细胞受损情况和功能状态,分值越高,代表肝脏储备功能越差。Gao等[13]分析318 例HBV 相关肝病病人的铁代谢水平,发现血清铁蛋白随Child-Pugh 评分升高而升高,这与本研究结果一致。肝脏沉积的铁促进氧化应激反应,激活肝星状细胞诱发肝纤维化,对肝细胞的细胞膜和细胞核产生毒性,从而导致肝功能障碍,增加失代偿期LC 以及肝癌等终末期肝病的风险。
本研究中HCC 组的肝脏PDFF 高于NC 组,LC病人PDFF 与Child-Pugh 评分无相关性。笔者推测HCC 组的PDFF 升高可能是由于HCC 代谢活跃,血供代偿不足导致细胞乏氧,进而引起的脂肪变性。脂肪肝可由“非乙醇”因素(胰岛素抵抗和代谢紊乱)与乙醇、基因3 型丙型肝炎病毒感染等因素引起。而HBV 与脂肪肝的关系至今仍存在争议,如肝脂肪变性是病毒本身、代谢因素还是两者共同作用所致,脂肪变性是否与HBV 感染病情进展互相作用。一些研究[14-15]发现肝细胞脂肪变性与年龄、BMI、血脂及血糖水平等宿主代谢因素有关,与HBV DNA水平和HBeAg 状态无明显相关性,甚至有研究[16]显示HBV 病毒感染可降低非酒精性脂肪肝的风险;而在动物实验中发现HBV 编码的HBx 蛋白诱导肝细胞内脂质基因合成脂酶类的表达,还可干扰胰岛素信号通路,这可能是引起肝细胞脂肪变性的分子机制[17]。
本研究结果显示,HCC 病人病灶R2*显著低于邻近正常肝组织。有研究者[18]对HBV 阳性HCC 病人的术后标本行铁染色分析,结果显示癌灶未见铁染色,铁多沉积于癌周组织。铁是细胞增殖的必需元素,参与新陈代谢的众多环节,癌细胞迅速增殖导致旺盛的铁需求可能是HCC 病人病灶铁廓清的发生机制。本研究显示病灶PDFF 与邻近正常肝组织PDFF 相比差异无统计学意义,而Jiang 等[19]研究发现肝癌不同阶段结节内脂肪成分先增加后减少。可见,脂肪在肝癌进展中的作用目前尚无定论,有待进一步研究。
本研究中R2*值与PDFF 呈正相关。由于铁过载会使活性氧增加,对于大分子,尤其是脂质分子进行氧化,脂质活性氧通过促进脂滴的形成从而引起肝脏脂肪变性。一项针对丙型病毒肝炎病人的研究[20]发现,部分研究对象同时表现出血清铁指标升高和脂肪变性,且铁蛋白与脂肪变性程度高度相关。因此,可以认为铁和脂肪在对促进肝脏细胞损伤上具有协同作用,即超负荷的铁元素能加快HBV复制,诱导脂质发生过氧化反应,其产物能够刺激肝细胞胶原的合成,进而加重肝损伤。
本研究尚存一些局限性:①考虑到病人的接受度,只有少数病人行肝穿刺活检,因此没有基于病理诊断进一步区分肝纤维化组,缺乏MRI 参数与病理结果的对照;②每组样本量不均。有待继续扩充CHB 病人和HCC 病人的样本量,总结铁沉积和脂肪变性的变化规律,探寻脂肪在HCC 结节进展中的作用。
综上所述,HBV 所致慢性肝病病人可出现肝脏铁沉积和脂肪变性,肝脏铁浓度和脂肪含量在疾病的不同阶段存在差异,癌变病灶表现为肝脏富铁背景下的乏铁灶。

