3D肝细胞遗传毒性检测方法的建立
王敬亭,赵田田,赵泽浩,周长慧,李嫚琪,杨紫轩,何伟伟,常 艳
(1.中国医药工业研究总院上海益诺思生物技术股份有限公司,上海 201201;2. 复旦大学药学院,上海 201203)
当前3D细胞培养技术已经成为体外毒性检测的一个主要的发展方向[1]。3D细胞模型可在体外模拟体内微环境,与2D细胞相比在维持组织的形态和功能特征方面都有显著的改善。与此同时,使用3D细胞培养技术符合“减少、替代、优化”3R原则的要求。
目前已经建立的3D肝细胞模型有多种,如肝细胞球体模型、肝微图共培养模型、生物反应器模型、生物打印、灌注肝芯片模型以及微流控芯片[2]等。80%的已发表文献使用3D肝球状体模型用于体外毒性筛选[3],目前进行毒性评价的3D肝细胞球状体是最简单的3D体外细胞模型。3D细胞球体是细胞产生了包括纤维连接蛋白和胶原蛋白在内的几种关键蛋白,形成细胞间黏附,进而自组装形成的致密聚集体。与传统的2D细胞培养相比,3D细胞球体的优点是具有更好地模拟与细胞生长和细胞信号转导高度相关的细胞外微环境的能力;培养方式简单并可实现多种细胞共培养;形成的球体稳定,重复性好;可以实现高通量和高含量的药物筛查。已有证据表明,无支架培养方式培养的HepG2细胞球状体重新获得了肝细胞功能,如糖原的储存、胆盐的运输和类似胆汁小管的结构的形成,可使白蛋白、尿素、异种生物转录因子、Ⅰ期和Ⅱ期药物代谢酶和转运体表达增加、细胞色素P450介导的代谢明显高于单层培养的肝细胞[4]。目前,已有少量文献应用HepG2细胞或HepaRG细胞构建球体模型对化合物进行遗传毒性评价[5-7]。
本研究拟建立一种新的3D肝细胞模型,并选用研究最为充分的人源化肝细胞HepG2细胞作为该模型的细胞系,再将已建立的3D肝细胞模型与体外微核试验及体外彗星试验结合,采用模式化合物分别建立3D肝细胞体外微核试验方法及3D肝细胞体外彗星试验方法,探索3D肝细胞模型在体外遗传毒性检测方面的应用潜力。
1 材料与方法
1.1 材料
1.1.1细胞及主要试剂 HepG2细胞购自中国科学院上海生科院细胞资源中心。MMC(批号:AKZ80-NO)、MMS(批号:S4831975)均购自美国Sigma公司;Cyto-B(批号:654530)购自MCE公司;高糖DMEM培养基(货号:11995-065)和0.25%胰酶-EDTA消化液(货号:25200-012)购自美国Gibco公司;100×青链霉素混合液(货号:15140-122)、荧光素二乙酸二酯(Fluorescein diacetate,FDA,货号F1303)、碘化丙啶(propidium iodide,PI,货号P1304MP)、SYBR Gold染液(货号:S11494,批号:2174893)均购自美国Invitrogen公司;尿素试剂盒(货号:DIUR-500T)、白蛋白(BCG法)试剂盒(货号:DIAG-250T)均购自美国BioAssay Systems公司;miRNeasy Mini小型提取试剂盒(批号:163052565)购自美国QIAGEN公司;Evo M-MLV反转录试剂预混液(批号:A2A0216)、ROX Reference Dye 染液(20 μmol·L-1)(批号:A1A0850)、SYBR Green Pro Taq HS 预混型qPCR试剂盒(批号:A3A0768)均购自湖南艾科瑞生物工程有限公司;引物购自美国Thermo公司;彗星试验裂解液(批号:33489G15)、彗星试验低熔点凝胶(批号:1548656)购自美国R&D Systems公司;CellTiter-Glo®3D Cell Viability Assay(货号:G9681)购自美国Promega公司;Giemsa染液(货号:G1015)购自北京索莱宝科技有限公司等。
1.1.2主要仪器 细胞培养箱(Thermo Scientific FORMA STERI CYCLE CO2Incubator)、荧光定量PCR仪(AB/stepone)、生物安全柜(AIRTECH苏净安泰/BSC-1600 A2)、荧光酶标仪(Molecular Devices,IX6)、酶标仪(Molecular Devices,SpectraMax i3);光学显微镜(Olympus,CX21和BX51);彗星电泳仪(Trevigen)。
1.2 实验方法
1.2.12D和3D细胞培养方法 复苏HepG2细胞,培养于DMEM完全培养基,在37 ℃,5% CO2培养箱中维持培养。将生长状态良好的细胞以20 μL/滴、分别以5×107、1.25×108、2.5×108个·L-1的密度,接种至倒置培养皿盖内侧,皿底加PBS,单层置于培养箱。d 3转移至超低吸附96孔U形底板中,培养14 d,得到3D肝细胞。
1.2.23D肝细胞模型的建立 当细胞单层汇合度达到80%~90%时,将平铺生长的HepG2细胞消化后制成细胞悬液至15 mL的EP管中备用,并稀释到相应密度5×107、1.25×108、2.5×108L-1。预先在100 mm细胞培养皿底加入10 mL PBS缓冲液。使用多通道移液器,将上述细胞密度的细胞悬液以20 μL/滴接种至倒置的100 mm培养皿盖内侧,每个皿盖可接种50滴。轻轻翻转皿盖置于皿底,并将含有悬滴的皿转移至二氧化碳培养箱内,单层水平放置。培养3 d后,悬滴内部形成初始接种数为1×103、2.5×103、5×103个/滴的细胞球体。d 3时,将悬滴内球体转移至超低吸附U形底96孔板中继续培养,隔天更换一半培养基,直至d 14。
1.2.2.1 球体形态观察 收集适当数目球体(n=8),吸去上清液,用HBSS清洗2次;室温下加入40 mg·L-1PI和20 mg·L-1FDA染液染色5 min;随后吸去染液,用HBSS洗涤球体。荧光显微镜下观察球体生长及随时间的变化,使用DP2-BSW软件测量球体直径及面积。
1.2.2.2 上清液尿素和白蛋白含量测定 上清液尿素和白蛋白浓度按检测试剂盒说明书进行检测,分别在430 nm、620 nm测定吸光度值,计算得到尿素和白蛋白浓度。
1.2.2.3 Ⅰ 相及 Ⅱ相代谢酶基因表达量测定 将2D HepG2细胞及d 3、d 7的3D细胞球进行消化,测定细胞数量,提取RNA,并进行反转录(37 ℃ 15 min ;85 ℃ 5 s;4 ℃);使用SYBR Green®Premix Pro Taq HS qPCR Kit试剂与引物(Tab 1)及上步反应制得的cDNA产物按比例预混,在Step One荧光定量PCR仪95 ℃ 30 s,1次循环;95 ℃ 5 s,60 ℃ 30 s,40次循环,每样本检测3个复孔。根据RT- PCR检测结果,以2D细胞样品的基因表达作为对照,采用ΔΔCT法计算出各待测物的待测基因相对于内参基因β-actin的相对表达量。

Tab 1 Primer sequences of Ⅰ phase and Ⅱ phase metabolic enzymes
1.2.33D肝细胞模型微核组学试验方法的建立 CBMN-cyt的测定按照体外哺乳动物细胞微核试验(OECD TG487, 2016)指南推荐的方法进行[8]。
1.2.3.1 阳性细胞模型的建立
1.2.3.1.1 2D细胞模型建立 每孔接种1×105个HepG2细胞于细胞培养板中,24 h后调整为含阳性对照(MMC)及终浓度为5 mg·L-1cyto-B的培养液。0、0.012 5、0.025、0.05、0.1和0.2 mg·L-1MMC均平行处理2孔。
1.2.3.1.2 阳性3D肝细胞模型建立 后续试验使用3D细胞均为5 000个细胞/20 μL/滴,培养7 d 3D细胞球,尽可能吸去ULA96孔板原培养基,每孔分别加入0、0.012 5、0.025、0.05、0.1和0.2 mg·L-1MMC及终浓度为5 mg·L-1cyto-B的培养液,平行处理2孔。2D和3D肝细胞模型处理约48 h(>1.5个倍增周期)后弃去培养液。
1.2.3.2 制片及染色 收获各个处理组的细胞,用37 ℃预热0.56%氯化钾室温低渗细胞3~5 min,逐滴缓慢加入甲醇:冰醋酸(V/V=3 ∶1)3 mL固定,固定结束后离心,固定步骤重复2次。用离心管剩余少量固定液轻轻重悬细胞,以备滴片,室温干燥。最后用Giemsa染液染色,封片保存。
1.2.3.3 显微镜检指标 每张玻片计数每1 000个双核细胞中微核(micronucleus,MN)、核芽(nuclear buds,Nbud)和核质桥(nucleoplasmic bridges,NPB),将同组两张玻片(共2 000个双核细胞)相加,计算双核细胞MN、Nbud和NPB出现的千分率,并根据Fenech方法评分[9]。同时计数500个细胞中单核细胞、双核细胞及多核细胞数,计算胞质分裂阻滞增殖指数(cytokinesis-block proliferation index,CBPI)和复制指数(replicative index,RI)。

1.2.43D肝细胞模型彗星试验方法的建立
1.2.4.1 细胞活力检测 2D HepG2细胞在白色不透明底96孔平板中以1×104个/孔的密度接种后,培养24 h。2D和3D细胞使用不同浓度MMS(0、2.75、5.5、11、22 mg·L-1)处理24 h后,按照CellTiter-Glo 3D试剂盒步骤进行细胞活力检测,测得相对发光值(elative light unit, RLU)并计算细胞活力。
1.2.4.2 制片、裂解、解旋、电泳、染色和观察 在2D和3D肝细胞模型中分别加入含不同浓度MMS(0、2.75、5.5、11、22 mg·L-1)的培养液。含溶媒的完全DMEM培养基为溶媒对照组,作用约24 h后弃去培养液并收集细胞,胰酶消化后制成单细胞悬液,加入预冷DPBS并调整细胞密度至(4~6)×108·L-1。
将适量细胞悬液与预温至37 ℃的低熔点胶混合,涂片,每组设4个复孔。随后浸入预冷的裂解液中于2~8 ℃过夜裂解(16 h)随后解旋20~30 min,电泳20 min,电泳条件为15 V,(300±10) mA。电泳后的玻片经中和、无水乙醇脱水、干燥和荧光染色后采用Comet assay IV彗星分析软件分析各浓度彗星尾DNA%。
1.3 统计学分析尿素、白蛋白、RT-PCR的结果均采用独立样本t检验的方法,3D肝细胞模型微核组学试验采用Fisher精确检验;3D肝细胞模型彗星试验细胞活力测定中,将RLU值根据公式换算成细胞活力,采用单因素方差分析(ANOVA)方法将各组数据与阴性对照组进行比较;彗星试验结果计算每孔75个细胞的彗星尾DNA%的中位数,将受试物各剂量组的尾DNA%与溶媒对照组的尾DNA%进行单因素方差分析(ANOVA)。
2 结果
2.1 3D肝细胞模型建立3D肝细胞球体及常规培养细胞的显微镜观察结果显示悬滴培养3 d的HepG2细胞在重力的作用下,自聚集形成了一个质地紧密的细胞球体(Fig 1)。不同初始接种细胞密度的细胞球体在d 1~14均能保持良好的球体形态(Fig 2)。随着培养时间的延长,细胞球体的直径和面积迅速增大,d 7时增长逐渐缓慢,细胞球趋于稳定(Fig 3A,B)。

Fig 1 2D HepG2 cells and 3D HepG2 spheres cultured for three days

Fig 2 Effect of initial seeding cell density on spherical growth and morphology
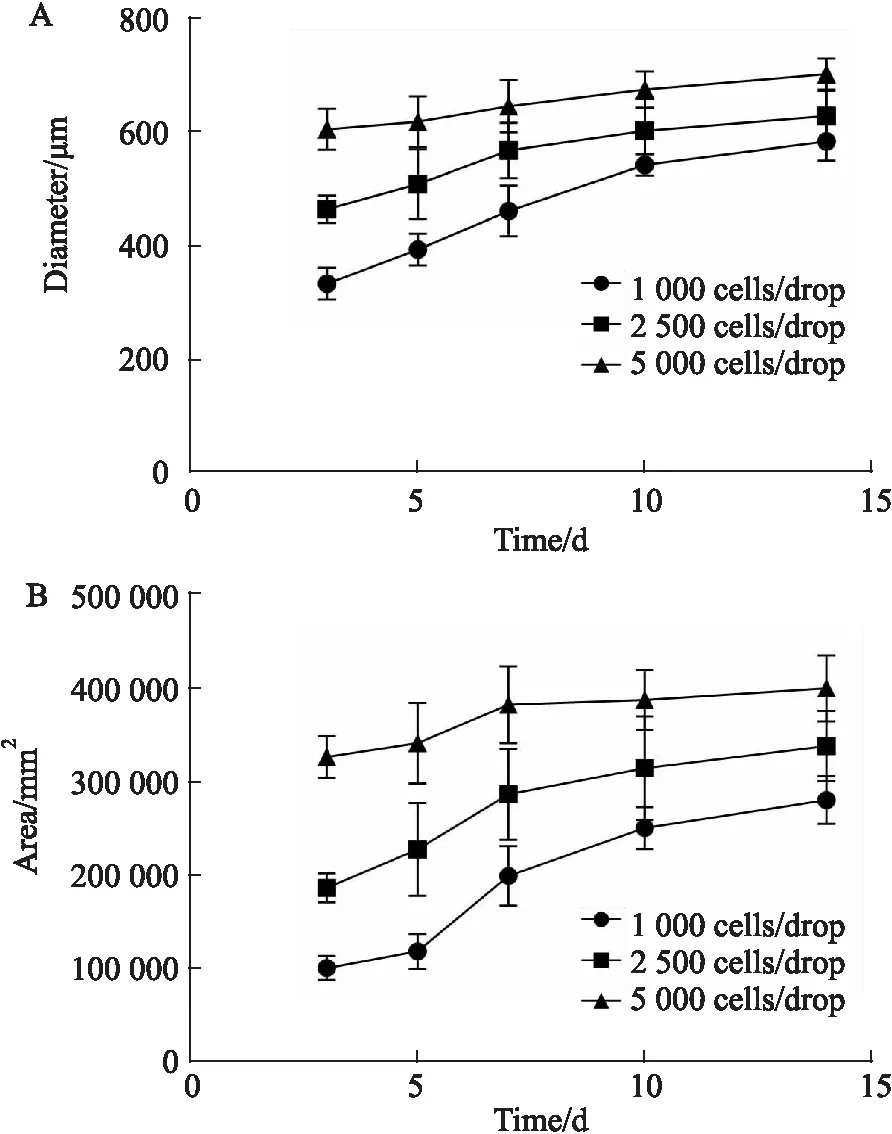
Fig 3 Change of diameter and area of sphere with incubation time
将大小相近但培养天数不同的两个细胞球体进行对比,d 3和d 14的FDA染色结果相近(Fig 4A,C),提示随着培养时间的延长,球体内细胞仍然存活;d 3的PI染色的红色荧光较暗(Fig 4B),而d 14的红色荧光较强; 提示随着培养时间的延长,球体内部会逐渐形成坏死核心(Fig 4D)。

Fig 4 Cell survival rate and internal growth of 3D spheroids
使用白蛋白产生及尿素水平为检测指标,比较不同培养方式的HepG2细胞的肝脏特异性功能的区别,数值归一化为1×106个细胞。通过对d 3~14上清液样本的测量,与2D细胞相比,3D培养的细胞上清白蛋白浓度显著升高,d 7为最高值(Fig 5)。同时,3D球体上清的尿素含量在d 7达到最高值(Fig 5)。由于d 3、d 7的3D细胞球显示出了更好的细胞功能,且培养时间较短,因此进一步选择d 3、d 7的3D细胞球与2D细胞Ⅰ、Ⅱ期代谢酶基因表达量对比,选择合适的3D细胞培养时间。

Fig 5 Comparison of urea and albumin concentration in supernatant between 2D cell model and 3D cell model with different culture time
实时荧光定量PCR分析结果显示,3D HepG2球状体中不同Ⅰ、Ⅱ期代谢酶的表达水平普遍高于2D培养的HepG2细胞(Fig 6)。系统分析球形体培养过程中I相代谢酶mRNA的转录水平。培养天数为7 d的3D HepG2细胞的CYP1A1、CYP2C9、CYP2D6 、UGT1A6表达水平与2D细胞相比显著性升高。

Fig 6 Real-time fluorescence quantitative PCR analysis of metabolic enzymes in 2D and 3D cultures
3D细胞最佳培养条件为5 000个细胞/20 μL/滴接种,培养7 d,作为接下来方法建立阶段的3D细胞培养条件。
2.2 微核组学实验结果2D模型组4个处理浓度下的MN‰、0.05、0.1 mg·L-1浓度组的Nbud‰显著升高(P<0.05),具有浓度相关性,NPB‰在0.025~0.1 mg·L-1有显著性差异,但没有浓度相关性(Tab 2)。3D肝细胞微核细胞组学各浓度的Cytostasis及RI与2D肝细胞模型组相当。3D肝细胞模型组4个MMC处理浓度下的MN‰与Nbud‰均见显著升高(P<0.05),NPB‰各浓度组均未见显著升高(Tab 3)。3D模型组MMC的MN‰及Nbud‰最低检出浓度为0.012 5 mg·L-1,而2D模型组最低检出浓度为0.025 mg·L-1。

Tab 2 2D hepatocyte CBMN-cyt assay results of MMC

Tab 3 3D hepatocyte CBMN-cyt assay results of MMC
2.3 彗星实验结果2D与3D肝细胞模型经MMS处理24 h后同时进行细胞活力和DNA损伤检测。0~22 mg·L-1各浓度 MMC同时作用于2D与3D细胞模型24 h后,2D和3D肝细胞模型组均未出现明显的细胞毒性(Fig 7)。

Fig 7 Effect of MMS on 2D and 3D hepatocyte models’ cell viability
HepG2单层和球形细胞经MMS处理24 h后经DNA损伤检测结果显示。2D和3D培养物的溶剂对照的尾DNA%背景水平在相同的范围内。在2D模型组中,22.0 mg·L-1MMS组的DNA损伤相对于对照组明显增加(P<0.05)。在3D模型组中,5.5 mg·L-1MMS组的DNA损伤相对于对照组明显增加(P<0.01)(Fig 8)。
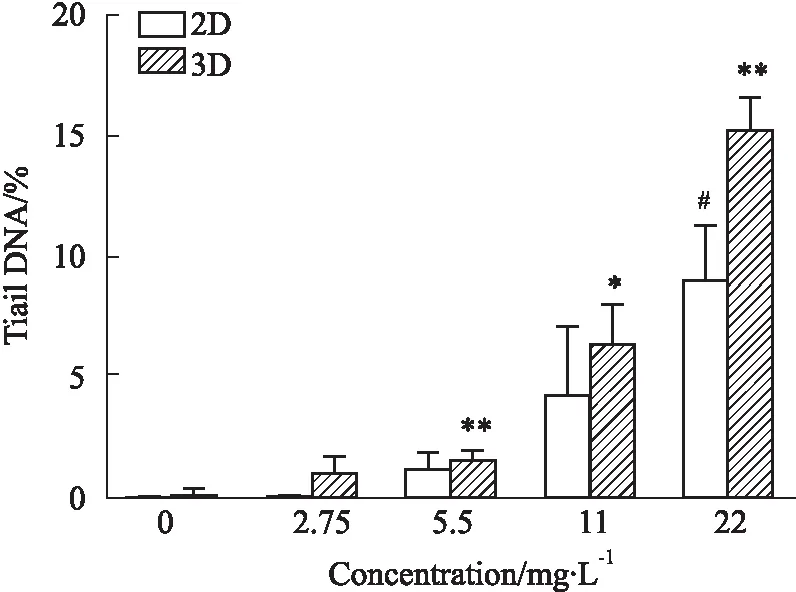
Fig 8 DNA damage in MMS exposed 2D and 3D hepatocyte models measured by comet assay n=4)
3 讨论
3.1 3D肝细胞模型的建立目前体外哺乳动物细胞模型的主要缺陷是未能充分反映人体内的毒性反应。本研究中,采用人肝癌细胞系HepG2细胞作为材料,使用悬滴与超低吸附培养结合的无支架培养方式构建了3D细胞模型。该方法与标准96孔试验板和自动化设备的兼容性使其适合于高通量的毒性筛选。建立3D肝细胞模型的影响因素包括以下几个方面:(1)细胞:细胞自身代谢能力与培养成本影响后续实验模型的可用性。HepG2细胞是研究最为充分的人源化肝细胞,具有一定自身代谢活化能力与低培养成本的优点。(2)培养基:培养基成分的改变会影响实验重复性,3D细胞培养选用与常规2D培养相同的培养基。(3)培养方式:已有的建立3D肝细胞遗传毒性检测模型采用悬滴法进行培养[6],但由于营养物质减少且无法更换培养基,不适用于长期培养及后续添加试剂进行细胞活力和遗传毒性检测[10]。在本研究中,将悬滴培养至3 d的细胞球体接种至ULA超低吸附96孔板中继续培养,可以实现延长培养时间。(4)初始细胞接种数:初始细胞接种数影响球体大小及细胞团内外的物质运输的能力。以现研究数据为依据[6,10],本研究选择(1~5)×103个细胞/20 μL/滴作为细胞接种条件,使用显微镜观察及免疫荧光染色法来观察细胞球的生长规律及内部细胞坏死情况,选择最佳的接种数。对同时接种的HepG2球体进行连续观测拍照记录3、5、7、10、14 d的细胞球面积及直径发现,细胞球体的直径和面积随培养时间延长迅速增大,在d 7时增长逐渐缓慢,细胞球趋于稳定。5×103个/滴的球体增长平稳,球体形态在培养过程中更为为稳定。用FDA和PI染色对活细胞(绿色)和死细胞(红色)染色,在荧光显微镜下进行观察,可以看到随着培养时间的延长,球体内部由于物质转运受阻逐渐形成坏死核心。综合对3D细胞球体长期生长状态及活死细胞的观察,最终选择初始接种条件为5×103个细胞/20 μL/滴进行后续实验。该培养条件下球体直径控制在500~700 μm,在已有研究对于3D细胞球体的参考直径范围内[11-12]。球体形态稳定,且可实现长期培养,满足后续彗星和微核试验所需细胞数。(5)培养时间:肝细胞球体的形成、维持和成熟需要一定的培养时间,可使细胞产生与人体细胞更为接近的生理功能。本实验中,同一球状体的形态变化是从质地松散的不规则球体逐渐压实成质地紧密形状规则的椭球体,7 d后球体增长趋势变缓,与文献中的描述一致[13]。由于球体微结构和功能的进一步分化会改变物质向球体内部扩散的效率和影响药物代谢,因此球体的生长会直接影响药物的作用。白蛋白的产生、尿素的分泌是肝脏代谢活动的一个指标,结合尿素及白蛋白的测量结果,d 7为肝特异性产物表达最高的培养时间,提示HepG2细胞在3D培养环境中发生了聚集与分化,具备了一定的代谢功能,3D环境更有利于细胞功能的产生。通过Ⅰ相及Ⅱ相药物代谢酶基因RT-PCR结果分析,培养7 d的3D HepG2细胞的CYP1A1、CYP2C9、CYP2D6表达水平与2D细胞相比显著性增加。
综合建立3D肝细胞模型的影响因素,3D肝细胞模型的最佳培养条件为5 000个细胞/20 μL/滴接种,培养7 d。基于动物伦理学 “减少、替代、优化”3R原则,3D细胞培养技术有望发展成为替代动物实验的体外实验方法。
3.2 3D肝细胞微核组学试验方法MMC作用于2种细胞模型,细胞毒性指标100-RI与Cytostasis都出现浓度相关性上升,2种细胞模型均出现相似程度的细胞损伤。3D模型组MMC的MN‰及Nbud‰最低检出浓度为0.012 5 mg·L-1,而2D模型组最低检出浓度为0.025 mg·L-1,提示3D细胞模型在检测MMC时,MN及Nbud灵敏度高于2D细胞模型。NPB‰未在3D细胞模型该浓度范围内有显著性差异,在2D细胞模型中检出但不具有剂量相关性,且NPB的值落在外周血淋巴细胞CBMN-cyt试验0~10‰的阴性参考范围内[14]。提示MMC可能在HepG2细胞中未通过诱导DNA链断裂错误和端粒末端融合造成遗传毒性损伤。与已有HepG2及衍生细胞系的微核细胞组学研究结果相似[9,15]。即2D及3D培养的HepG2细胞模型经MMC处理后可于一定细胞毒性范围内检测到微核细胞组学指标明显升高。
本研究使用MMC同时作用于2D和3D肝细胞模型,成功建立了3D肝细胞微核组学试验方法。MMC是一种抗肿瘤药物,体外微核试验为阳性。它作为一种烷基化剂可以交联互补的DNA复制体,从而影响核酸的合成和功能。MN、NPB和Nbud是癌症中常见的核异常现象,代表一种常见的染色体不稳定的细胞表型。染色体不稳定会导致细胞的基因量改变,并具有迅速进化和突变的潜力,从而形成各种异常的基因型[16]。
3.3 3D肝细胞彗星试验方法在非细胞毒性浓度下,MMS能够诱导2D和3D HepG2培养物的尾DNA%增加,并具有浓度相关性。2D模型22 mg·L-1MMS组与3D模型 5.5 mg·L-1MMS组与对照组相比尾DNA%差异均有显著性。3D肝细胞模型对MMS遗传毒性检测灵敏度高于2D细胞。同时发现,与传统的二维单层细胞培养相比,3D肝细胞彗星尾DNA%具有更高的离散度(Fig 9)。这是由于3D细胞球体作为一个整体暴露于化合物时,不同部分细胞的化合物暴露水平不一,因此受到的DNA损伤水平不一。

Fig 9 2D and 3D hepatocyte comet assay tail DNA% scatter distribution diagram(MMS 22 mg·L-1, n=75, median and range)
本研究使用MMS同时作用于2D和3D肝细胞模型,成功建立了3D肝细胞彗星试验方法。MMS是一种甲基化DNA碱基的诱变化合物,可导致DNA单链断裂、染色体断裂、微核形成,最终导致细胞死亡[17]。3D肝细胞模型应用于彗星实验,减少了体内研究和基于2D细胞培养的体外彗星试验数据之间的差距。
3.4 总结本文初步建立了悬滴法与超低吸附培养相结合的3D HepG2细胞模型,基于3D肝细胞模型的微核细胞组学和彗星试验方法也表现出较高灵敏度。与标准96孔试验板和自动化设备的兼容性使其适合于高通量的毒性筛选,提高了其安全性评估研究的总体适宜性。

