葛根素对棕榈酸诱导胰岛MIN6细胞损伤的保护作用
陈 铭,莫广艳,叶 溪,徐小惠,高雨桐,张晓琳,吴娅妮,韦秀莎,黄仁彬,梁 韬
(1.广西医科大学药学院,2.广西壮族自治区人民医院,3.广西医科大学附属肿瘤医院,4.广西医科大学附属口腔医院,5.广西壮族自治区卫生健康委员会口腔感染性疾病防治重点实验室,广西 南宁 530021)
随着人类生活水平的不断提高,2型糖尿病(type 2 diabetes mellitus,T2DM)已经成为严重影响人类健康生活质量的公共卫生问题,而且T2DM的发病呈现逐年年轻化[1]。T2DM是一种病因复杂的慢性全身性疾病,以胰岛素抵抗、血液中葡萄糖水平升高和胰岛β细胞功能障碍为主要特征[2]。其中,肥胖是导致T2DM的主要影响因素之一,高水平的游离脂肪酸对胰岛β细胞可产生明显毒性作用,并可诱导机体发生胰岛素抵抗。研究表明,长期暴露于高浓度的游离脂肪酸则可导致胰岛β细胞功能受损,胰岛素分泌绝对或相对不足,从而引发糖尿病[3-4]。因此,探讨抑制游离脂肪酸诱导的胰岛功能损伤和胰岛β细胞凋亡的策略,对T2DM的防治具有非常重要的意义。
葛根素(puerarin,PR)是从豆科植物野葛PuerarinLobata(Wild) Ohwi根部中提取的异黄酮类生物活性成分。在我国已被广泛应用于T2DM、糖尿病肾病、糖尿病心肌病等糖尿病并发症的治疗[5]。前期研究发现,葛根素可明显改善链脲佐菌素(STZ)诱导的糖尿病小鼠糖尿病前期状态,改善胰腺超微组织损伤[6]。但目前尚未有相关文献明确葛根素对胰岛细胞的体外保护作用机制,因此,本研究将采用体外培养的小鼠胰岛β细胞株(MIN6细胞),观察葛根素对棕榈酸诱导的MIN6细胞损伤和凋亡的影响,并从NF-κB信号通路及凋亡相关因子的角度探究其可能机制。
1 材料
1.1 实验细胞MIN6细胞株购于武汉普诺赛生命科技有限公司,货号:CL-0674 。
1.2 药品与试剂葛根素注射液(山东方明药业集团股份有限公司,批号:H20033292)、棕榈酸钠(鲲创科技股份有限公司,批号:KCSJ002)、胎牛血清(Gemini公司,批号:A58G00J)、RPMI 1640培养基(美国Giboco公司,批号:8119267)、0.25%含EDTA胰酶(北京索莱宝公司,批号:20201217)、青霉素/链霉素(北京索莱宝公司,批号:20201101)、β-巯基乙醇(武汉普诺赛生命科技有限公司,批号:WH01112009XP)、LDH试剂盒(南京建成生物工程研究所,批号:20200613)、MDA试剂盒(南京建成生物工程研究所,批号:20200411)、GSH试剂盒(南京建成生物工程研究所,批号:20200510)、GAPDH多克隆抗体(中国Proteintech公司,批号:10494-1-AP)、NF-κB抗体(美国Cell Signaling Technology公司,批号:CN89330)、p-NF-κB抗体(美国Cell Signaling Technology 公司,批号:16)、Bax抗体(中国Proteintech公司,批号:50599-2-lg)、Bcl-2抗体(中国Proteintech公司,批号:26593-1-AP)、辣根过氧化物酶标记羊抗兔抗体(Invitrogen中国公司,批号:VC303853)
1.3 主要仪器二氧化碳培养箱(Thermo Forma公司,型号:31111)、超净工作台(苏州净化设备总厂,型号:1450型)、小型高速冷冻离心机(德国ThermoIEC公司,型号:Micro CL17R)、荧光倒置显微镜(日本奥林巴斯株式会,型号:奥林巴斯CKX-41)、连续光谱扫描式酶标仪(香港分子仪器公司,型号:SpectraMaxPlus384)、垂直电泳仪(美国Bio-Rad中国有限公司)、双色红外荧光成像系统(美国Li-COR OdysseClx公司)。
1.4 MIN6细胞的培养将MIN6细胞培养于含10%胎牛血清的RPMI 1640完全培养基中(含1%青霉素-链霉素、50 μmol·L-1β-巯基乙醇),置于含5% CO2的37 ℃培养箱中培养,2~3 d换液1次,待细胞生长至接近融合时,用0.25%胰酶消化、传代培养,继续后续实验。
1.5 MTT法检测MIN6细胞的存活率将MIN6细胞制备成单细胞悬液,计数,以5×103/孔的密度接种于96孔板中。待细胞贴壁后,弃去培养基,将细胞分为正常组( Normal control ),模型组(Model control ),葛根素高、中、低剂量组(PR 5、2.5、1.25 mg·L-1),分别加入相应浓度的含药培养基或完全培养基预处理2 h后,除正常组外,其余各组加入120 μmol·L-1的棕榈酸,共同培养24 h。每孔加入10 μL MTT试剂和90 μL无血清培养基,培养箱培养4 h后,酶标仪490 nm处检测各孔吸光度值(A值),计算细胞存活率。
1.6 细胞LDH、MDA和GSH的测定细胞分组及药物处理见“1.5”项,各组细胞处理结束后,收集细胞上培养清液,根据LDH含量检测试剂盒说明书,检测并计算细胞上清中LDH含量。采用超声破碎法破碎细胞,细胞破碎完毕后离心取上清,根据MDA含量检测试剂盒和GSH检测试剂盒说明书进行检测和计算。
1.7 细胞AOEB染色及形态观察将对数生长期的细胞按每孔5×104/孔的密度接种于6孔板中,细胞分组及药物处理见“1.5”项,各组给药处理结束后,弃除完全培养基或含药培养基,用PBS轻柔清洗1遍细胞,每孔再加入500 μL的PBS,然后将配置好的AOEB工作液(将AO和EB两种溶液按照1 ∶1混合配置),5 μL/孔加入各组细胞中,室温避光染色5 min,染色结束后,弃去荧光染液,用PBS清洗1遍细胞,采用倒置荧光显微镜观察细胞凋亡情况并拍照记录。
1.8 Western blot法检测各组细胞Bcl-2、Bax、NF-κB p65蛋白表达情况细胞分组及药物处理见“1.5”项,各组细胞处理结束后,用PBS冲洗1~2次,各组加入含PMSF的RIPA裂解液裂解细胞,12 000g离心15 min,取上清即为各组细胞总蛋白,用BCA法测定蛋白浓度,加入上样缓冲液,根据目的蛋白分子量的大小采用不同浓度的分离胶进行SDS-PAGE凝胶电泳,湿法转膜,TBST溶液洗膜3次后,4 ℃冰箱孵育按1 ∶500或1 ∶1 000稀释的一抗过夜,TBST重新洗膜3次,每次5 min室温摇床孵育加HRP标记的山羊兔二抗0.5~1 h,TBST洗膜3次,每次5 min,双色红外荧光成像系统曝光扫膜,以GAPDH作为内参蛋白校正,实验结果用ImageJ分析软件进行灰度值分析。

2 结果
2.1 葛根素对MIN6细胞存活率的影响120 μmol·L-1棕榈酸孵育MIN6细胞24 h后可以诱导MIN6细胞损伤(P<0.01);与模型组相比,不同浓度葛根素预处理2 h后,120 μmol·L-1棕榈酸共同孵育24 h可减轻棕榈酸诱导的细胞损伤(P<0.01或P<0.05)。提示葛根素可有效改善棕榈酸诱导的细胞损伤(Tab 1)。
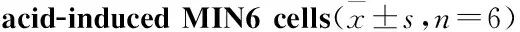
Tab 1 Effects of PR on viability of palmitic
2.2 各组细胞上清液LDH含量的比较结果显示,模型组LDH释放量,MDA含量明显增加,GSH活性明显下降(P<0.01或P<0.05),说明此时棕榈酸对MIN6细胞造成了损伤。当加入不同浓度葛根素预处理2 h后,120 μmol·L-1棕榈酸共同孵育24 h时,随着葛根素浓度的增加,MIN6细胞中LDH释放量呈现明显(P<0.01或P<0.05)剂量依赖性下降趋势,葛根素高、中剂量组MDA含量明显降低,GSH活性明显增加(P<0.01或P<0.05)。结果表明,葛根素能够减轻棕榈酸造成的细胞损伤(Tab 2)。
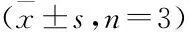
Tab 2 Effects of PR on level of LDH,MDA and GSH in palmitic acid-induced MIN6 cells
2.3 细胞AOEB染色及形态观察如Fig 1所示,正常组细胞生长良好,贴壁情况良好,呈现亮绿色荧光,模型组细胞出现凋亡,发出橘红色荧光,对于葛根素给药组,高剂量组的呈现黄绿色荧光,中剂量开始出现早期凋亡细胞,呈现橘黄色荧光,低剂量组坏死细胞最多,呈现橘红色荧光。结果提示,葛根素可以改善棕榈酸引起的MIN6细胞凋亡。

Fig 1 Effects of PR on apoptosis of palmitic acid-induced MIN6 cells (200×)A: Normal control; B: Model group; C: PR 5 mg ·L-1; D: PR 2.5 mg·L-1;E: PR 1.25 mg·L-1
2.4 葛根素对MIN6细胞Bcl-2、Bax、NF-κB p65蛋白表达的影响各组细胞中目的蛋白表达结果如Fig 2所示。与正常组相比,模型组中NF-κB p-p65、Bax蛋白表达上调,Bcl-2蛋白表达下调(P<0.01);与模型组相比,葛根素高、中剂量组NF-κB p-p65、Bax蛋白表达下调,Bcl-2蛋白表达上调(P<0.01或0.05)。提示葛根素能减少炎症因子NF-κB p-p65蛋白和促凋亡因子Bax蛋白的表达,同时促进抗凋亡因子Bcl-2蛋白的表达。

Fig 2 Effects of PR on Bax,Bcl-2,p65 and p-p65 expression of palmitic acid-induced MIN6 cells
3 讨论
T2DM的发病因素众多,近年来,脂毒性在T2DM的发生发展中的作用受到广泛关注。研究表明,长期暴露于高水平的游离FFA中,一方面会减少葡萄糖刺激的胰岛素分泌,引起胰岛素抵抗;另一方面可诱导胰岛β细胞发生凋亡,激活炎症因子,导致胰岛细胞损伤[7-8]。因此,抑制脂毒性诱导的胰岛细胞损伤有望成为治疗T2DM的有效途径之一。本研究采用棕榈酸作为造模刺激物,从细胞水平来探讨葛根素对脂毒性诱导的胰岛β细胞的作用。实验结果表明,MTT法、LDH、MDA和GSH试剂盒均提示葛根素具有改善棕榈酸引起的MIN6细胞损伤的作用,AOEB荧光染色法结果提示葛根素具有抑制MIN6细胞凋亡的作用。
NF-κB是重要的核转录因子之一,在细胞炎症、损伤中具有重要的调节作用[9]。当刺激因素激活后,NF-κB核转移过程增强,其与相应的靶基因结合,参与调控一系列炎症因子等促炎基因的表达,最终导致细胞功能受损甚至凋亡的发生。大量研究显示[10-12],NF-κB信号通路的激活与糖尿病发生的胰岛β细胞凋亡及损伤密切相关,抑制NF-κB信号通路的活化可以有效保护胰岛β细胞。Western blot结果表明,与正常组相比,模型组NF-κB p-p65表达明显上调,说明造模成功。与模型组相比,葛根素高剂量组NF-κB p-p65表达明显下调,提示葛根素有较好的抑制NF-κB通路活性,改善MIN6细胞损伤的作用。
β细胞凋亡在T2DM的发生发展过程中起到重要的作用,T2DM患者的胰岛β细胞数量明显减少[13-14]。Bcl-2家族的凋亡相关基因Bcl-2、Bax是调控胰岛β细胞凋亡的重要因子。其中,Bcl-2是抑制细胞凋亡的基因蛋白,为线粒体膜的整合蛋白,可通过线粒体途径、内质网途径抵抗细胞凋亡;Bax是促进细胞凋亡的基因蛋白,当接收到凋亡信号刺激被激活后,分子构象发生改变,形成Bax/Bax二聚体,进而促进细胞凋亡[15-16]。Western blot结果显示,与正常组相比,模型组Bax表达明显上调,Bcl-2表达明显下调,说明造模成功。与模型组相比,葛根素高、中剂量组Bax表达明显下调,Bcl-2表达明显上调,提示葛根素有明显的抑制棕榈酸引起的MIN6细胞凋亡的作用。
综上所述,葛根素可改善棕榈酸诱导的胰岛MIN6细胞的氧化应激状态,进而抑制凋亡和炎症反应而改善胰岛细胞的功能。因此,葛根素对胰岛MIN6细胞的保护机制可能与调节凋亡相关蛋白Bcl-2、Bax的表达及抑制NF-κB信号通路有关。

