浅析2020年国家医疗器械质量抽查检验品种质量变化特点
【作 者】李晓,张欣涛,郝擎,朱炯,马金竹,杨国涓
1 中国食品药品检定研究院,北京市,102629
2 天津市医疗器械质量监督检验中心,天津市,300384
0 引言
国家医疗器械质量抽查检验(以下简称国抽)是医疗器械监管的重要举措,是加强医疗器械产品质量监管、保障公众用械安全的重要手段。国抽不仅作为评价医疗器械产品质量的重要方式,还在医疗器械注册、检验、生产、管理、经营、使用等方面发挥了重要作用,对医疗器械产业健康发展也起到了促进作用。国抽遵循合法、规范、科学、公正原则,根据具有法律效力的标准、经注册或者备案的产品技术要求开展符合性检验;充分考虑强制性标准的实施过程和产品技术要求的修订情况,制定科学合理的抽检方案;由具备相应资质能力的检验机构开展检验;对于确定不合格产品,各地药品监督管理部门均会在收到检验报告的第一时间对问题产品和相关单位进行处理;国抽组织检验机构围绕各类产品可能存在的潜在风险,开展探索性研究[1-4]。
加大针对不合格产品所涉及单位的监管力度,促使企业更加严密地控制、消除风险,并认真整改,促进医疗器械产品质量提高,减少械害事件发生。监管部门通过对国抽结果的分析运用,结合日常监管情况,针对国抽发现的产品潜在风险点进行总结归纳和科学研判,全面分析产品质量,掌握产品质量安全趋势,做好后续监管工作[5-6]。
2020年国抽继续对安全风险性高、临床使用量大、舆情关注度高以及既往抽检发现问题较多的品种进行持续关注。2020年国抽监督抽检样品中,共抽到三类医疗器械共1157批,二类医疗器械共1277批,另有部分按照一类备案的产品共4批。三类医疗器械不合格共30批,占全部不合格数量的31.3%,二类医疗器械不合格共66批,占全部不合格数量的68.7%。从不合格检出率上看,三类医疗器械不合格检出率最低,为2.6%,二类医疗器械不合格检出率为5.2%。
下面通过整理分析历年国抽结果,分析2020年国抽品种质量状况,归纳品种质量变化特点,从品种角度分析医疗器械行业发展水平,向行业和监管部门提出加强医疗器械质量安全保障方面的改善建议。
1 部分品种质量状况比较稳定
通过汇总整理2020年国抽数据,并与历次抽检数据横向对比分析,发现一次性使用无菌注射器和牙科手机等2个品种质量比较稳定,占2020年国抽品种数量的4.1%。
1.1 一次性使用无菌注射器
该品种自2013年以来共抽检4次,总体企业覆盖率达到85.8%。其中2015年抽检236批次,不合格检出率为1.3%;2017年抽检399批次,不合格检出率为0.8%;2018年抽检375批次,不合格检出率为0.3%;2020年抽检390批次,不合格检出率为0.3%,历次抽检不合格检出率总体较低(见图1)。4次抽检中发现的不合格项目主要集中在注射针尺寸、外观、连接牢固度,没有企业在2次抽检中均有不符合标准规定的情况出现。该品种抽检结果较好且稳定。

图1 一次性使用无菌注射器历年抽检情况Fig.1 Results of supervision and inspection of disposable sterile syringes
1.2 牙科手机
该品种2017年至2020年共抽检2次,总体企业覆盖率达到83.0%。其中2017年抽检53批次,不合格检出率为3.8%;2020年抽检60批次,不合格检出率为1.7%(见图2)。2017年2批次产品不合格,其中1批次无法正常工作,1批次不合格项目为转速;2020年1批次产品不合格,不合格项目为转速。不合格企业未呈现集中分布态势,没有企业连续在抽检中被发现不合格,2017年抽检发现的2家不合格企业,2020年均被抽到,且均检验合格。该品种抽检结果稳定良好。
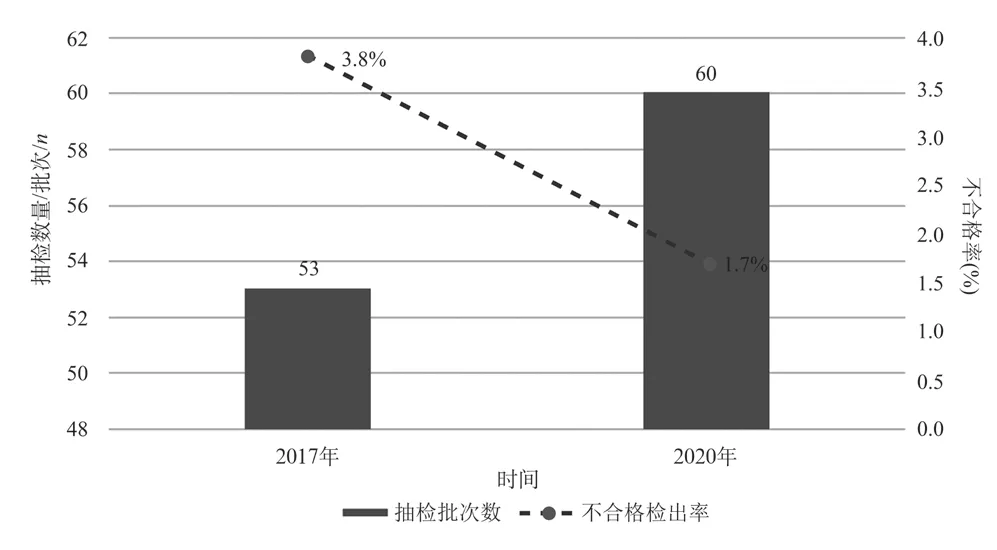
图2 牙科手机历年抽检情况Fig.2 Results of supervision and inspection of dental handpiece
2 部分品种质量状况有改善
通过抽检数据的汇总整理、对比分析,发现金属接骨板、人工晶状体、一次性使用人体静脉血样采集容器、血液透析及相关治疗用浓缩物、髋关节假体(股骨球头)、超声雾化器、电子血压计、B型超声诊断设备等8个品种质量状况有改善(见表1),占2020年国抽品种数量的16.3%。
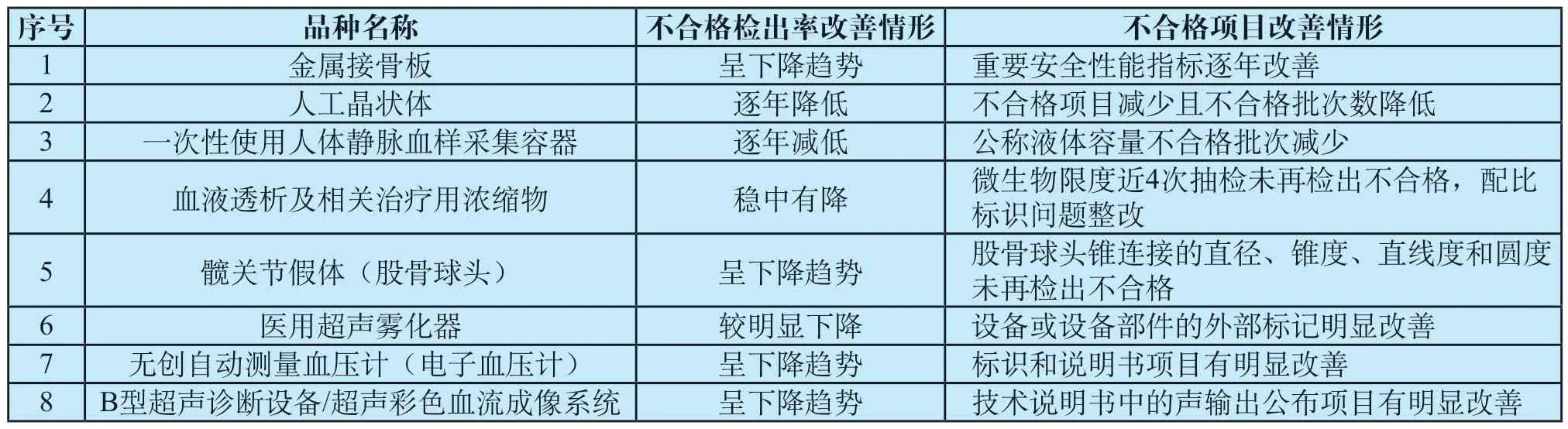
表1 部分品种质量状况改善情形Tab.1 Quality improvement of some varieties
2.1 金属接骨板
该品种自2013年以来共抽检5次,总体企业覆盖率为66.7%。其中2013年抽检60批次,不合格检出率为8.3%;2014年抽检21批次,不合格检出率为14.3%;2015年抽检88批次,不合格检出率为2.3%;2019年抽检58批次,不合格检出率为1.7%;2020年抽检52批次,不合格检出率为0。通过连续多次抽检,该品种不合格检出率和不合格项目均有明显改善。前期抽检中发现的一些重要安全性能指标不合格,如化学成分、弯曲性能、尺寸等,在近几次抽检中逐年改善,2020年未再发现不合格项。5次抽检,共有8家企业被检出不合格,其中7家企业在之后的抽检中检验合格,1家企业未再抽到。
2.2 人工晶状体
该品种自2013年以来共抽检3次,总体企业覆盖率为61.3%。2014年抽检15批次,不合格率检出率为26.7%;2017年抽检18批次,不合格检出率为22.2%;2020年抽检12批次,不合格检出率为8.3%,不合格检出率逐年降低。主要不合格项目也有明显改善:2014年抽检发现的不合格项目有光焦度和光谱透过率,2020年抽检仅有光焦度项目被检出不合格;光焦度项目不合格由2014年和2017年各4批次,减少到2020年1批次。3次抽检共有8家企业被检出不合格,其中2家企业在之后的抽检中检验合格,6家企业未再抽到。
2.3 一次性使用人体静脉血样采集容器
该品种自2013年以来共抽检3次,总体企业覆盖率为88.1%。2014年抽检86批次,不合格检出率为8.1%;2016年抽检102批次,不合格检出率为3.0%;2020年抽检98批次,不合格检出率为1.0%,不合格检出率逐年降低。3次抽检均发现公称液体容量、刻度标志和充装线不合格,其中公称液体容量2014年被检出6批次不合格,2016年被检出2批次不合格,2020年被检出1批次不合格。3次抽检共有10家企业被检出不合格,其中2家企业在之后的抽检中检验合格,3家企业的相关产品注册证到期后未更新信息,5家企业未再抽到。
2.4 血液透析及相关治疗用浓缩物
该品种2015年至2020年共连续抽检6次,总体企业覆盖率为72.0%。2015年抽检22批次,不合格检出率为9.1%;2016年抽检29批次,不合格检出率为3.4%;2017年抽检12批次,不合格检出率为0;2018年抽检40批次,不合格检出率为7.5%;2019年抽检42批次,不合格检出率为2.4%;2020年抽检30批次,不合格检出率为3.3%,不合格检出率呈稳中有降的趋势。其中,特别是微生物限度项目,2015年被检出2批次不合格、2016年被检出1批次不合格,近四次抽检未再检出。主要原因在于部分企业改进了生产工艺,提高了关键工序生产环境的洁净级别。
另外,2019年抽检发现某企业产品,其标签中A粉、B粉浓度配制比例标识错误,存在严重临床使用安全风险,抽检发现后第一时间向生产企业及其所在地省级药品监督管理部门发出重大质量安全风险提示。2020年对该企业同型号产品进行了再次抽检,配比标识错误问题已得到整改。
6次抽检共有6家企业被检出不合格,其中5家企业在之后的抽检中检验合格,1家企业未再抽到。
2.5 髋关节假体(股骨球头)
该品种自2013年以来共抽检4次,总体企业覆盖率为67.0%。2014年抽检20批次,不合格检出率为5.0%;2018年抽检34批次,不合格检出率为8.8%;2019年抽检16批次,不合格检出率为0;2020年抽检24批次,不合格检出率为0。前期抽检中发现的股骨球头锥连接的直径、锥度、直线度和圆度项目不合格问题,在近两次抽检中未再出现。通过抽检,产品质量有了明显提高。
不过,2020年抽检中仍发现1家企业在注册产品标准执行行业标准方面存在一定缺陷,未严格按照强制性行标YY 0118—2016规定产品的显微组织和表面缺陷项,且未明确规定锥连接部位直径的测量位置,建议该企业加强相关行业标准学习,进一步完善产品技术要求,监管部门加强对该企业的监督检查。
4次抽检共有4家企业被检出不合格,其中3家企业在之后的抽检中检验合格,1家企业未再抽到。
2.6 医用超声雾化器
该品种2015年至2020年共抽检4次,总体企业覆盖率为73.2%。2015年抽检37批次,不合格检出率为2.7%;2017年抽检28批次,不合格检出率为17.9%;2019年抽检31批次,不合格检出率为16.1%;2020年抽检89批次,不合格检出率为0。该品种抽检结果有较为明显的提高,尤其是设备或设备部件的外部标记项目经过2017年、2019年两年抽检后有明显改善。2019年发现的2家不合格企业,2020年均被抽到,且均检验合格。
2.7 无创自动测量血压计(电子血压计)
该品种2014年至2020年共抽检6次,总体企业覆盖率为99.3%。2014年抽检64批次,不合格检出率为17.2%;2015年抽检73批次,不合格检出率为28.8%;2016年抽检196批次,不合格检出率为21.9%;2018年抽检168批次,不合格检出率为13.1%;2019年抽检175批次,不合格检出率为5.1%;2020年抽检147批次,不合格检出率为3.4%,该品种不合格检出率呈下降趋势。
另外,通过对历年抽检数据统计分析,行业标准YY 0670—2008中条款4.2标识项目和说明书项目有明显改善:标识项目2014年被检出11批次不合格,2015年被检出19批次不合格,2016年被检出35批次不合格,2018年被检出11批次不合格,2019年被检出9批次不合格,2020年被检出3批次不合格;说明书项目2014年被检出7批次不合格,2015年被检出8批次不合格,2016年被检出23批次不合格,2018年被检出6批次不合格,2019年被检出4批次不合格,2020年被检出3批次不合格。
2.8 B型超声诊断设备/超声彩色血流成像系统
该品种2013年至2020年共抽检5次,总体企业覆盖率为77.2%。2013年抽检10批次,不合格检出率为20.0%;2014年抽检8批次,不合格检出率为40.0%;2015年抽检21批次,不合格检出率为28.6%;2016年抽检48批次,不合格检出率为22.9%;2020年抽检30批次,不合格检出率为6.7%,该品种不合格检出率呈逐年降低趋势。
通过对历年抽检数据统计分析,技术说明书中的声输出公布项目有明显改善,此项目2014年被检出2批次不合格,2015年被检出4批次不合格,2016年被检出5批次不合格,2020年未被检出不合格。2014年至2016年抽检中共有21家企业被检出不合格,其中4家企业在之后的抽检中检验合格,4家企业被检出不合格项目后再未被抽到,13家企业相关产品的注册证过期后未更新信息。对于该项目,无同一企业被检出2次以上不合格的情况,说明企业对不合格项目的整改情况良好。
3 部分品种检验项目的个别检验结果有明显改善
通过对历年抽检数据整理,概括抽检产品主要不合格情形及其可能造成的危害,分析质量变化趋势,发现电针治疗仪、电动轮椅车、验光仪等3个品种的检验项目有明显改善(见表2),占2020年国抽品种数量的6.1%。

表2 部分品种检验项目明显改善情形Tab.2 The improvement for the inspection items of some varieties
3.1 电针治疗仪
该品种2015年至2020年共抽检3次,总体企业覆盖率为89.7%。抽检结果无明显差异,但控制器的操作部件项目有明显的改善。3次抽检中均发现控制器的操作部件、随机文件有不合格情况,其中控制器的操作部件不合格,可能引发意外的高强度输出[7]。该项目为重要的安全指标,2015年被检出5批次不合格,2016年被检出1批次不合格,2020年被检出1批次不合格。2015年至2016年抽检共有6家企业被检出该项目不合格,其中5家企业在之后的抽检中该项目检验合格,1家企业未被抽到。对于该项目,无同一企业被检出2次以上不合格的情况,说明企业对不合格项目的整改情况良好。
另外,2020年抽检中该品种共有7批次监测到潜在风险,其中5批次生产企业集中在某省,占比71.4%。
3.2 电动轮椅车
该品种2017年至2020年共抽检2次,总体企业覆盖率为63.2%。不合格检出率无明显差异,但最大速度项目有明显改善。2次抽检中均发现设备或设备部件的外部标记、最大速度项目有不合格情况。其中最大速度是影响产品使用的重要指标,最大速度不合格,可能引发使用者撞伤或轮椅倾倒等危害。该项目2017年被检出11批次不合格,2020年被检出4批次不合格。
对于该项目,2017年抽检共有7家企业不合格,2020年抽到其中5家企业,4家企业检验合格,1家企业(A公司)被检出不合格,1家企业未再抽到,1家企业相关产品注册证过期后未更新信息。除A公司连续2次被检出该项目不合格外,无同一企业出现2次以上不合格的情况。
3.3 验光仪
该品种2015年至2020年共抽检3次,总体企业覆盖率为94.4%,不合格检出率无明显差异,但外部标记项目有明显改善。3次抽检不合格项目集中在外部标记,2015年被检出1批次不合格,2017年被检出4批次不合格,2020年被检出1批次不合格。
2015年至2017年抽检,共有4家企业不合格,其中2家企业在之后的抽检中检验合格,2家企业相关产品注册证过期后未更新信息。通过对比历年的不合格企业,未发现1次以上不合格的情况,说明被抽到的企业对不合格项目的整改情况良好[8]。
4 建议
4.1 强化医疗器械企业强化风险管理意识
风险管理贯穿于产品研制、开发、生产、销售、使用全过程中。建议医疗器械企业强化产品的风险管理意识,具体表现为:应当切实履行质量安全主体责任,主动分析研判产品风险和成因,完成风险控制和消除,对于已经上市销售的产品进行召回,完成质量管理体系的整改,特别是对于国抽不合格产品的产生原因,应当及时制定整改方案并实施。
4.2 加大监管部门加强监督检查力度
监督检查是医疗器械上市后监管重要的手段之一。针对国抽发现的不合格项目及既往抽检发现问题较多的品种,加大监督检查的力度和频次,监督相关企业完成整改,必要时开展跟踪检查。充分用好国抽数据,尤其是国抽发现的重大质量安全风险、产品潜在风险点。各级药品监督管理部门应当及时调查处理,加强对企业的监督指导,采取切实有效的措施,强化后续监管。
4.3 持续开展医疗器械上市后监管风险会商机制
国抽紧抓医疗器械注册人、备案人和进口产品代理人的主体责任,以品种为视角,结合历次抽检数据,通过归纳和分析,对典型问题、典型现象进行检视。经由医疗器械上市后监管风险会商机制研判、转交至各地药品监督管理部门,为上市后监管提供技术支撑,为其他监管环节提供参考,同业界人士共勉。
5 结语
随着医疗器械产业持续稳定的发展,国家对医疗器械监管力度进一步增强,相关医疗器械法规制度不断更新。国抽作为重要的医疗器械监管手段,为不同环节、不同地区的医疗器械监管工作提供线索和抓手[9]。同时,持续深化国抽数据分析,进行总结归纳和科学研判,对上市后产品的潜在风险及时给出较为明确的研究结果和建议,掌握产品质量安全趋势,高效发挥抽检效能,有针对性地就既往抽检多次发现问题的品种加强监管。希望相关人员重视医疗器械质量状况,进一步提升医疗器械产业水平,保障公众用械安全,为医疗器械全生命周期管理做出贡献。

