MAPK/ERK信号通路在逆转乳腺癌内分泌治疗耐药中的作用
叶敬文,沈云岳,刘鷖雯,何怡青,杜 艳,张国良,高 锋,杨翠霞
(1.上海交通大学附属第六人民医院中心实验室,上海 200233;2.上海交通大学附属第六人民医院检验科,上海 200233)
乳腺癌是源于乳腺导管上皮细胞的恶性肿瘤。2020年全球新增癌症患者中,女性乳腺癌患者约占11.7%,发病率居所有肿瘤之首[1]。约有80%的乳癌患者为雌激素受体(estrogen receptor,ER)阳性,表现为激素依赖性[2],对内分泌治疗敏感;有约20%的患者会产生耐药性并复发[2],其中20%的复发患者ER由阳性转变为低表达或阴性[3],失去对内分泌治疗的敏感性[2]。根据美国国立综合癌症网络(the National Comprehensive Cancer Network,NCCN)最新指南[4],乳腺癌复发患者若表现为ER阴性或ER低表达,只能使用吉西他滨等常规化疗药物。因此,针对发生内分泌治疗耐药的患者,目前临床多采用放化疗辅以芳香化酶抑制剂等联合治疗方案[5],但多数患者对放化疗的反应较大,且芳香化酶抑制剂仅适用于绝经后女性。因此,寻找新的治疗方案是攻克内分泌治疗耐药乳腺癌的关键。有研究结果显示,肿瘤细胞生长相关的信号通路常被过度激活[6]。因此,信号通路抑制剂是目前临床讨论的热点方案之一。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)是调控细胞生长的重要信号通路,在乳腺癌中会被高度活化[6-7]。当常规化疗药物阿霉素治疗管腔型乳腺癌发生耐药时,MAPK/ERK通路在耐药细胞中被过度激活,而抑制MAPK/ERK信号通路可明显降低耐药细胞对阿霉素的耐药性[8],提示MAPK/ERK通路与乳腺癌细胞的耐药性和可塑性密切相关。但在内分泌治疗耐药中,关于MAPK/ERK通路活化程度及作用的研究尚少。为此,本研究拟采用丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase,MEK)抑制剂抑制MAPK/ERK信号通路,观察内分泌治疗耐药的乳腺癌细胞增殖的改变情况,为寻找内分泌治疗耐药的乳腺癌治疗新方案提供实验室基础。
1 材料和方法
1.1 细胞培养
人乳腺癌细胞系MCF-7和T47D购自美国典型培养物保藏中心。MCF-7细胞采用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的最低基本培养基(minimum essential medium,MEM)培养。T47D细胞采用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的1640培养基培养。
参考文献[9],使用1 μmol/L他莫昔芬连续刺激MCF-7细胞和T47D细胞>10个月,建立内分泌治疗耐药的乳腺癌细胞株MCF-7/TAMR和T47D/TAMR,此后,MCF-7/TAMR和T47D/TAMR细胞需持续培养于含1 μmol/L他莫昔芬的培养基中。人乳腺癌细胞系MCF-7他莫昔芬耐药株(MCF-7/TAMR)采用无酚红MEM培养,人乳腺癌细胞系T47D他莫昔芬耐药株(T47D/TAMR)采用无酚红1640培养基培养,2种培养基中均添加5%活性炭吸附胎牛血清,同时添加1 μmol/L他莫昔芬、100 U/mL青霉素和100 mg/mL链霉素。培养箱条件为37 ℃、5% CO2。细胞密度达到70%时进行后续实验。他莫昔芬和MEK抑制剂U0126均购自美国MedChem Express公司。
1.2 细胞增殖实验
采用CCK-8法检测细胞的增殖情况,CCK-8试剂购自美国Promega公司。分2个组进行细胞增殖实验。第1组实验:将MCF-7细胞、MCF-7/TAMR细胞、T47D细胞和T47D/TAMR细胞按3 000个/孔接种到96孔板中,培养24 h后分别加入不同浓度[0、1、5、10 μmol/L,0 μmol/L为仅加入1 μmol/L二甲基亚砜(dimethyl sulfoxide,DMSO;美国MedChem Express公司)]的他莫昔芬;第2组实验:将MCF-7/TAMR细胞和T47D/TAMR细胞按3 000个/孔接种到96孔板中培养24 h后,加入1 μmol/L他莫昔芬和不同浓度[0、1、5、10 μmol/L,0 μmol/L为仅加入1 μmol/L DMSO]的U0126。2个实验组的细胞均培养72 h后,加入20 μL CCK-8试剂和80 μL相应的无血清培养基,37 °C孵育2 h。采用Epoch酶标仪(美国BioTek公司)检测吸光度(A)值。
1.3 平板克隆形成实验
分2个组进行平板克隆形成实验。第1组实验:将MCF-7细胞、MCF-7/TAMR细胞、T47D细胞和T47D/TAMR细胞按800个/孔接种于6孔板中,培养24 h后加入他莫昔芬,使培养基中的他莫昔芬浓度为1 μmol/L。第2组实验:将MCF-7/TAMR细胞和T47D/TAMR细胞按800个/孔接种于6孔板中,培养24 h后,U0126组加入他莫昔芬和U0126,使培养基中的他莫昔芬和U0126浓度分别为1和5 μmol/L;对照组加入他莫昔芬和DMSO,使两者浓度均为1 μmol/L。2个实验组的细胞均持续培养2周,直至形成肉眼可见的克隆细胞团后,用4%多聚甲醛固定液固定细胞20 min后,去除固定液,用1×磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤3次,再用0.05%结晶紫溶液染色20 min,用1×PBS洗涤后风干,拍照并记录所形成的细胞克隆数目。
1.4 免疫印迹法
采用RIPA裂解液(上海碧云天公司)裂解细胞并提取总蛋白。采用bicinchoninic酸蛋白测定试剂盒(美国Sigma公司)测定总蛋白浓度。在总细胞裂解液中加入总体积1/4的蛋白上样缓冲液(上海碧云天公司,货号P0015),置于100 ℃水浴锅中孵育10 min,按照每泳道10 μg总蛋白上样,采用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质,通过湿转法转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,然后用含5%脱脂奶粉的三羟甲基氨基甲烷-吐温缓冲液(tris-hydroxymethyl aminomethane-Tween,TBST)封闭1 h,加入一抗,4 ℃下孵育过夜。一抗中的c-MYC抗体、磷酸化细胞外调节蛋白激酶(phosphorylated extracellular regulated protein kinase,pERK)抗体、ERK抗体购自美国Cell Signaling Technology公司(货号分别为5605S、4370P、4695),类固醇受体共激活因子-1(steroid receptor coactivator-1,SRC-1)抗体、E26转录因子-2(E26 oncogene homolog-2,ETS-2)抗体和c-JUN抗体购自武汉爱博泰克公司(货号分别为A9058、A16844、A11378)。采用TBST洗涤PVDF膜3次,每次10 min,再加入辣根过氧化物酶标记的多克隆二抗,孵育1 h。然后加入化学发光底物,采用Amersham Imager 600扫描成像系统(美国GE healthcare Bio-Sciences AB公司)分析。以3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,使用Image Pro-Plus 6.0软件(美国 Media Cybernetics 公司)对图像灰度进行分析。
1.5 流式细胞术分析细胞周期
MCF-7/TAMR细胞和T47D/TAMR细胞按300 000个/孔接种于6孔板中,培养24 h,U0126组加入他莫昔芬和U0126,使培养基中的他莫昔芬和U0126浓度分别为1和5 μmol/L;对照组加入他莫昔芬和DMSO,使两者浓度均为1 μmol/L,2个组的细胞分别处理12 h和48 h。收集细胞上清,并使用胰酶消化细胞,与上清液一起1 000×g离心5 min,弃上清,用冰PBS清洗沉淀,1 000×g离心5 min,弃上清。使用冰70%乙醇固定细胞30 min,用冰PBS清洗后,1 000×g离心5 min,弃上清,加入细胞周期检测试剂(上海碧云天公司,货号C1052),避光染色30 min,采用CytoFLEX Lx流式细胞仪(美国 Beckman Coulter公司)检测,采用配套的CytExpert 2.4软件进行分析。
1.6 荧光定量聚合酶链反应(polymerase chain reaction,PCR)
MCF-7/TAMR细胞和T47D/TAMR细胞按300 000个/孔接种于6孔板中,培养24 h,实验组加入他莫昔芬和U0126,使培养基中的他莫昔芬和U0126浓度分别为1和5 μmol/L;对照组加入他莫昔芬和DMSO,使两者的浓度均为1 μmol/L。2个组均处理72 h。采用RNAiso Plus试剂盒(日本TaKaRa公司)提取总RNA。采用NanoDrop系统(美国ThermoFisher Scientific公司)测定RNA浓度。采用含gDNA Eraser(日本TaKaRa公司)的PrimeScript RT Reagent试剂盒(日本TaKaRa公司)逆转录1 μg mRNA。采用荧光定量PCR检测SRC-1、ETS-2和c-JUN基因。SYBR试剂盒购自日本TaKaRa公司,检测仪器为QuantStudio 7 Flex实时荧光定量PCR仪(美国ThermoFisher Scientific公司)。引物由上海擎科公司合成,引物序列见表1。反应条件:95 ℃ 1 min;95 ℃ 5 s,65 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。以GAPDH为内参,采用2-ΔΔCt法计算各基因的相对表达量。

表1 引物序列
1.7 统计学方法
所有实验均至少独立重复3次。采用Graphpad Prism 8.0软件进行统计分析。呈正态分布的数据2个组之间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 他莫昔芬对细胞增殖的影响
采用不同浓度他莫昔芬处理后,MCF-7/TAMR细胞和T47D/TAMR细胞的增殖速度分别显著高于MCF-7细胞和T47D细胞(P<0.05)。在1 μmol/L他莫昔芬的刺激下,MCF-7/TAMR细胞和T47D/TAMR细胞克隆形成能力分别显著高于MCF-7细胞和T47D细胞(P<0.000 1)。见图1。

图1 他莫昔芬对MCF7细胞、MCF-7/TAMR细胞、T47D细胞和T47D/TAMR细胞增殖能力的影响
2.2 他莫昔芬耐药细胞株MAPK/ERK信号通路分子的表达情况
MCF-7/TAMR细胞和T47D/TAMR细胞的ERK、pERK和c-MYC表达量分别高于MCF-7细胞和T47D细胞。见图2。
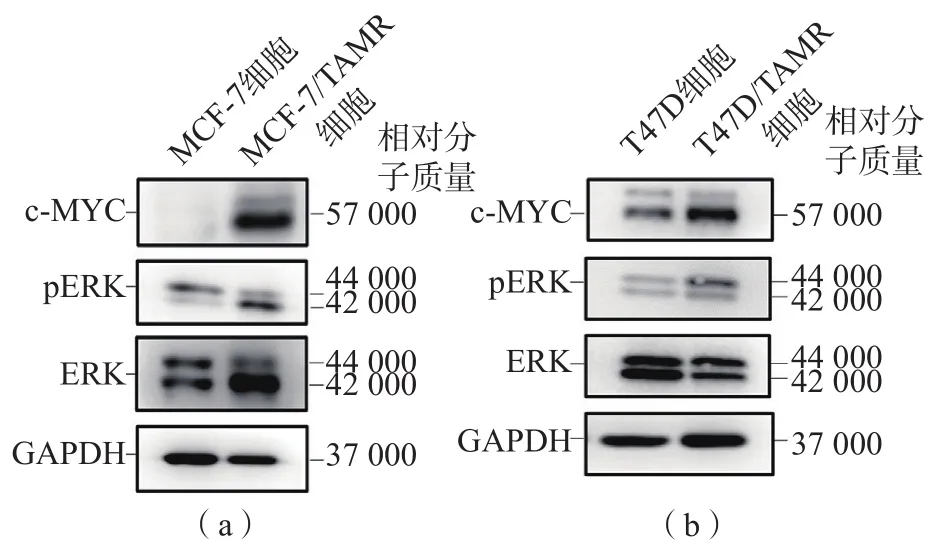
图2 MCF-7/TAMR细胞、MCF-7细胞、T47D/TAMR细胞和T47D细胞中MAPK/ERK信号通路分子的表达
2.3 抑制MAPK/ERK信号通路对他莫昔芬耐药细胞株增殖的影响
采用MEK抑制剂U0126阻断MAPK/ERK信号通路后,MCF-7/TAMR和T47D/TAMR细胞的MAPK/ERK信号通路相关分子c-MYC、ERK和pERK表达显著降低。见图3(a)。
细胞增殖实验结果显示,与0 mol/L U0126(对照)比较,用不同浓度U0126处理后,MCF-7/TAMR和T47D/TAMR细胞的增殖速度均显著降低(P<0.05、P<0.000 1)。见图3(b)。
平板克隆形成实验结果显示,与对照组比较,U0126组MCF-7/TAMR细胞和T47D/TAMR细胞的克隆形成能力均显著降低(P<0.01)。见图3(c)。
流式细胞术分析结果显示,与对照组比较,U0126组处于S期和G2期的MCF-7/TAMR细胞和T47D/TAMR细胞百分比率显著增加(P<0.01)。见图3(d)、表2。

表2 对照组和U0126组2种细胞处于S期和G2期的百分比 %

图3 MEK抑制剂U0126对他莫昔芬耐药细胞株增殖及细胞周期的影响
2.4 抑制MAPK/ERK信号通路对他莫昔芬耐药细胞株转录因子表达的影响
与对照组比较,U0126组MCF-7/TAMR和T47D/TAMR细胞转录因子SRC-1、ETS-2和c-JUN的基因和蛋白表达水平均显著降低(P<0.01)。见图4、图5。

图4 MCF-7/TAMR和T47D/TAMR细胞转录因子SRC-1、ETS-2和c-JUN表达的免疫印迹图
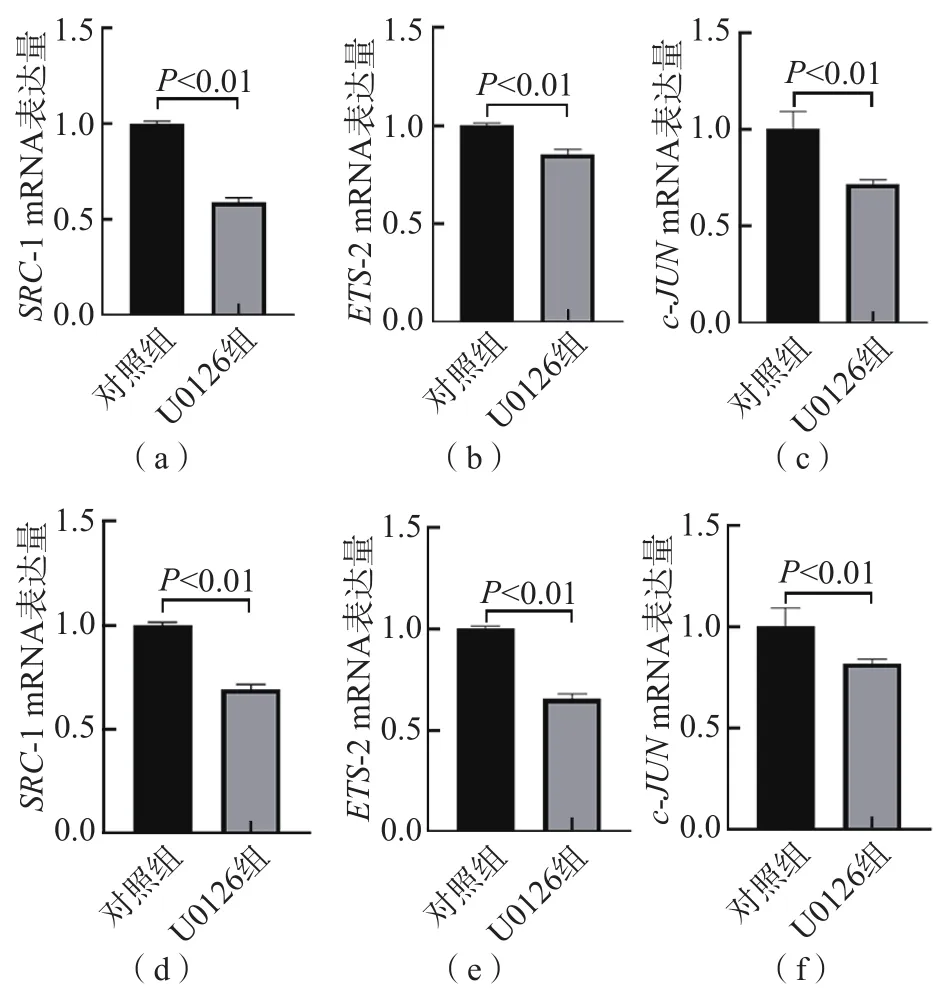
图5 MEK抑制剂U0126对MCF-7/TAMR细胞和T47D/TAMR细胞转录因子表达的影响
3 讨论
内分泌治疗耐药是ER阳性乳腺癌患者治疗失败及复发的主要原因,目前临床对这类患者尚无有效的治疗方案。本研究结果显示,抑制他莫昔芬耐药细胞株的MAPK/ERK通路可显著抑制ERK的过度激活,下调ERK依赖的转录因子的表达,使其细胞周期阻滞在G0/G1期,延缓增殖速度,恢复了其对他莫昔芬的敏感性。提示抑制MAPK/ERK信号通路对逆转内分泌治疗耐药具有重要的潜在临床价值。
针对内分泌治疗耐药的乳腺癌患者,目前临床上首选联合使用多种化疗药物[4-5],但其毒副作用均较大。为解决这一难题,有学者提出使用内分泌治疗药物联合调节细胞生长周期或抑制信号通路过度活化的替代方案。目前,临床常联合使用PI3K抑制剂、Src抑制剂和CDK4/6抑制剂等。PI3K抑制剂,如阿培利斯,可通过抑制蛋白激酶B(protein kinase B,PKB;又称Akt)活化,抑制生长信号通路活化[10],已被美国食品与药品监督管理局(U.S.Food and Drug Administration,FDA)批准用于治疗PI3CA基因突变的乳腺癌。Src蛋白是许多信号通路的上游分子,Src抑制剂,如博舒替尼,可抑制Src的磷酸化,从而抑制PI3K/Akt/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、MAPK/ERK和Janus激酶(Janus kinase,JAK)/信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)等信号通路的活性[11-12],已被FDA批准用于治疗慢性粒系白血病。虽然以上用于治疗内分泌治疗耐药乳腺癌的方案均在Ⅰ期临床试验中取得一定的疗效,但在Ⅲ期临床试验中,多数患者会迅速对其产生耐药[5,13],因此至今未进入临床应用。有研究结果表明,MAPK/ERK通路是调节细胞生长的重要通路之一,在乳腺癌、黑色素瘤和白血病细胞中被过度活化[6,14-15]。有研究结果显示,三阴性乳腺癌患者磷酸化ERK的表达量高于ER阳性的管腔型乳腺癌患者(P<0.01)[16]。ERK在介导乳腺癌发生顺铂或阿霉素耐药中发挥着重要作用,抑制其过度活化可逆转乳腺癌细胞的耐药性[17]。由此可见,ERK的活化程度与乳腺癌细胞的恶性程度和耐药性密切相关。因此,MAPK/ERK信号通路过度激活可能提示乳腺癌预后不良。但关于ERK活化程度在内分泌治疗耐药中的作用的研究尚不多见,具体机制仍不清楚。为此,本研究在体外建立了内分泌治疗耐药细胞模型MCF-7/TAMR和T47D/TAMR,结果显示MAPK/ERK通路被过度激活,与文献报道[18]一致。本研究采用MEK抑制剂U0126抑制MAPK/ERK通路后,发现MCF-7/TAMR和T47D/TAMR细胞的增殖速度明显减缓,逆转了乳腺癌细胞对他莫昔芬的耐药性。提示抑制MAPK/ERK通路可能对治疗内分泌治疗耐药的乳腺癌有一定作用,但是其体内效果有待深入研究。
转录因子是MAPK/ERK通路发挥生物学功效的关键因子。MAPK/ERK信号通路调控的转录因子包括SRC-1、ETS-2、c-JUN、c-MYC和c-FOS等[19-22],主要发挥促进细胞增殖和分化等功能。BROWNE等[19]的研究结果显示,SRC-1通过MAPK/ERK通路活化后,可使ETS-2表达增加,从而调节c-JUN等下游基因表达,促进细胞增殖。SRC-1在调控乳腺癌细胞获得内分泌治疗耐药中发挥了重要作用[19]。有研究结果显示,乳腺癌患者ETS家族异常高表达[20],其中ETS-2参与了乳腺癌细胞发生内分泌治疗耐药[21]。而c-JUN是构成转录因子激活蛋白-1(activating protein-1,AP-1)的转录因子之一,具有参与细胞增殖、分化等生理功能[23]。QUAN等[24]的研究结果显示,c-JUN可促进前列腺癌细胞发生内分泌治疗耐药。由此可见,SRC-1、ETS-2和c-JUN与肿瘤细胞发生内分泌治疗耐药密切相关。本研究结果显示,抑制ERK磷酸化可显著抑制SRC-1、ETS-2和c-JUN的表达,进而使乳腺癌细胞恢复对他莫昔芬的敏感性。这进一步验证了转录因子(SRC-1、ETS-2和c-JUN)在内分泌治疗耐药发生中的重要作用。
综上所述,抑制MAPK/ERK通路可减缓内分泌治疗耐药的乳腺癌细胞的增殖速度,恢复其对他莫昔芬的敏感性。提示抑制MAPK/ERK通路并与他莫昔芬联合使用可能具有良好的临床应用潜力,或能为临床治疗化疗不耐受,且内分泌治疗耐药乳腺癌患者的治疗提供新思路。

