粪便SDC2基因甲基化检测在结直肠癌辅助诊断中的价值
龚志贇,江铭磊,施卫忠,卢仁泉,郭 林
(复旦大学附属肿瘤医院检验科 复旦大学上海医学院肿瘤学系,上海 200032)
2020年中国癌症统计数据显示,在我国全部恶性肿瘤中,结直肠癌的发病率居第2位,病死率居第5位,新发病例55.5万,死亡病例28.6万[1]。大部分结直肠癌患者被确诊时已处于中晚期,疗效及预后均较差。早期筛查、早期诊断并进行适当干预能将结直肠癌患者的存活率提高至75%~90%[2-3]。目前,肠镜活检是肠癌早期诊断常用的方法,也是“金标准”方法,但有一定漏检率,并且这是一种侵入性的检查,有肠穿孔、出血、感染等风险。粪便隐血试验(fecal immunochemical test,FIT)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)检测是除肠镜外常用的结直肠癌筛查方法,但FIT易受干扰,假阳性率高[4];CEA、CA19-9特异性低,一般用于疗效监测[5]。因此,寻找一种高敏感性、高特异性的非侵入性结直肠癌筛查和诊断方法显得尤为重要。结直肠癌早期会发生异常甲基化,相关甲基化标志物陆续被报道,有研究结果显示,黏结蛋白聚糖2(syndecan 2,SDC2)参与肿瘤细胞活化、肿瘤血管生成及侵袭、转移[6]。本研究拟探讨SDC2基因甲基化、CEA、CA19-9在结直肠癌中的临床应用价值。
1 材料和方法
1.1 研究对象
选取2018年5月—2021年10月复旦大学附属肿瘤医院确诊的结直肠癌患者51例(结直肠癌组),其中男25例、女26例,年龄40~75岁。结直肠癌诊断标准参照《中国结直肠癌诊疗规范(2020年版)》[7],TNM分期参照美国癌症联合委员会结直肠癌TNM分期标准[8]。选取同期复旦大学附属肿瘤医院确诊的结直肠腺瘤患者22例(腺瘤组),其中男12例、女10例,年龄40~60岁。结直肠腺瘤诊断标准参考《中国早期结直肠癌筛查及内镜诊治指南(2014年,北京)》[9]。另选取同期复旦大学附属肿瘤医院健康体检者39名作为正常对照组,其中男19名、女10名,年龄35~60岁,肠镜结果均无明显异常。本研究经复旦大学附属肿瘤医院伦理委员会批准,所有对象均知情同意并签署知情同意书。
1.2 纳入和排除标准
1.2.1 纳入标准 初诊患者,有明确的病理诊断,肠镜检查前有SDC2基因甲基化、CEA、CA19-9的检测结果。
1.2.2 排除标准 合并其他肿瘤的患者,进行过放化疗及全身治疗的患者,妊娠期女性,病理诊断不明确的患者。
1.3 方法
1.3.1 样本采集及处理 收集所有患者治疗前及正常对照者体检当日粪便样本,采用粪便采集装置(广州康立明生物科技股份有限公司)采集4.5 g粪便,放入配套的粪便保护液中,用于后续检测。在收集粪便样本的同时采集所有对象的静脉血4 mL,4 h内离心分离血清,-20 ℃保存,2周内完成血清CEA、CA19-9检测。
1.3.2 P12全自动样本预处理仪与手工法的比对 随机选取26份结直肠癌患者、结直肠腺瘤患者和正常对照者的粪便样本,每份样本均分为2份,1份采用P12全自动样本预处理仪进行预处理,1份采用手工法预处理,分别检测。采用2-ΔCt法计算26例比对样本的粪便SDC2基因相对表达量,ΔCt=CtSDC2-Ctβ-actin。比较2种处理方法检测结果的一致性。
1.3.3 粪便SDC2基因甲基化检测 采用荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测SDC2基因甲基化,试剂盒(批号:CSD12210603)购自广州康立明生物科技股份有限公司,检测仪器为ABI 7500荧光定量PCR仪(美国ABI公司)。严格按仪器和试剂说明书操作。
1.3.4 血清CEA、CA19-9水平检测 采用cobas e 801全自动电化学发光免疫分析仪(瑞士罗氏公司)及配套试剂检测血清CEA、CA19-9水平。严格按仪器和试剂说明书操作。
1.3.5 阳性标准 粪便SDC2基因甲基化以循环阈值(cycle threshold,Ct)≤38为阳性,CEA和CA19-9均以高于参考区间上限(5.2 ng/mL、29 U/mL)为阳性。
1.4 统计学方法
采用SPSS 25.0软件进行统计分析。呈非正态分布的计量资料以中位数(M)[四分位数(P25~P75)]表示,组间比较采用Kruskal Wallis H检验,两两比较采用Mann Whitney U检验。计数资料以例或率表示,组间比较采用χ2检验。采用二元 Logistic回归分析建立各项指标的联合检测方程,采用受试者工作特征(receiver operating characteristic,ROC)曲线评价各项指标单项检测及联合检测诊断结直肠癌的效能。采用Peason相关分析评估2种方法之间的相关性,采用kappa检验分析2种方法的一致性。以P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌组、腺瘤组及正常对照组各项指标阳性率比较
结直肠癌组粪便SDC2基因甲基化阳性率显著高于腺瘤组和正常对照组(P<0.01)。结肠癌组粪便SDC2基因甲基化阳性率显著高于血清CEA和CA19-9的阳性率(P<0.01)。见表1。
结直肠癌Ⅰ~Ⅳ期患者之间粪便SDC2基因甲基化阳性率差异均无统计学意义(P>0.05)。结直肠癌Ⅰ~Ⅲ期患者的粪便SDC2基因甲基化阳性率显著高于血清CEA和CA19-9的阳性率(P<0.01)。见表1。

表1 结直肠癌组、腺瘤组及正常对照组各项指标阳性率比较 例(%)
2.2 粪便SDC2基因甲基化、血清CEA、CA19-9单项和联合检测诊断结直肠癌的效能
粪便S D C 2基因甲基化及血清C E A和CA19-9的联合检测方程为:Logit(P)=1.02×SDC2+0.14×CEA+0.01×CA19-9。ROC曲线分析结果显示,粪便SDC2基因甲基化、血清CEA、CA19-9单项检测和联合检测诊断结直肠癌的曲线下面积(area under curve,AUC)分别为0.965、0.694、0.567、0.976。见图1、表2。

表2 粪便SDC2基因甲基化、血清CEA、CA19-9单项及联合检测诊断结直肠癌的ROC曲线参数
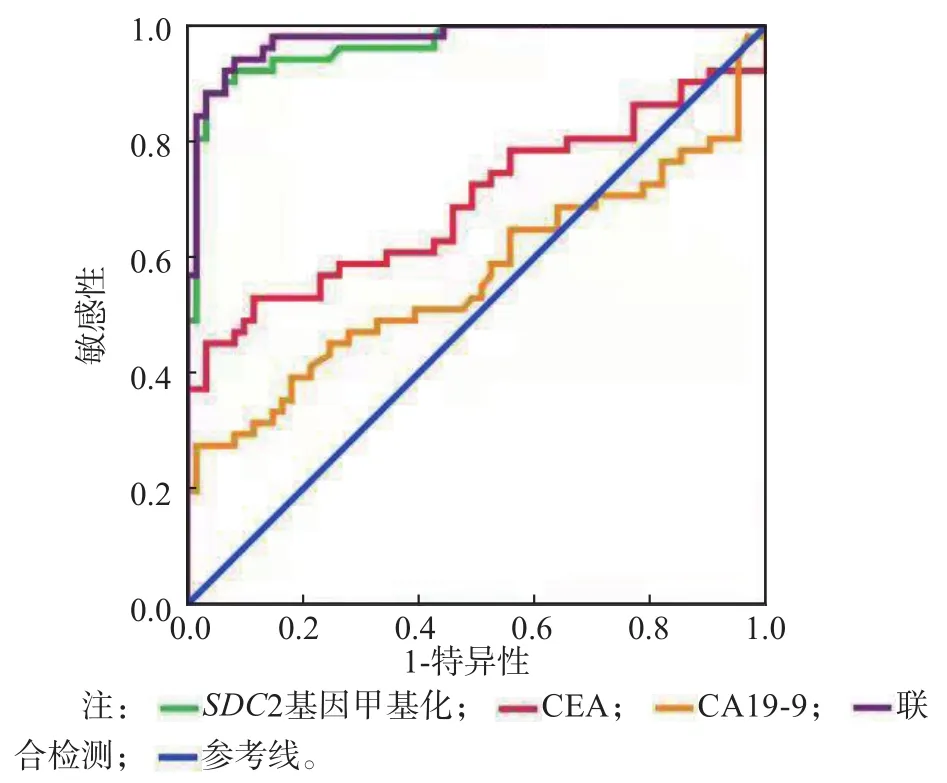
图1 粪便SDC2基因甲基化、血清CEA、CA19-9单项及联合检测诊断结直肠癌的ROC曲线
2.3 结直肠癌组粪便SDC2基因甲基化与血清CEA联合检测的阳性率分析
将腺瘤组和正常对照组合并为对照组(61例),粪便SDC2基因甲基化和血清CEA联合检测可将结直肠癌组的阳性率从84.3%(粪便SDC2基因甲基化单项检测)提升至90.2%(粪便SDC2基因甲基化+CEA),显著高于CEA的阳性率(P<0.01)。见表3。
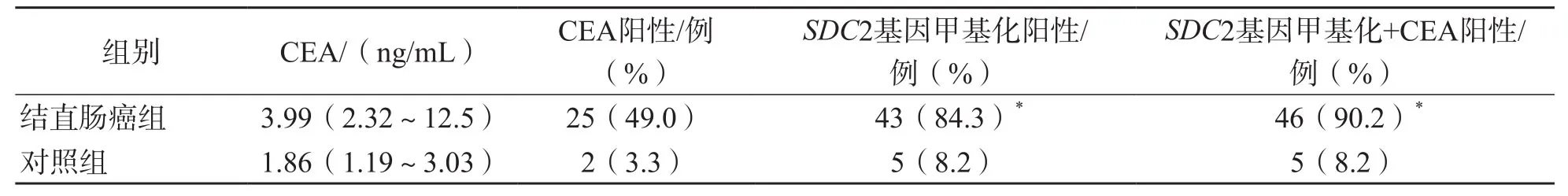
表3 结直肠癌组与对照组血清CEA水平及粪便SDC2基因甲化、血清CEA单项和联合检测阳性率比较
2.4 P12自动化样本预处理仪与手工法预处理样本粪便SDC2基因相对表达量比较
分别采用P12自动化样本预处理仪与手工法同时对26份粪便样本进行预处理。2种方法粪便SDC2基因相对表达量呈正相关(r=0.994,P<0.001),一致性良好(kappa=0.845,P<0.001)。见图2。
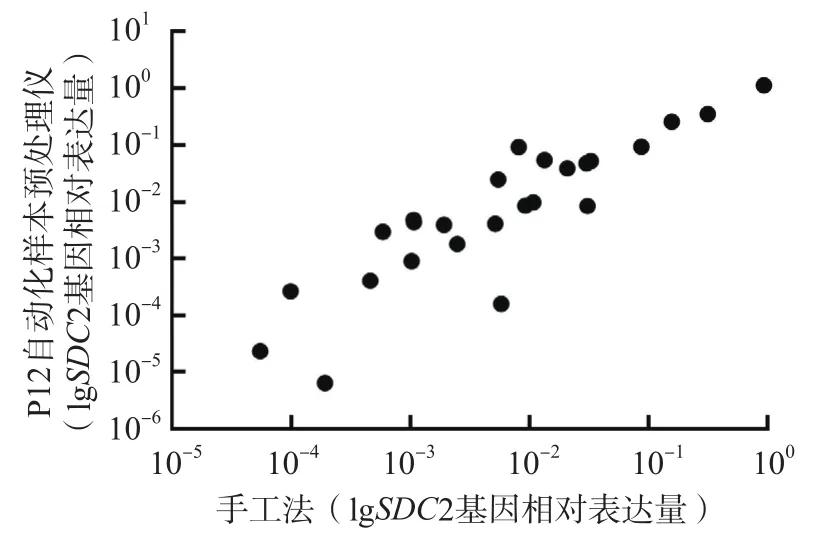
图2 P12自动化样本预处理仪与手工法预处理样本SDC2基因相对表达量的相关性
3 讨论
基因甲基化检测是目前临床应用前景较广的肿瘤筛查方法,在发达国家已开展多年[10]。目前,采用肠镜取样进行组织病理学检查依然是诊断结直肠癌的金标准,但其缺点也很明显,特别是侵入性操作会导致较多结直肠癌患者无法坚持定期检查,错失了早期诊断时机,降低了结直肠癌患者的生存率[11]。临床上常用的非侵入性检查项目为血清CEA、CA19-9,但两者的敏感性和特异性不高,更适用于结直肠癌患者的疗效监测[12]。因此,临床亟需一种无创且敏感性和特异性均较高的方法来筛查、诊断结直肠癌,特别是早期结直肠癌[13-14]。为此,本研究探讨了粪便SDC2基因甲基化在结直肠癌辅助诊断中的价值。
SDC2属于转化生长因子β通路相关基因,其与免疫监控及细胞增殖、侵袭、转移等密切相关;在结直肠癌中,SDC2主要调节细胞与肿瘤微环境的相互作用,使基质金属蛋白酶活化,分解细胞外基质,同时还参与了间质-上皮转化过程等生物学进程,促进肿瘤细胞的增殖和转移[15-16]。有研究发现,SDC2基因甲基化与结直肠癌关系密切,有良好的应用前景[17]。本研究结果显示,粪便SDC2基因甲基化诊断结直肠癌的AUC为0.965,最佳临界值(Ct值)为-38.1,敏感性为88.2%,敏感性显著优于目前临床常用指标(CEA和CA19-9)。提示将粪便SDC2基因甲基化用于结直肠癌筛查具有良好的应用前景。本研究结果还显示,结直肠癌Ⅰ~Ⅳ期患者粪便SDC2基因甲基化的阳性率分别为70%、85%、90%、94%,各分期间差异均无统计学意义(P>0.05);结直肠癌Ⅰ~Ⅲ期患者粪便SDC2基因甲基化阳性率显著高于血清CEA和CA19-9的阳性率(P<0.01)。提示粪便SDC2基因甲基化检测在早期结直肠癌的筛查中有较好的应用价值。这可能与SDC2参与了肿瘤的生长、浸润、转移有关。另外,粪便SDC2基因甲基化联合CEA检测可将阳性率提升至90.2%,有效提升了结直肠癌的检出率。
为了提升粪便SDC2基因甲基化的检测效率,本研究对P12自动化样本预处理仪与手工法预处理样本的效果进行了比对,结果显示2种方法预处理样本的检测结果呈正相关(r=0.994,P<0.001),一致性良好(kappa=0.845,P<0.001)。提示自动化样本预处理可以取代人工预处理,在样本量较大的情况下,采用自动化仪器预处理样本更快速,且更加规范,不宜出错和污染,有助于提升检测效率。
本研究的不足之处在于样本量较小,这可能与用于SDC2基因甲基化检测的粪便样本留取方式与一般粪常规不同,患者尚需要一个接受过程有关。相信随着更广泛的宣传和患者接受度的提高,粪便SDC2基因甲基化检测无创、简便、准确的优势将会进一步体现。
综上所述,粪便SDC2基因甲基化具有较高的敏感性,可用于结直肠癌的辅助诊断,在早期结直肠癌的筛查中也有较高的临床价值,具有良好的临床应用前景。

