桂皮醛抗念珠菌的敏感性及对细胞壁的影响
邓洁华 王佳 祁晓明 王刚生
摘要:為了研发靶向抗真菌药物,研究桂皮醛对念珠菌抗菌活性及对白念珠菌细胞壁的影响。参照CLSI的M27-A3方案,采用微量液基稀释法,测定桂皮醛对念珠菌(白念珠菌、热带念珠菌、克柔氏念珠菌)的抗菌作用。将白念珠菌的菌悬液(1×10 cfu/mL)加入到RPMI 1640液体培养基内,置于37 ℃孵育48 h后,离心、制片,在透射电镜下观察细胞结构,以卡泊芬净、氟康唑作对照。结果表明:桂皮醛、卡泊芬净、氟康唑对念珠菌的MIC分别为白念珠菌3.91,15.62,31.25 mg/L,热带念珠菌3.91,15.62,31.25 mg/L,克柔氏念珠菌3.91,31.25,>250 mg/L)。电镜显示,01%(质量分数)的桂皮醛只作用于白念珠菌细胞壁,致细胞壁外层溶解脱落,细胞核及细胞器溶解消失,但细胞膜仍然完整;0.1%(质量分数)的卡泊芬净致白念珠菌细胞壁完全溶解脱落变薄,同时细胞膜部分受损;0.1%(质量分数)的氟康唑致白念珠菌细胞膜溶解脱落,但细胞壁较完整。桂皮醛、卡泊芬净对念珠菌(白念珠菌、热带念珠菌、克柔氏念珠菌)均有较强的抗菌活性,氟康唑对白念珠菌、热带念珠菌也有较强的抗菌活性,但对克柔氏念珠菌显示耐药。桂皮醛的抗菌活性优于卡泊芬净,卡泊芬净优于氟康唑。桂皮醛作用于白念珠菌细胞壁而不影响细胞膜,卡泊芬净作用于白念珠菌细胞壁但对细胞膜也有一定影响,氟康唑作用于白念珠菌细胞膜,而不影响细胞壁。因此,桂皮醛有望成为一种靶向治疗念珠菌感染的理想药物。
关键词:中医学与中药学其他学科;桂皮醛 ;卡泊芬净;白念珠菌;氟康唑;抗菌活性;细胞壁;细胞膜;电镜
中图分类号:R285.5文献标识码:A
DOI: 10.7535/hbgykj.2022yx02005
Sensitivity of cinnamaldehyde to Candida and its effect on cell wall
DENG Jiehua WANG Jia QI Xiaoming WANG Gangsheng
(1Department of Dermatology and Venereology,Second Hospital of Hebei Medical University,Shijiazhuang,Hebei 050000,China;2Hebei Clinical Research Center for Dermatology and Venereology,Shijiazhuang,Hebei 050000,China;3Construction Unit of Sub-center of National Clinical Medical Research Center for Skin and Immune Diseases,Shijiazhuang,Hebei 050000,China;4Scientific Research Department,Second Hospital of Hebei Medical University,Shijiazhuang,Hebei 050000,China;5Electron Microscope Room Department,Second Hospital of Hebei Medical University,Shijia-zhuang,Hebei 050000,China;6Translational Medicine Center,Second Hospital of Hebei Medical University,Shijia-zhuang,Hebei 050000,China)
Abstract:In order to develop targeted antifungal drugs,the antifungal activity of cinnamaldehyde on Candida and its effect on the cell wall of Candida albicans were investigatedAccording to M27-A3 procedure of CLSI,the antibacterial effect of cinnamaldehyde on Candida (Candida albicans,Candida tropicalis,and Candida krusei) was determined by the micro-liquid dilution methodThe Candida albicans suspension (1×10 cfu/mL) was added to RPMI 1640 liquid medium,incubated at 37 ℃ for 48 h,centrifuged to prepare sections,and the cell structure was observed by transmission electron microscope,and Caspofungin and fluconazole were used as controlsThe results show that the MIC of cinnamaldehyde,caspofungin and fluconazole against Candida are as follows:Candida albicans 3.91,15.62,31.25 mg/L,Candida tropicalis 3.91,15.62,31.25 mg/L,Candida krusei 3.91,31.25,> 250 mg/LElectron microscope shows that 01% cinnamaldehyde only acts on the cell wall of Candida albicans,causing the outer layer of the cell wall to dissolve and fall off,the nucleus and organelles to dissolve and disappear,but the cell membrane is still intact;0.1% caspofungin causes the cell wall of Candida albicans to dissolve,fall off and thin,and the cell membrane is partially damaged0.1% fluconazole dissolves the cell membrane of Candida albicans,but the cell wall is relatively intactCinnamaldehyde and caspofungin have strong antibacterial activity against Candida (Candida albicans,Candida tropicalis,and Candida krusei),and fluconazole has strong antibacterial activity against Candida albicans and Candida tropicalis,but it shows resistance to Candida kruseiThe antibacterial activity of cinnamaldehyde is better than caspofungin,and caspofungin is better than fluconazoleCinnamaldehyde acts on the cell wall of Candida albicans without affecting the cell membraneCaspofungin acts on the cell wall of Candida albicans but also has a certain effect on the cell membraneFluconazole acts on the cell membrane of Candida albicans without affecting the cell wallCinnamaldehyde is expected to be an ideal drug for the targeted treatment of Candida infections
Keywords: traditional Chinese medicine and other disciplines of traditional Chinese pharmacy;Cinnamaldehyde;caspofungin;Candida albicans;fluconazole;antifungal activity;cell wall;cell membrane;electron microscope
念珠菌病是由各种致病性念珠菌引起的局部或全身感染性疾病,好发于免疫力低下患者,可侵犯皮肤、黏膜以及全身组织器官。近年来,随着糖皮质激素、广谱抗生素及免疫抑制剂的使用及介入性操作、器官移植、肿瘤放化疗的增多等危险因素,念珠菌感染率呈上升趋势[1]。当宿主免疫力低下时还可引起严重的深部组织器官的侵袭性感染或菌血症[2-3]。念珠菌是临床上深部真菌病感染的主要致病菌,感染率以白念珠菌居首位[4]。临床上为降低侵袭性念珠菌菌血症的发生,常预防性或经验性地使用唑类抗真菌药物,长此以往念珠菌对唑类药物的敏感性逐渐下降,形成耐药性[5]。唑类抗真菌药物作用于麦角甾醇生物合成通路上14a-去甲基化酶,抗真菌活性和较宽的抗菌谱,仅有抑菌作用而無杀菌效果[6-7]。新型抗真菌药物棘白菌素作为真菌细胞壁结构(1,3)-β-D-葡聚糖合成酶制剂,它能够通过破坏真菌细胞壁结构而杀伤真菌细胞[8]。由于真菌细胞壁是真菌细胞所独有并且为真菌生存所必须,不存在于哺乳动物的细胞中,所以以真菌细胞壁为靶位的抗真菌药物成为研究的热点。
桂皮醛常又称为肉桂醛、桂醛、β-苯丙烯醛(β-phenylacrolein)、3-苯基-2-丙烯醛,其化学名称为三苯基丙烯醛,系醛类化合物,为黄色液体,在肉桂等植物中含量较多,天然产物主要存在于桂皮油、藿香油、风信子油、玫瑰油等中,也可被人工合成。肉桂醛为反式结构,其分子是1个苯环连接1个丙烯醛,分子式为CHO,结构简式为CHCHCHCHO,相对分子质量为132.16。国内外对桂皮醛的大量药理研究表明,其具有抗炎、降糖、抗肿瘤、抗菌等多种药理活性[9-11],及对多种真菌的抗菌活性[12-13],尤其是对念珠菌的抗菌活性较强[14-15]。日益严重的侵袭性真菌感染致死率高,从资源丰富的植物药中寻找有应用价值的抗深部真菌感染药物有重要意义[16]。为此,本研究参照美国国家临床实验室标准化研究所(clinical and laboratory standards institute,CLSI)制订的M27-A3方案中酵母菌微量液基稀释法,检测桂皮醛对念珠菌的抗菌活性,进行其对白念珠菌细胞壁影响作电镜观察,并与卡泊芬净、氟康唑的抗真菌作用对照,为研发靶向抗真菌药物提供依据。
1材料与方法
1.1实验材料
1.1.1仪器和试剂
透射电子显微镜(JEM-1200EX型),日本电子株式会社(JEOL)提供;超净工作台,北京半导体一厂提供;离心机,美国雅培公司提供;电热恒温培养箱,上海精宏实验设备有限公司提供;光学显微镜,日本奥林巴斯株式会社(Olympus)提供;麦氏比浊管,法国Biomerieux公司提供;血细胞计数板,上海求精生化试剂仪器有限公司提供;96孔细胞培养板,浙江黄岩塑料制品厂提供;RPMI1640粉,美国Gibco公司提供;沙氏培养基原料,国药集团化学试剂有限公司上海分公司提供。
1.1.2菌株
标准株:白念珠菌(Candida albicans),中国科学院微生物研究所提供(ATCC90028)。临床株:白念珠菌、热带念珠菌、克柔氏念珠菌,均为河北医科大学第二医院真菌室保存菌株。
1.1.3药物
桂皮醛(纯度98%以上,批号20170101),湖北武汉远成共创科技有限公司提供;注射用醋酸卡泊芬净(批号20170910),默沙东公司提供;氟康唑(批号20170912),辉瑞制药有限公司提供;罗瑞(注射用氟康唑,批号20170912),山东罗欣药业集团股份有限公司提供。
1.2测定抗菌药物最低抑菌浓度(MIC)方法
1.2.1微量液基稀释法(M27-A3)[17]的制备
1)药物储存液的制备
将桂皮醛、卡泊芬净、氟康唑分别溶于高压灭菌后的9%(质量分数)吐温80生理盐水内,配制成0.5%(质量分数)的药物母液(5 mg/mL),置于冰箱保存备用。
2)药物敏感测试板的制备
用RPMI 1640液体培养基将配制好的药物储存液按所需测试浓度的2倍稀释后,加入一次性使用的96孔板第1—10孔(250~048 μg/mL),每孔100 μL,第11,12孔分别加入不含药物RPMI 1640液体培养基100,200 μL,其中第11孔为阳性生长对照,第12孔为阴性空白对照。
3)菌悬液的制备和接种
为保证受试菌株(白念珠菌、热带念珠菌、克柔氏念珠菌)的纯度和活力,将其连续转种至沙堡弱斜面培养基2次,35 ℃培养48 h,用3 mL无菌生理盐水制成菌悬液,于血细胞计数板上调整菌株浓度至1×10~5×10cfu/mL。用麦氏比浊管调整为0.5个麦氏单位。[JP3]用1640液体培养基将菌悬液稀释1 000倍,取100 μL接种于药物敏感测试板第1—11孔中。
4)孵育和终点判定
接种后的药物敏感测试板置于35 ℃恒温培养箱中培养24 h,采用视觉判定终点。药物敏感终点判读参照M27-A3中对微量液体培养基稀释法的标准,判断最低抑菌浓度(minimum inhibitory con-centration,MIC)。
1.2.2电镜标本的制备
1)0.1%(质量分数,下同)桂皮醛液基制备
取1 g桂皮醛加入到9 g吐温80中,溶解后逐渐加入到90 mL的1640液体培养基中,分装试管,每管15 mL,消毒灭菌。将白念珠菌(1×10 cfu/mL)0.5 mL接种于0.1%桂皮醛药基内,35 ℃震动培养24 h,离心取菌丝及孢子,再经生理盐水冲洗、离心后送透射电子显微镜(以下简称电镜)观测。0.1%(质量分数,下同)卡泊芬净和0.1%(质量分数,下同)氟康唑作对照。
2)电镜观察
分别取经0.1%的桂皮醛、卡泊芬净、氟康唑作用后的白念珠菌,用3%(质量分数)戊二醛磷酸缓冲液(pH值为7.4)洗后,1%(质量分数)锇酸双重固定,再逐级用丙酮脱水。环氧树脂包埋,制备超薄切片,醋酸双氧铀和枸橼酸钠溶液双重染色,于电镜下观察。
1.2.3统计学处理
采用SPSS 13.0软件进行数据分析。
2结果及分析
2.1桂皮醛实验组及卡泊芬净和氟康唑对照组对念珠菌的抗菌活性
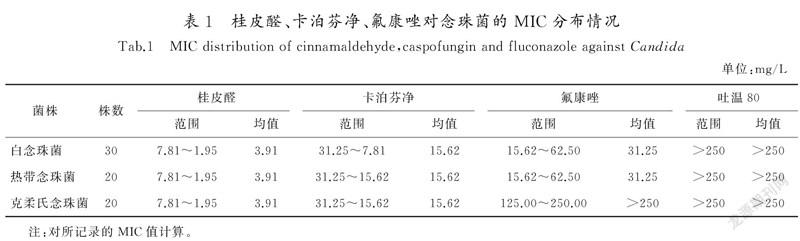
桂皮醛实验组对白念珠菌、热带念珠菌、克柔氏念珠菌的MIC均值均為3.91 mg/L;卡泊芬净对照组对白念珠菌、热带念珠菌的MIC均值为15.62 mg/L,对克柔氏念珠菌均值为31.25 mg/L;氟康唑对照组对白念珠菌、热带念珠菌均值为31.25 mg/L,对克柔氏念珠菌均值为> 250 mg/L。
结果表明,桂皮醛和卡泊芬净对白念珠菌、热带念珠菌、克柔氏念珠菌均有较强的抗菌活性,且桂皮醛优于卡泊芬净。氟康唑对白念珠菌、热带念珠菌也有较强的抗菌作用,但对克柔氏念珠菌显示耐药,结果见表1。
2.2电镜下桂皮醛、卡泊芬净和氟康唑对白念珠菌细胞壁的影响
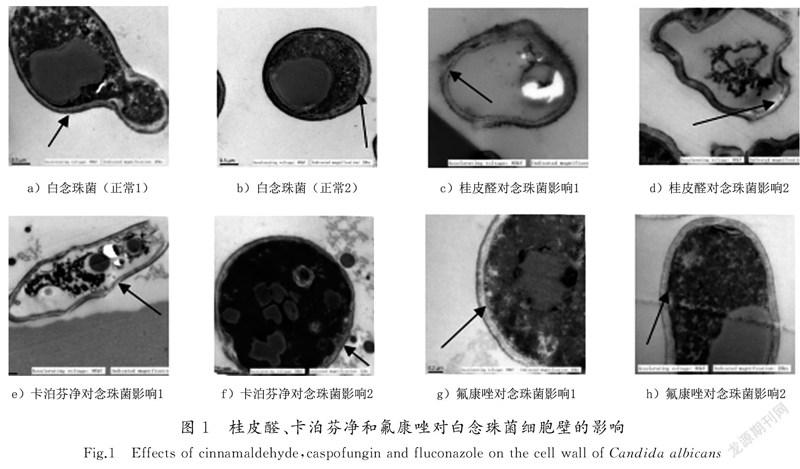
未经药物作用的白念珠菌在电镜下,白念珠菌芽生孢子细胞表面光滑,胞壁层次清楚,胞膜完整,胞核及内容物清晰(见图1 a)—b))。实验组的桂皮醛作用白念珠菌后,细胞形态呈不规则,外层胞壁缺损,不完整,胞核破坏,内容物消失,呈空泡状,但细胞膜较完整(见图1 c)—d));对照组的卡泊芬净作用白念珠菌后,细胞壁溶解变薄,胞核破坏,内容物消失,部分胞膜缺损(见图1 e)—f));对照组的氟康唑作用白念珠菌后,细胞壁较完整,但胞膜部分破坏或消失,不完整,内容物部分被破坏(见图1 g)—h))。
3讨论
目前,能有效治疗深部真菌感染尤其是免疫缺陷合并系统性侵袭性真菌感染的药物尚不多,深部真菌与其哺乳类宿主都是真核生物,在基因、结构和代谢等方面有许多相同之处。因此,研发理想抗真菌药物时应考虑到药物只作用于真菌特有的结构或代谢过程而不影响宿主,这样才能提高抗真菌药物的有效性和安全性。
1)桂皮醛的抗菌性优于卡泊芬净和氟康唑
本研究显示,桂皮醛、卡泊芬净对念珠菌(白念珠菌、热带念珠菌、克柔氏念珠菌)均有较强的抗菌活性,桂皮醛、卡泊芬净均优于氟康唑,二者比较桂皮醛优于卡泊芬净。实验进一步证明桂皮醛是最活跃的抗微生物的有效成分,依据其最低抑菌浓度(MIC)可预见桂皮醛将成为一种强有力的天然抗菌剂[18-19]。
2)桂皮醛对宿主不易产生副作用
电镜观察发现,桂皮醛作用白念珠菌后,细胞形态呈不规则,胞壁结构受损,胞壁外层脱落缺损,导致细胞内外的渗透压破坏、细胞器溶解,最终菌体破裂、死亡。但细胞膜仍然保持完整、无损、清晰。这说明桂皮醛只破坏真菌细胞壁而不影响细胞膜,对宿主不易产生毒副作用。研究进一步验证了谢小梅等[20]的研究发现,通过电镜和同位素标记发现桂皮醛作用于曲霉菌细胞壁后使其结构破坏,细胞内外物质交换受阻,影响了物质的吸收,生物大分子合成,从而抑制了真菌的生长繁殖。邓洁华等[21]通过电镜发现桂皮醛作用于曲霉菌细胞壁后使其结构破坏,但细胞膜不受影响。
3)卡泊芬净对宿主的毒副作用不确定
卡泊芬净是一种棘白菌素类抗真菌药物,作用机制主要是通过非竞争性抑制(1,3)-β-D-葡聚糖合成酶,干扰真菌细胞壁(1,3)-β-D-葡聚糖合成,导致真菌细胞壁渗透性改变,细胞溶解死亡[22-24]。张明等[25]发现棘白菌素类抗真菌药可抑制真菌细胞中(1,3)-β-D-葡聚糖合成酶导致细胞破坏菌体裂解死亡。卡泊芬净对大多数念珠菌具有杀菌作用,包括白念珠菌、热带念珠菌、克柔氏念珠菌、光滑念珠菌等[26]。本研究发现,卡泊芬净作用白念珠菌后,菌丝、孢子外层胞壁缺损,不完整,胞壁层次不清,变薄,胞核破坏,内容物消失,部分胞膜缺损,致细胞变性、死亡。这说明卡泊芬净主要破坏白念珠菌细胞壁,同时对细胞膜也有一定的影响,可能具有双向靶位抗菌作用,临床治疗真菌感染可能会产生一定的副作用。卡泊芬净作用在真菌细胞壁抑制真菌细胞中(1,3)-β-D-葡聚糖合成酶,但是卡泊芬净是否影响真菌细胞膜,尚未见相关报道。本研究发现卡泊芬净可能会对细胞膜有一定的影响,今后应进一步深入研究。
4)氟康唑对宿主易产生毒副作用
氟康唑对白念珠菌细胞壁无显著影响,对细胞膜有显著影响。这说明,氟康唑主要是作用在真菌细胞膜,对宿主易产生毒副作用。氟康唑为三唑类抗真菌药,其药理作用主要是对真菌依赖的细胞色素P450酶有高度特异性,可抑制真菌细胞膜麦角甾醇的生物合成,影响细胞膜的通透性,达到抑制真菌生长。因此,临床可见氟康唑具有显著的副作用。
4结语
深部念珠菌感染日益普遍且形势严峻,这已经成为业内关注的公共卫生问题[26],探讨桂皮醛抗深部念珠菌的抗菌活性及作用机理,对研发靶向抗真菌药物具有重要意义。实验表明,桂皮醛对念珠菌有很强的抗菌活性(其MIC分别为白念珠菌3.91 mg/L,热带念珠菌3.91 mg/L,克柔氏念珠菌3.91 mg/L)且优于卡泊芬净和氟康唑。电镜结果显示,桂皮醛作用白念珠菌后只破坏细胞壁而不影响细胞膜,对人类不易产生毒副作用。
在抗真菌药物研发方面,重点研发葡聚糖合成酶抑制剂,降低抗真菌药物的毒副作用,提高临床的治疗效果。但是,桂皮醛有望成为一种靶向治疗念珠菌感染的理想药物,今后在针对桂皮醛的药物研发工作中还应进一步注重深入探讨其作用机制,充分利用其多种药理活性使其发挥更大的临床价值。
参考文献/References:
[1]中国成人念珠菌病诊断与治疗专家共识组中国成人念珠菌病诊断与治疗专家共识[J].中国医学前沿杂志(电子版),2020,12(1):35-50Chinese Adult Candidiasis Diagnosis and Management Expert Consensus GroupChinese consensus on the diagnosis and management of adult candidiasis[J].Chinese Journal of the Frontiers of Medical Science(Electronic Version),2020,12(1):35-50.
[2]田洹2015~2017年某医院念珠菌感染及其耐药性分析[J].中国真菌学杂志,2019,14(1):37-41TIAN HuanCandida infection and drug resistance in a hospital from 2015 to 2017[J].Chinese Journal of Mycology,2019,14(1):37-41.
[3]王梦旻,陶智,贺伟侵袭性念珠菌血症致病菌耐唑类抗真菌药物的基因突变位点筛查结果分析[J]内蒙古医科大学学报,2019,41(4):396-398.
[4]答嵘,吴友伟,石红,等尿液培养念珠菌的菌群分布与药敏分析[J].重庆医学,2017,46(24):3390-3391.
[5]王皓旻,郭大文哈尔滨某医院住院患者无菌部位侵袭性真菌的分布及药物敏感性[J].哈尔滨医科大学学报,2017,51(3):240-243WANG Haomin,GUO DawenDistribution and antimicrobial susceptibilities of invasive fungi isolated from sterile sites of inpatients in a hospital of Harbin[J].Journal of Harbin Medical University,2017,51(3):240-243.
[6]孟玲寧,刘锦燕,李文静,等白念珠菌与生物膜相关的耐药机制[J].中国真菌学杂志,2017,12(2):124-127MENG Lingning,LIU Jinyan,LI Wenjing,et alThe resistance mechanisms of the biofilm related Candida albicans[J].Chinese Journal of Mycology,2017,12(2):124-127.
[7]李翠,吴永琴,陈艺升,等白念珠菌临床分离株吡咯类耐药机制研究[J].中国感染与化疗杂志,2017,17(4):397-403LI Cui,WU Yongqin,CHEN Yisheng,et alMechanism of azole resistance in the Candida albicans strains isolated from vulvovaginal candidiasis[J].Chinese Journal of Infection and Chemotherapy,2017,17(4):397-403.
[8]田超,史强,王晓玲棘白菌素类抗真菌药在儿童侵袭性念珠菌感染中应用的有效性和安全性的系统评价和Meta分析[J].中国药学杂志,2019,54(8):659-664TIAN Chao,SHI Qiang,WANG XiaolingThe efficacy and safety of echinocandins to invasive candidiasis in pediatric patients:A systematic review and Meta-analysis[J].Chinese Pharmaceutical Journal,2019,54(8):659-664.
[9]SAIFUDIN A,KADOTA S,TEZUKA YProtein tyrosine phosphatase 1B inhibitory activity of Indonesian herbal medicines and constituents of Cinnamomum burmannii and Zingiber aromaticum[J].Journal of Natural Medicines,2013,67(2):264-270.
[10]BALAGUER M P,LOPEZ-CARBALLO G,CATALA R,et alAntifungal properties of gliadin films incorporating cinnamaldehyde and application in active food packaging of bread and cheese spread foodstuffs[J].International Journal of Food Microbiology,2013,166(3):369-377.
[11]王迎春,王梦,曹文利,等HPLC法同时测定麻黄-桂枝药对水煎液中5种成分的含量[J].河北工业科技,2021,38(3):192-197WANG Yingchun,WANG Meng,CAO Wenli,et alSimultaneous determination of five constituents in the decoction of Ephedra-Cinnamomi Ramulus drug pair by HPLC[J].Hebei Journal of Industrial Science and Technology,2021,38(3):192-197.
[12]KOCEVSKI D,DU Muying,KAN Jianquan,et alAntifungal effect of Allium tuberosum,Cinnamomum cassia,and Pogostemon cablin essential oils and their components against population of Aspergillus species[J].Journal of Food Science,2013,78(5):M731-M737.
[13]LI Hongbo,SHEN Qingshan,ZHOU Wei,et alNanocapsular dispersion of cinnamaldehyde for enhanced inhibitory activity against aflatoxin production by Aspergillus flavus[J].Molecules,2015,20(4):6022-6032.
[14]SHARMA J,GAIROLA S,SHARMA Y P,et alEthnomedicinal plants used to treat skin diseases by Tharu community of district Udham Singh Nagar,Uttarakhand,India[J].Journal of Ethnopharmacology,2014,158(Pt A):140-206.
[15]YANG Fengqin,DING Shuqin,LIU Wei,et alAntifungal activity of 40 TCMs used individually and in combination for treatment of superficial fungal infections[J].Journal of Ethnopharmacology,2015,163:88-93.
[16]MASEVHE N A,MCGAW L J,ELOFF J N,et alThe traditional use of plants to manage candidiasis and related infections in Venda,South Africa[J].Journal of Ethnopharmacology,2015,168:364-372.
[17]CLSI M27-A3:3rd edition,Reference method for broth dilution antifungal susceptibility testing of yeasts [S].
[18]NAVEED R,HUSSAIN I,TAWAB A,et alAntimicrobial activity of the bioactive components of essential oils from Pakistani spices against Salmonella and other multi-drug resistant bacteria[J].BMC Complementary and Alternative Medicine,2013,13:265.
[19]陳丽星真菌毒素研究进展[J].河北工业科技,2006,23(2):124-126CHEN LixingMycotoxins and their research progress[J].Hebei Journal of Industrial Science and Technology,2006,23(2):124-126.
[20]谢小梅,张文平,付颖瑗,等肉桂醛与柠檬醛抗曲霉菌作用机制的研究[J].中草药,2004,35(4):430-432.
[21]邓洁华,李继红,祁晓明,等桂皮醛抗曲霉的敏感性及对烟曲霉细胞壁的影响[J].中国真菌学杂志,2018,13(6):345-349DENG Jiehua,LI Jihong,QI Xiaoming,et alComparison of sensitivity of cinnamaldehyde and caspofungin to Aspergillus oryzae and their effects on cell wall of Aspergillus fumigatus[J].Chinese Journal of Mycology,2018,13(6):345-349.
[22]张树敬,杨帆棘白菌素类药物[J].中国感染与化疗杂志,2012,12(5):393-396ZHANG Shujing,YANG FanEchinocandins[J].Chinese Journal of Infection and Chemotherapy,2012,12(5):393-396.
[23]刘秀书,邹爱英棘白菌素类抗真菌药临床应用研究进展[J].天津药学,2014,26(6):70-72.
[24]侯欣,徐英春,赵玉沛棘白菌素在念珠菌中的耐药性[J].中国真菌学杂志,2018,13(1):40-45HOU Xin,XU Yingchun,ZHAO YupeiEchinocandin resistance in Candida[J].Chinese Journal of Mycology,2018,13(1):40-45.
[25]张明,施毅棘白菌素类抗真菌药物的“矛盾现象”[J].中国感染与化疗杂志,2014,14(5):442-445ZHANG Ming,SHI YiThe paradoxical effects of echinocandins[J].Chinese Journal of Infection and Chemotherapy,2014,14(5):442-445.
[26]YAPAR NEpidemiology and risk factors for invasive candidiasis[J].Therapeutics and Clinical Risk Management,2014,10:95-105.

