阿尔茨海默病患者OCTA血流密度改变的Meta分析
邓 宇,刘自强,王建伟,李媛媛,接传红
0引言
阿尔茨海默病(Alzheimer’s disease,AD)是一种慢性进行性神经退行性疾病,通常表现为记忆、思维、定向、理解、计算、学习和语言等能力下降,是痴呆病最常见的病因,发病率与年龄呈正比[1]。AD病理过程较复杂,患者普遍有脑神经细胞外大量β-淀粉样蛋白(β-amyloid,Aβ)沉积形成的老年斑(senile plaques,SP)、tau蛋白异常磷酸化形成的细胞内神经原纤维缠结(neurofibrillary tangles,NFTs)、神经元丢失、神经营养不良、突触丢失等病理现象而导致脑深部萎缩等[2],其视网膜可见神经纤维层厚度和神经节细胞层厚度变薄[3],以及视网膜血管外Aβ斑块的沉积[4],常伴有视力障碍,包括视野狭窄、色差、对比敏感度缺陷、眼球运动异常和视觉诱发电位改变等眼部症状[5]。目前AD的诊断受到成本(如磁共振成像)、侵袭性(如脑脊液)、敏感性(如遗传标记物、血清淀粉样蛋白)、评估时间(神经心理学评估)等因素的限制[6]。
光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)是一种非侵入性的血管成像技术,可以在不使用造影剂的条件下快速获得不同层次视网膜和脉络膜血管的血流造影图像[7]。OCTA可以识别非灌注区、微动脉瘤和新生血管形成、血流密度(VD)等,这些参数可以量化和统计分析黄斑周边微血管损伤情况和中心凹无血管区面积[8]。人脑微血管与视网膜微血管有相似的解剖结构、生理特征,相同的胚胎起源,视网膜被认为是中枢神经系统的一部分,通过视神经与中枢神经系统相连[9],它是大脑发育的延伸,是中枢神经系统中唯一能够实现无创成像的部分,因此可以作为观察脑部疾病的独特窗口[10]。AD患者视网膜内丛状层厚度和视网膜神经纤维层厚度降低,呈退行性改变[11]。由于AD是一种脑部微血管病变为特征的疾病,OCTA可以量化观察视网膜微血管的变化,因此OCTA可能是潜在的早期筛查AD的工具。目前尚缺乏关于OCTA协助早期筛查AD的系统分析。本文收集2016-01/2021-09公开发表的关于AD患者OCTA黄斑区血流密度的研究并进行Meta分析,评估AD患者视网膜微血管变化的特征,为OCTA在AD的诊断和筛查中的应用提供可靠的证据。
1资料和方法
1.1资料
1.1.1文献检索检索资料库:Embase、Pubmed、The Cochrane Library数据库。检索策略:主题词加自由词。检索词:阿尔茨海默病主题词为“Alzheimer Disease”,自由词为“Alzheimer Dementia”“Alzheimer Dementias”“Dementia, Alzheimer”“Alzheimer’s Disease”“Dementia, Senile”“Senile Dementia”“Dementia, Alzheimer Type”“Alzheimer Type Dementia”“Alzheimer-Type Dementia (ATD)”“Alzheimer Type Dementia (ATD)”“Dementia, Alzheimer-Type (ATD)”“Alzheimer Type Senile Dementia”“Primary Senile Degenerative Dementia”“Dementia, Primary Senile Degenerative”“Alzheimer Sclerosis”“Sclerosis, Alzheimer”“Alzheimer Syndrome”“Alzheimer’s Diseases”“Alzheimer Diseases”“Alzheimers Diseases”“Senile Dementia, Alzheimer Type”“Acute Confusional Senile Dementia”“Senile Dementia, Acute Confusional”“Dementia, Presenile”“Presenile Dementia”“Alzheimer Disease, Late Onset”“Late Onset Alzheimer Disease”“Alzheimer’s Disease, Focal Onset”“Focal Onset Alzheimer’s Disease”“Familial Alzheimer Disease (FAD)”“Alzheimer Disease, Familial (FAD)”“Familial Alzheimer Diseases (FAD)”“Alzheimer Disease, Early Onset”“Early Onset Alzheimer Disease”“Presenile Alzheimer Dementia”;OCTA主题词为“Tomography, Optical Coherence”,自由词为“Coherence Tomography, Optical”“OCT Tomography”“Tomography, OCT”“Optical Coherence Tomography”。检索时间范围:2016-01/2021-09。
1.1.2文献纳入和排除标准

1.1.2.2排除标准(1)研究分组、研究对象不明确;(2)研究方案不符(综述、病例报道、基础实验研究等);(3)数据无法获取,数据存在明显错误;(4)无明确对照组,仅是自身对照的研究或个案;(5)研究目的与本研究不符合。
1.2方法
1.2.1数据提取由2名研究人员进行文献筛选,将文献的具体资料提取后进行交叉核对,研究人员之间的分歧可通过讨论解决。文献筛选步骤:首先根据题目和摘要判断是否符合纳入标准,排除明显不合格文献后,进一步进行全文阅读,根据纳入和排除标准进一步筛选文献,最后拟定纳入文献,并从中独立提取信息(第一作者、发表年份、研究类型、患者特征、随访时间和结局指标等)。
1.2.2文献质量评价队列研究采用纽卡斯尔-渥太华量表(NOS)进行质量评价,涉及干预对象的选择、可比性和结果测量等方面,满分为9分,其中NOS评分>5分为高质量研究。
统计学分析:采用RevMan 5.3软件(www.cochrane.org)制作风险偏倚评估图并进行数据的Meta分析。连续性变量采用均值差(MD)及95%可信区间(CI)进行合并,P<0.05表示差异有显著性意义。异质性则通过Q检验与卡方检验判断大小,当P≥0.1且I2≤50%时提示异质性的可能性小,采用固定效应模式;当P<0.1且I2>50%提示异质性存在的可能性大,采用随机效应模式并分析异质性的可能来源,可采用亚组分析作进一步分析。发表偏倚通过Egger检验进行判断,P>0.1表示无发表偏倚。
2结果
2.1文献筛选结果及纳入研究的基本信息根据设定的检索策略检索英文文献90篇,经剔除重复后获得54篇,阅读文章题目及摘要后筛选出文献11篇,最后阅读全文筛选出符合要求的文献10篇[12-21],纳入研究对象740例(眼),其中AD组321例,对照组419例。文献筛选流程及结果见图1。纳入研究的基本情况见表1。
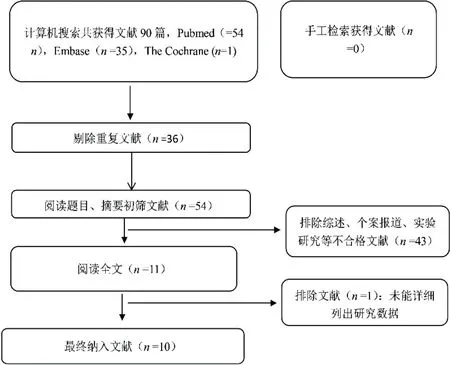
图1 文献筛选流程及结果。
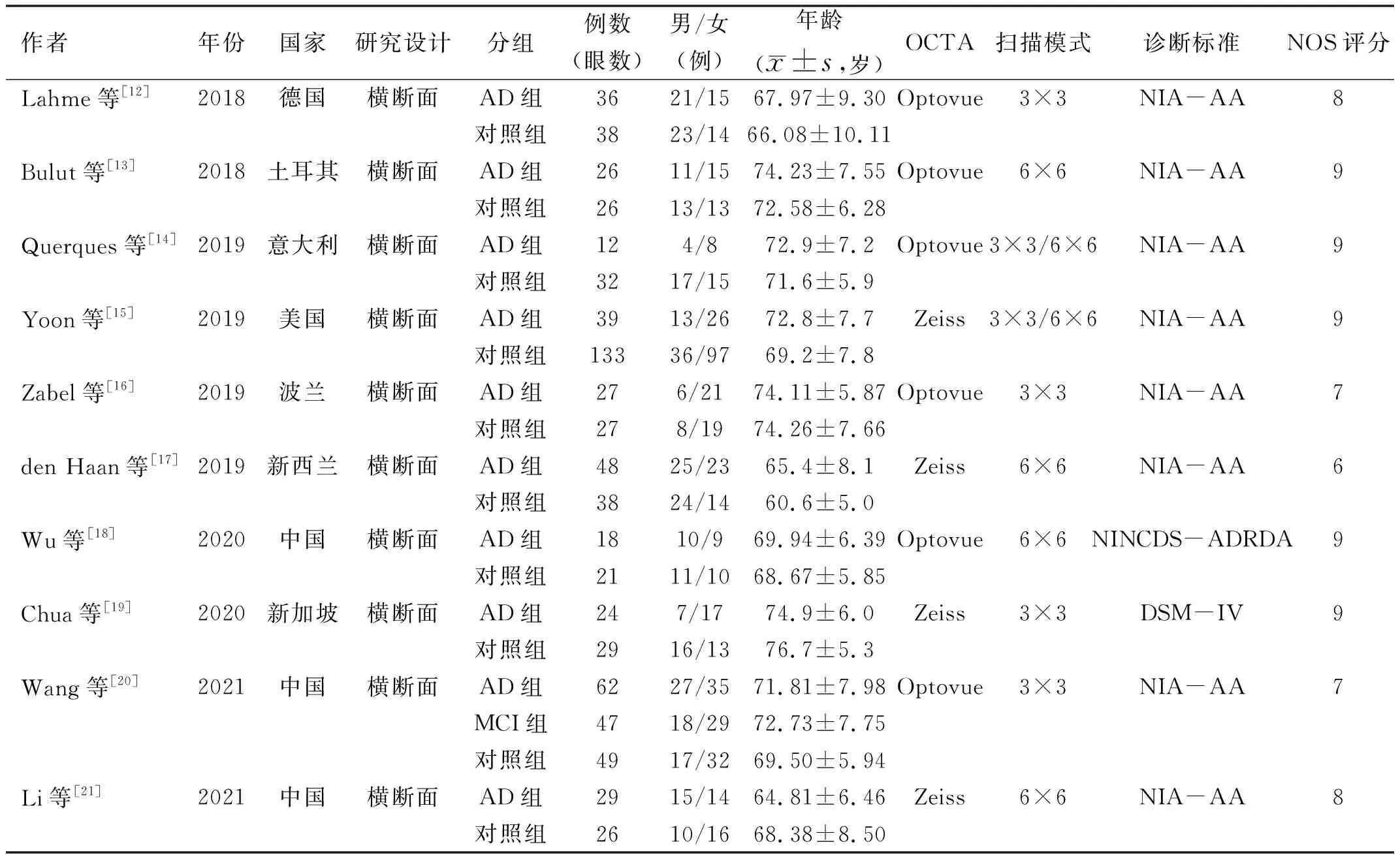
表1 纳入研究基本情况
2.2Meta分析结果
2.2.1浅层血流密度的Meta分析纳入的10篇文献均分析了黄斑区浅层血流密度情况,纳入研究对象740例(眼),其中AD组321例,对照组419例。进行异质性检验,各项研究存在异质性(I2=92%),剔除任意研究后异质性无明显下降,采用随机效应模型进行Meta分析,合并MD=-1.58(95%CI-2.60~-0.55,P=0.003),结果表明AD患者黄斑区浅层血流密度均低于对照组(图2)。使用Egger检验进行发表偏倚评估,结果显示P=0.542,提示无明显发表偏倚。
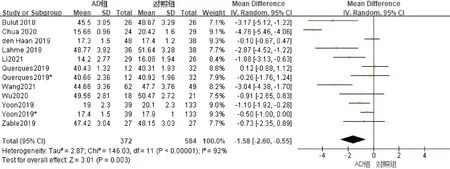
图2 浅层血流密度Meta分析的森林图。
按照扫描面积进行亚组分析,其中6篇文献使用了OCTA 3×3模式进行扫描,纳入研究对象508例(眼),其中AD组200例,对照组308例。进行异质性检验,各项研究存在异质性(I2=92%),剔除任意研究后异质性无明显下降,采用随机效应模型进行Meta分析,合并MD=-2.18(95%CI-3.83~-0.53,P=0.009);6篇文献使用了OCTA 6×6模式进行扫描,纳入研究对象445例(眼),其中AD组169例,对照组276例。进行异质性检验,各项研究存在异质性(I2=68%),剔除任意研究后异质性无明显下降,采用随机效应模型进行Meta分析,合并MD=-0.77(95%CI-1.47~-0.08,P=0.03),结果表明使用不同扫描模式,AD患者黄斑区浅层血流密度均低于对照组(图3)。使用Egger检验进行发表偏倚评估,结果显示3×3模式P=0.303,6×6模式P=0.147,均提示无明显发表偏倚。
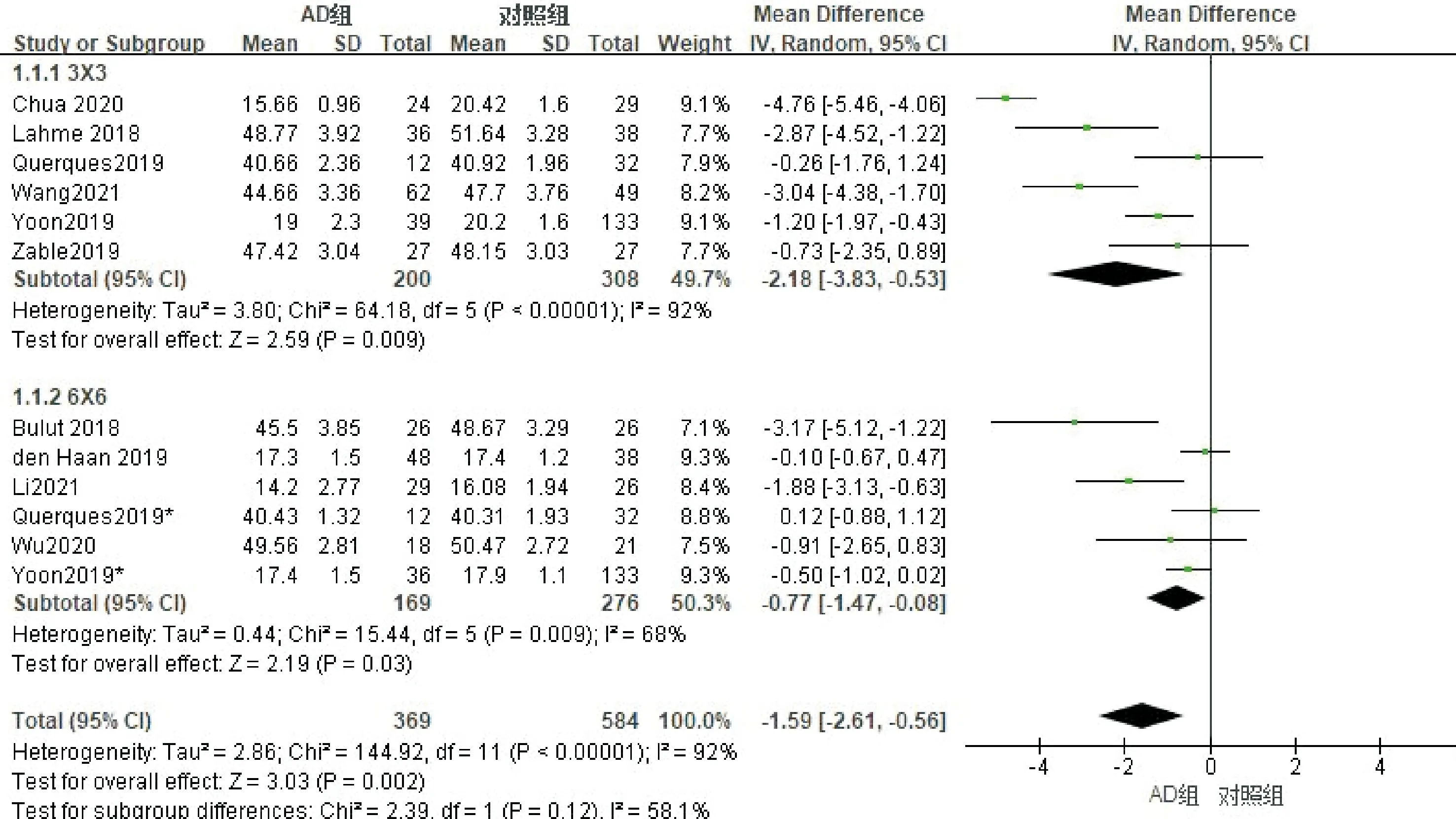
图3 浅层血流密度亚组Meta分析的森林图。
2.2.2深层血流密度的Meta分析纳入的文献中有6篇文献分析了黄斑区深层血流密度情况,纳入研究对象408例(眼),其中AD组203例,对照组205例。进行异质性检验,各项研究存在异质性(I2=94%),剔除任意研究后异质性无明显下降,采用随机效应模型进行Meta分析,合并MD=-2.72(95%CI-4.36~-1.07,P=0.001),结果表明AD患者黄斑区深层血流密度均低于对照组(图4)。使用Egger检验进行发表偏倚评估,结果显示P=0.346,提示无明显发表偏倚。
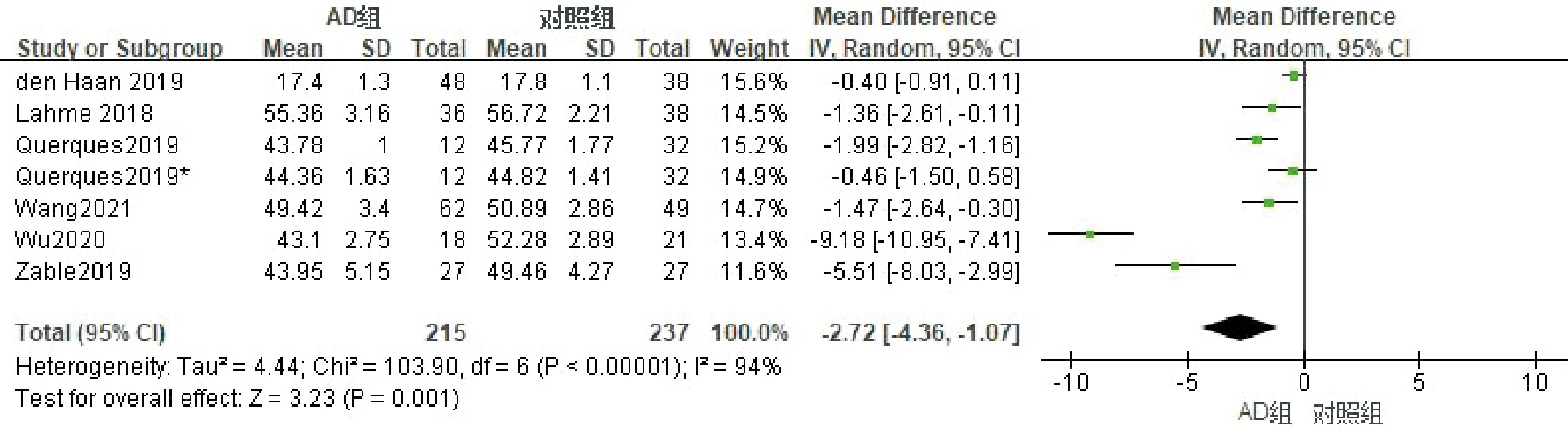
图4 深层血流密度Meta分析的森林图。
按照扫描面积进行亚组分析,其中4篇文献使用了OCTA 3×3模式进行扫描,纳入研究对象283例(眼),其中AD组137例,对照组146例。进行异质性检验,各项研究存在异质性(I2=77%),剔除任意研究后异质性无明显下降,采用随机效应模型进行Meta分析,合并MD=-1.82(95%CI-3.24~-0.39,P=0.01,图5);2篇文献使用了OCTA 6×6模式进行扫描,纳入研究对象130例(眼),其中AD组60例,对照组70例。进行异质性检验,各项研究不存在异质性(I2=0%),采用固定效应模型进行Meta分析,合并MD=-1.91(95%CI-2.72~-1.09,P<0.00001,图6),结果表明使用不同扫描模式,AD患者黄斑区深层层血流密度均低于对照组。使用Egger检验进行发表偏倚评估,结果显示3×3模式P=0.121,提示无明显发表偏倚;6×6模式仅有2项研究,故不进行发表偏倚评估。
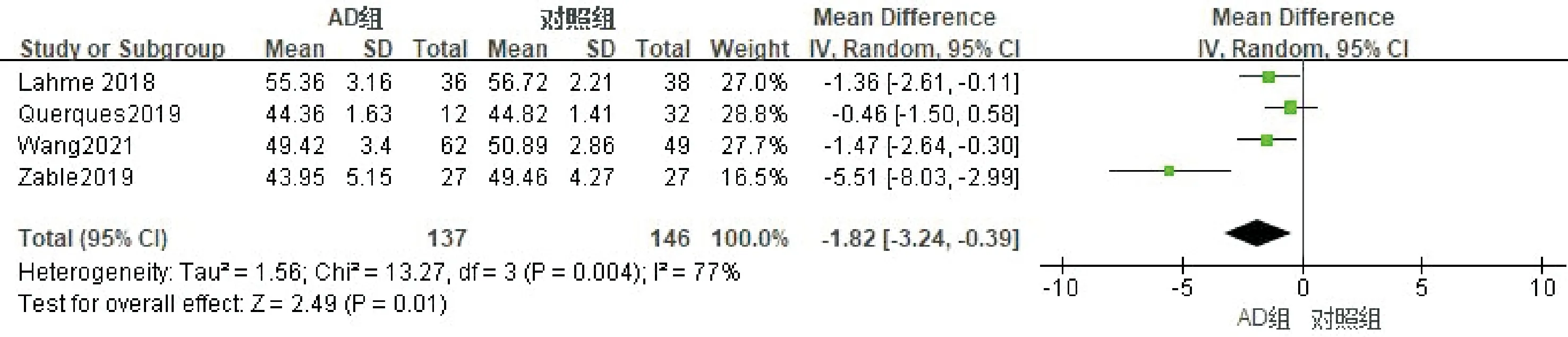
图5 深层血流密度3×3亚组分析的森林图。
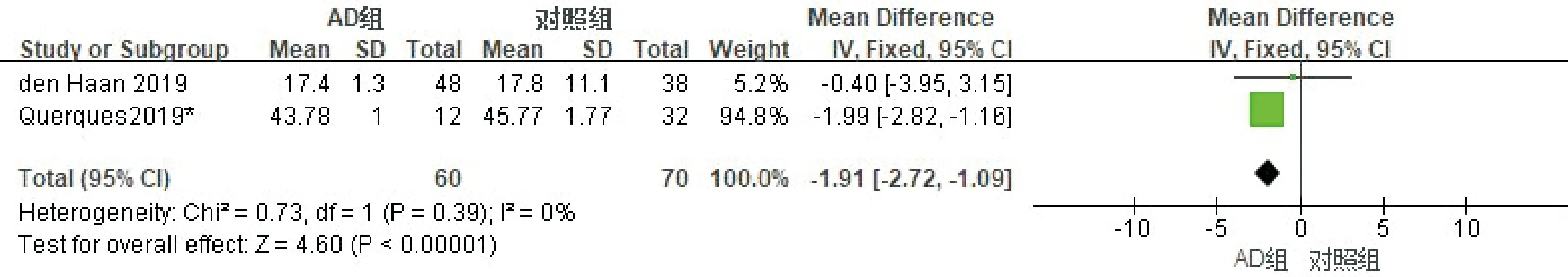
图6 深层血流密度6×6亚组分析的森林图。
2.2.3旁中心凹血流密度的Meta分析纳入的文献中有4篇文献分析了黄斑区旁中心凹血流密度情况,纳入患者388例患者(眼),其中AD组151例,对照组237例。进行异质性检验,各项研究存在异质性可能较小(I2=32%),采用固定效应模型进行Meta分析,合并MD=-1.44(95%CI-1.94~-0.94,P<0.00001),结果表明AD患者旁中心凹血流密度均低于对照组(图7)。使用Egger检验进行发表偏倚评估,结果显示P=0.027,提示无明显发表偏倚。
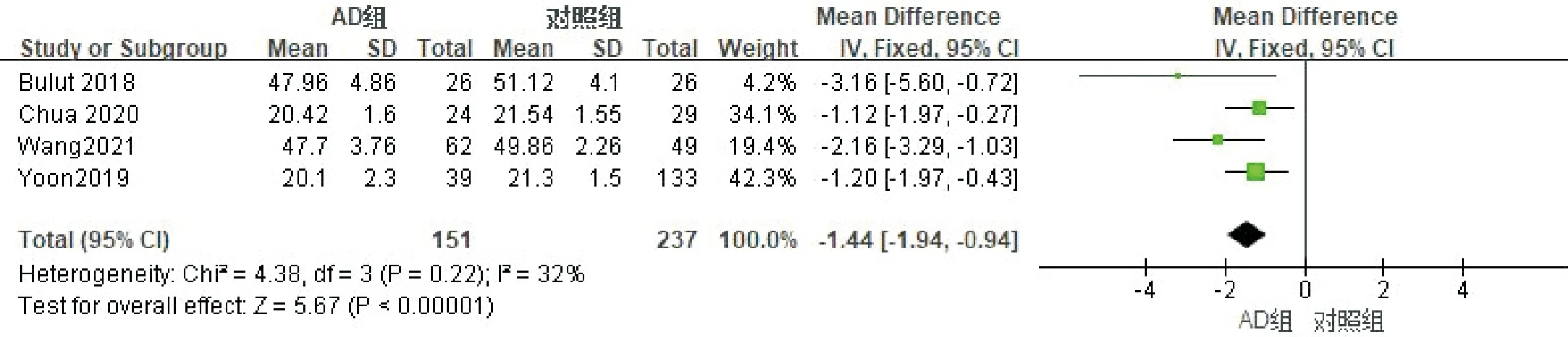
图7 旁中心凹血流密度Meta分析的森林图。
2.2.4FAZ面积的Meta分析纳入的文献中有5篇文献分析了FAZ面积情况,纳入患者417例(眼),其中AD组164例,对照组253例。进行异质性检验,各项研究存在异质性(I2=88%),剔除任意研究后异质性无明显下降,采用随机效应模型进行Meta分析,合并MD=0.05(95%CI-0.01~0.11),表明AD患者FAZ面积均大于对照组,但差异无统计学意义(P=0.13,图8)。使用Egger检验进行发表偏倚评估,结果显示P=0.13,提示无明显发表偏倚。
2.2.5敏感性分析通过逐一剔除单项研究的方法对各Meta分析的结果进行敏感性分析,发现数据结果与之前变化不明显,说明结果稳定可靠,见表2、3。
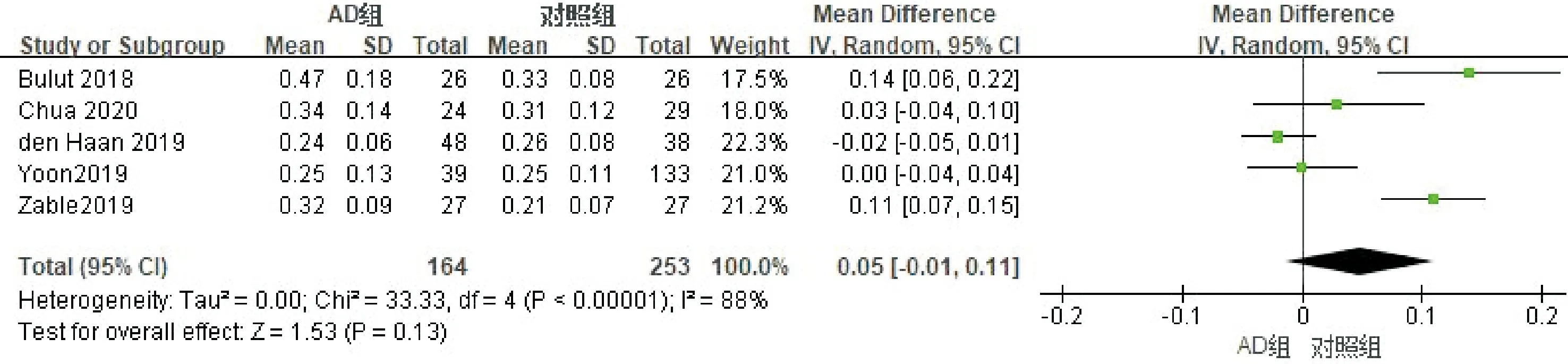
图8 FAZ面积Meta分析的森林图。
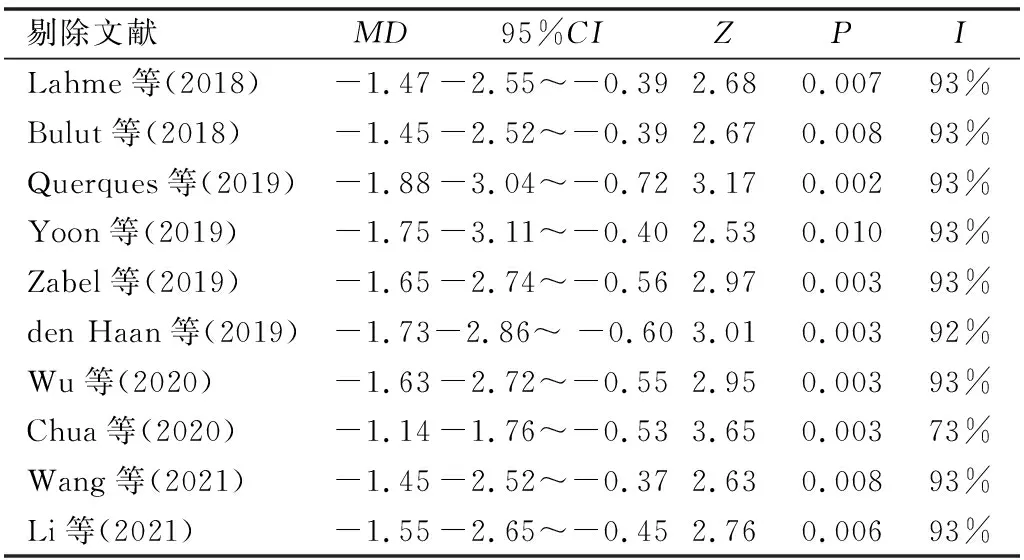
表2 浅层血流密度的指标敏感性分析
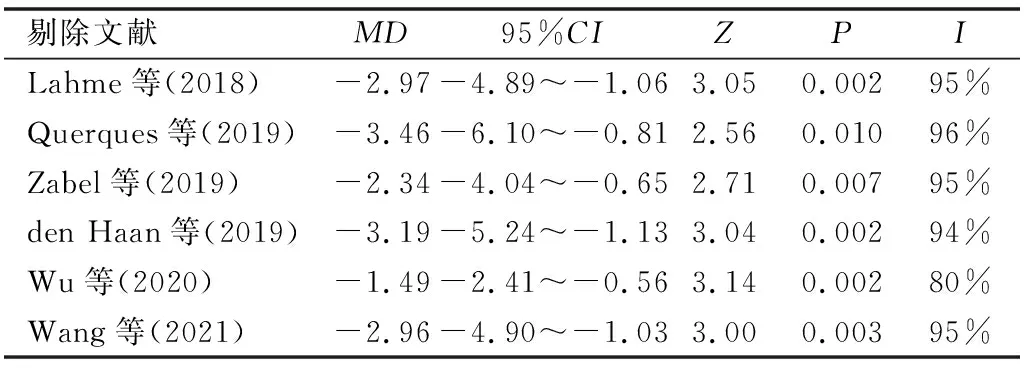
表3 深层血流密度的指标敏感性分析
3讨论
AD是一种神经系统功能退化性疾病,发病机制尚不明确,其复杂的病理现象仍有待系统地研究和观察,目前尚缺乏理想的临床治疗方案。微血管损伤是影响AD病理过程的重要因素[22]。动脉硬化特别是脑动脉粥样硬化的患者,AD发病率明显升高[23]。研究发现脑血流量与AD的发病机制有关[24],AD患者脑部血流低灌注会增加脑血管弯曲,降低血管密度[25]。由于脑血管无法直接观察和评估[26],视网膜和脑血管在胚胎发育以及生理和解剖学特征上相似[27],是观察大脑的最佳“窗口”,异常的视网膜血管系统可以作为相关脑部疾病的生物标志物[28]。Stefánsson等[29]发现AD患者的视网膜氧代谢受到影响,视网膜血管血氧饱和度升高。Cheung等[30]观察AD患者眼底照相和多普勒超声检查发现,AD患者视网膜血管形态改变、血流减少。
OCTA是一种非侵入性的血管成像技术,可以在不使用造影剂的条件下快速获得不同层次视网膜和脉络膜血管的血流造影图像[31]。使用OCTA扫描可将其视网膜血管分层为浅层毛细血管丛(SCP)、深层毛细血管丛(DCP)。OCTA可以识别非灌注区、微动脉瘤和新血管形成、血流密度等,可以量化和统计分析黄斑周边微血管损伤情况和FAZ面积[32]。OCTA有更好的可视性[33],可以检测出临床检查难以发现的视网膜微血管改变。越来越多的学者提出可将OCTA作为AD早期诊断的指标之一。
既往研究显示,AD患者存在一系列视网膜改变,包括视网膜血管狭窄、动脉粥样硬化、淀粉样血管病变[34]。本研究纳入了10篇AD患者OCTA相关研究,以血流密度为主要观察指标,综合分析了AD患者黄斑区血流密度的变化情况。结果发现在使用3×3、6×6两种模式的情况下,AD患者黄斑区浅层、深层血流密度值均低于对照组。分析可能与视网膜血管壁周围异常Aβ沉积有关[35]。大量Aβ沉积扰乱了视网膜血管和神经正常功能,使血管收缩性丧失,同时Aβ聚集体阻塞了较小的远端小动脉,导致氧气和血流量不足[36]。此外,AD患者视网膜周细胞凋亡增加,同时血管低密度脂蛋白受体相关蛋白1(LRP1)表达下调,导致Aβ清除率降低[37]。这些变化可能与血管密度降低有关。本研究分析了AD患者黄斑区浅层、深层、旁中心凹血流密度变化情况,结果表明在不同模式、不同类型仪器情况下,AD患者血流密度均低于对照组。尽管研究存在异质性,但其中每一篇研究的结果均显示AD患者OCTA血流密度低于对照组。因此其异质性来源可能是由于不同的设备其计算方式有误差,或者不同国家、不同人种的患者其血流密度可能不同导致。同时由于现有设备算法限制,在计算血流密度过程中浅层血管的伪影会影响深层血流密度的读数,可能也会导致研究结果的异质性。健康眼的FAZ是由浅层毛细血管、深层毛细血管共同划定的区域,典型的FAZ在健康人中呈圆形或椭圆形,测量面积约为0.231~0.280mm2[38]。本研究中有5篇文献对比了AD组与对照组FAZ面积的差异,进行Meta分析后发现AD组患者FAZ面积略大于对照组,但两组数据无统计学差异。总的来说,OCTA可以评估AD进展与视网膜微血管改变之间的关系,为临床早期诊断AD提供帮助。
OCTA设备中存在介质不透明时,血流密度测量会降低[39-40]。不同厂商的OCTA设备在计算血流密度、FAZ面积等指标时存在广泛的差异性,相同患者使用不同设备测量出的结果也可能存在显著差异[41]。在临床使用中应该考虑使用的OCTA设备与患者屈光间质之间的差异性[42]。目前还缺少为OCTA装置收集的不同种族的大量人群研究,以提供各个指标测量的标准化数据作为参考范围[43]。这些都可能是本研究存在较大异质性的潜在原因,同时也是限制OCTA在AD患者早期诊断中应用的原因。此外,在临床实践中发现糖尿病等多种原因也可能导致OCTA血流密度下降[44],因此尚需要进一步研究。

