小鼠视神经损伤后视网膜中TLR-9与MyD88表达变化
李雪颖,李 迪,陈丽平,李 静
0引言
外伤性视神经病变是常见的临床问题,研究发现闭合性颅脑外伤的患者中有0.5%~5%伴随有视神经损伤[1]。如发生颅面部骨折,视神经损伤(optic nerve injury,ONI)的发生率上升为10%[2]。目前对于外伤性视神经损伤主要的治疗方法还是视神经管减压术、糖皮质激素治疗、营养神经治疗及改善循环治疗[3]。研究报道视神经管减压术治疗外伤性视神经病变的有效率为50%~60%[4-5]。而药物、基因、干细胞移植等一些治疗方法的效果也不确切。目前创伤性视神经损伤的治疗仍是临床面临的难题。
Toll样受体-9(Toll like recepter 9,TLR-9)是Toll样模式识别受体家族成员之一,是Hemmi等[5]在2000年发现的Tolls家族新成员,表达于免疫细胞,通过与细菌DNA作用而诱导机体的固有免疫反应。髓样分化因子(myeloid differentiation factor 88,MyD88)是TLR-9和其他TLRs的衔接分子[6-7]。近年发现TLR-9在很多疾病进程中起重要作用,而TLR-9是否参与视神经损伤的病理过程鲜见报道。本实验旨在研究TLR-9及其衔接分子MyD88在视神经损伤后的变化特点,为视神经损伤病变的治疗提供新的思路。
1材料和方法
1.1材料选取清洁级8周龄雄性C57BL/6J小鼠36只,无眼疾(由西安交通大学医学部实验动物中心提供)。动物饲养保持12h昼夜交替的生物节律,能自由饮用水和食物,室温保持在20℃~24℃条件下每日定时清洗笼舍。饲养环境及实验操作均符合国家科学技术委员会《实验动物管理条例》规定,并获得陕西省人民医院动物伦理委员会许可。随机分为6组每组6只:空白对照组(未做任何处理)、ONI 1d组(视神经损伤后1d取材)、ONI 3d组(视神经损伤后3d取材)、ONI 5d组(视神经损伤后5d取材)、ONI 7d组(视神经损伤后7d取材)、ONI 14d组(视神经损伤后14d取材),分组后进行造模。
1.2方法
1.2.1视神经损伤模型1%戊巴比妥钠(50mg/kg)腹腔注射麻醉,经颞侧入路显露左侧视神经,延长轴方向剪开神经鞘,分离视神经,避免损伤视网膜中央动脉。于球后0.5~1mm处夹持视神经,夹持时间为5s。手术完术眼涂红霉素眼膏,放置于电热毯上苏醒。苏醒后于动物房中正常饲养。1%戊巴比妥钠腹腔注射安乐处死小鼠。模型制作成功标准:伤后10min瞳孔散大,间接对光反射存在,直接对光反射消失,且眼底明确未损伤大鼠眼动脉、眼底供血情况恢复良好。30只模型鼠经确认均建模成功。
1.2.2RT-qPCR 视神经损伤后1、3、5、7、14d利用RNeasy Lipid Tissue Mini Kit试剂盒(QIAGEN, Germany)从小鼠视网膜提取总RNA,然后用逆转录酶Ⅲ(Invitrogen, USA)和寡核苷酸oligo-dT将总RNA转录成cDNA。用UNICONTM qPCR SYBR®Green Master Mix试剂盒(Yeasen,Shanghai,China)在StepOnePlus unit(Applied Biosystems, USA)实时荧光定量PCR仪上完成RT-qPCR检测。方法:94℃预变性55s,然后进行一下循环:95℃变性30s,57℃退火30s,73℃延伸30s,共进行45个循环。然后再95℃变性10s,65℃退火45s,40℃延伸60s。使用2-△△Ct方法计算相对mRNA水平。甘油醛-3-磷酸脱氢酶(GAPDH)作为内参。引物序列如下:TLR-9:正向引物,5’-GCA ATG TTC TAT ATG CAT TCT C-3’,反向引物,5’-TGA TAT TGG CAC ACC AAC AC-3’;MyD88:正向引物,5’-AGG GTC GCA CAG TGG GTG A-3’,反向引物,5’-CGT GTT CTC TTG CGC ATT CC-3’。
1.2.3Western-blot 视网膜组织在lysis buffer(Roche Biochemicals, USA)缓冲液中裂解。Pierce BCA Protein Assay Kit(Thermo Fisher Scientific, USA)蛋白质分析试剂盒测定蛋白浓度。通过SDS-PAGE(Invitrogen)分离等量的蛋白质,然后将其转移到聚偏二氟乙烯(PVDF, Millipore, USA)膜中。在室温下用5%脱脂牛奶封闭1.5h后,将膜与一抗TLR-9(ab134368)(以1∶1000稀释)、一抗MyD88(ab219413)(以1∶1000稀释)和GAPDH(ab9485)(以1∶1000稀释)在4℃下孵育过夜,将膜与辣根过氧化物酶偶联的二抗山羊抗小鼠IgG(Bio-Rad,USA)(以1∶1000稀释)或二抗山羊抗兔IgG(Bio-Rad)(以1∶1000稀释)在常温下孵育1.5h。用增强的化学发光试剂检测蛋白条带,并用Image J系统定量。GAPDH为内参。

2结果
2.1各组小鼠视网膜中TLR-9mRNA和TLR-9蛋白表达变化情况各组小鼠视网膜中TLR-9 mRNA的表达量比较差异有统计学意义(F=560.1,P<0.0001),见表1。RT-qPCR结果见图1。ONI 1d组视网膜中TLR-9 mRNA的表达量与空白对照组比较差异无统计学意义(P>0.05);ONI 3d、ONI 5d、ONI 7d、ONI 14d组视网膜中TLR-9 mRNA的表达量与空白对照组比较明显增加,差异均有统计学意义(P<0.01)。各组小鼠视网膜中TLR-9蛋白的表达比较差异有统计学意义(F=305.5,P<0.0001),见表1。Western-blot结果见图2。ONI 1d组视网膜中TLR-9蛋白的表达量与空白对照组比较差异无统计学意义(P>0.05);ONI 3d、ONI 5d、ONI 7d、ONI 14d组视网膜中TLR-9蛋白的表达量与空白对照组比较明显增加,差异均有统计学意义(P<0.01)。TLR-9 mRNA和TLR-9蛋白的变化规律为ONI 3d表达开始升高,ONI 5d达到顶峰,ONI 7d表达开始下降,ONI 14d表达依然高于空白对照组。

图1 RT-qPCR检测各组小鼠视神经损伤后TLR-9 mRNA的表达情况 bP<0.01 vs 空白对照组。

表1 各组小鼠视网膜中TLR-9和MyD88的表达情况
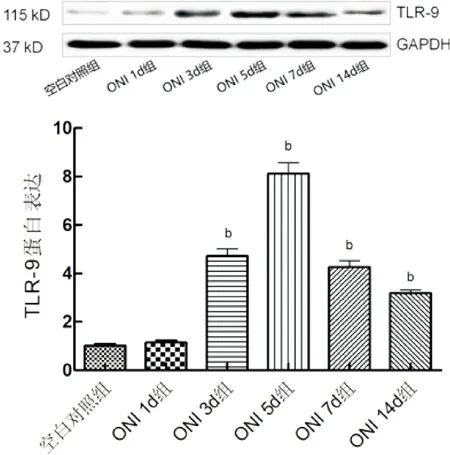
图2 Western-blot检测小鼠视神经损伤后TLR-9蛋白的表达情况 bP<0.01 vs 空白对照组。
2.2各组小鼠视网膜中MyD88mRNA和MyD88蛋白表达变化情况各组小鼠视神经损伤后视网膜中MyD88 mRNA的表达比较差异有统计学意义(F=439.3,P<0.0001),见表1。RT-qPCR结果见图3。ONI 1d组视网膜中MyD88 mRNA的表达量与空白对照组比较差异无统计学意义(P>0.05);ONI 3d、ONI 5d、ONI 7d、ONI 14d组视网膜中MyD88 mRNA的表达量与空白对照组比较均明显增加,差异均有统计学意义(P<0.01)。各组小鼠视神经损伤后视网膜中MyD88蛋白的表达比较差异有统计学意义(F=422.6,P<0.0001),见表1。Western-blot结果见图4,ONI 1d组视网膜中MyD88蛋白的表达量与空白对照组比较差异无统计学意义(P>0.05);ONI 3d、ONI 5d、ONI 7d、ONI 14d组视网膜中MyD88蛋白的表达量与空白图3RT-qPCR检测小鼠视神经损伤后MyD88mRNA的表达情况bP<0.01vs空白对照组。

对照组比较均明显增加,差异均有统计学意义(P<0.01)。MyD88 mRNA和MyD88蛋白的变化规律为ONI 3d表达开始升高,ONI 5d达到顶峰,ONI 7d表达开始下降,ONI 14d表达依然高于空白对照组。
3讨论
视神经是中枢神经的一部分,是将视觉信息从眼部传输到大脑的重要结构,视神经损伤后会激活多种继发性损伤机制,从而导致不可逆的视力损伤[8]。临床对于视神经损伤的治疗主要有手术治疗和药物,手术的有效率在一半左右,而药物治疗的疗效也不确定,能不能有更好的治疗方法来挽救视神经损伤患者的视力仍是我们要迫切解决的问题。
Toll样受体(TLRs)家族是一类重要的表面模式识别受体,其信号通路是介导免疫细胞产生固有免疫应答的极为重要的机制。人类TLR家族已发现10个成员(TLR1~10),可分为两类:表达于细胞膜上和表达于胞内细胞器膜上。TLR-9表达于细胞器膜上,主要识别细胞质中的病毒或细菌[9]。TLRs可以在多种疾病中参与炎症反应的过程[10-12]。有研究发现阻断TLR介导的MyD88依赖的MAPK信号通路能够减轻颗粒物诱导的炎症反应[13]。也有研究发现TLR-9的缺乏会加重一些自身免疫性疾病的病情。有研究发现狼疮倾向的Sle1小鼠与TLR-9缺乏的鼠杂交形成Sle1TLR-9小鼠,小鼠病情比Slel小鼠更加严重[14]。TLR-9在眼科相关疾病的研究少见报道,我们的研究发现视神经损伤后视网膜中的TLR-9 mRNA和TLR-9蛋白水平都显著增加,与空白对照组比较具有统计学意义,这提示TLR-9可能在视神经损伤的病程中起重要作用。但是它对疾病的发展起到的是正向的作用还是负向的作用还有待我们进一步研究。
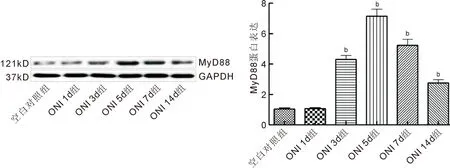
图4 Western-blot检测大鼠视神经损伤后MyD88蛋白的表达情况 bP<0.01 vs 空白对照组。
有研究发现,眶内视神经损伤后5~6d视网膜神经节细胞开始不可逆的凋亡[15]。我们的研究也发现了视神经损伤后TLR-9在视网膜中表达变化的规律,TLR-9的表达在视神经损伤后3d开始升高,损伤后5d达到顶峰,损伤后7d表达开始下降,TLR-9的表达早于神经节细胞开始凋亡的时间,TLR-9的升高可能与神经节细胞的凋亡有关。这也为我们后续的研究提供的一定的实验基础,也为治疗干预的时间窗选择提供了依据。
MyD88基因主要表达于免疫细胞中,最初在髓样细胞的分化过程中被发现,是细胞质中的一种可溶性蛋白。MyD88是细胞内信号传导的关键衔接蛋白,能够介导多种Toll样受体(TLRs)、白细胞介素1受体(IL-1R)及白细胞介素-18受体(IL-18R)的信号传递,在固有免疫中担任重要角色[16]。研究发现大鼠视神经损伤后TLR-4与MyD88表达增加,脂肪干细胞移植能够降低视神经损伤大鼠TLR-4与MyD88表达,改善大鼠的视功能[17]。Syeda等[18]对MyD88基因敲除小鼠的研究发现,与空白对照组相比基因敲除组促炎性细胞因子分泌显著减少,激活的视网膜小胶质细胞数量减少、聚集减弱,视网膜光感受器细胞的凋亡坏死明显减少。我们的研究发现小鼠视神经损伤后MyD88的表达变化规律与TLR-9的表达变化规律是一致的,这也证明TLR-9/MyD88信号通路与小鼠视神经损伤进程的相关性。MyD88激动剂和抑制剂可以调节MyD88的表达,从而在疾病中起到治疗的作用。
视神经损伤的治疗是临床的难题,我们的研究发现TLR-9和MyD88可能是视神经损伤疾病病程进展过程的重要影响因素,调节TLR-9和MyD88的表达可能成这类疾病治疗的一个靶点。

