青岛文昌鱼AHR和ARNT的鉴定和表达分析及相互作用研究
刘颖超, 程 潇, 宋丽丽, 张 宇
(中国海洋大学海洋生命学院, 山东 青岛 266003)
生物在长期演化过程中,形成了由一系列基因家族和反应通路组成的化学防御系统,以抵御环境中异生物质如微生物产物、重金属、多环芳烃、植物毒素等的伤害。其中,化学感受器是化学防御系统的重要组成,这些蛋白的功能是感知异生物质,并启动生物转化酶基因和转运蛋白基因的表达,以减除异生物质的毒害[1-2]。
芳香烃受体(Aryl hydrocarbon receptor, AHR)和芳香烃受体核转运蛋白(Aryl hydrocarbon receptor, AHR)都是重要的化学感受器,同属于bHLH-PAS(Basic helix-loop-helix/Per-Arnt-Sim)转录因子超家族[3-6],该家族成员的特征是具有bHLH和PAS功能域。AHR是配体依赖性的转录因子,可被多种内源性或外源性配体激活,包括多环芳香烃(PAHs,如苯并芘、苯并蒽)、多氯联苯(PCBs)、卤代多环碳氢类化合物(如二噁英TCDD、联二苯)、吲哚类等[7-10]。经典信号通路中,AHR能够与ARNT形成异二聚体并启动多种生物转化酶基因的表达。未出现配体时,AHR存在于细胞质中并处于失活状态,与一些分子伴侣稳定结合,包括两分子的90 kDa热激蛋白90(Heat shock protein 90, Hsp90)、p23以及AHR相互作用蛋白(AIP/XAP2/Ara9)。当AHR与TCDD、PCBs等配体结合后,AHR被激活并与分子伴侣解离,AHR/Hsp90复合体进入细胞核。在细胞核中,ARNT取代Hsp90,与AHR形成异二聚体,识别并结合下游靶基因启动子区域的应答元件(AHRE、DRE或XRE),从而启动细胞色素P450酶(Cytochrome P450,CYPs)家族基因等下游基因的转录。其中,CYP1s是研究最充分的AHR靶基因,其参与多种AHR配体的代谢激活和解毒[11-14],该经典通路也被称为AHR-CYP信号通路。
在脊椎动物中,AHR-CYP信号通路已明确是参与化学防御的重要机制。而无脊椎动物是否同脊椎动物一样,依靠AHR-CYP信号通路抵御外源有毒物质的伤害仍有争议[5,15-17]。Hahn[5]认为,脊椎动物AHR通过基因复制致使该基因获得能够与二噁英等外源物质结合的能力。而无脊椎动物的原型AHR主要参与动物发育过程,不具有与这些外源异生物结合的能力[14]。然而,也有研究表明,在苯并(a)芘、PCB126和TBT这些典型AHR配体的刺激下,剑水蚤(Tigriopusjaponicus)[16]和栉孔扇贝(Chlamysfarreri)[17]的AHR和ARNT基因均表达上调,且栉孔扇贝的CYP1A1以及雌激素受体基因的表达也被激活,暗示这两种海洋无脊椎动物中可能存在潜在的AHR-CYP信号通路。
头索动物文昌鱼,位于脊椎动物和无脊椎动物的的进化节点上,常作为研究脊椎动物起源的模式动物。目前,对文昌鱼AHR和ARNT在化学防御系统中的作用仍缺少了解,文昌鱼中是否存在类似脊椎动物的AHR-CYP信号通路也仍不清楚。本研究中克隆鉴定了青岛文昌鱼(Branchiostomajaponicum)ahr和arnt基因,并对这2个基因的结构域和系统进化关系展开了分析,通过qRT-PCR进行了组织表达分析,以及类二噁英PCB126胁迫后的表达分析。此外,还通过构建原核表达载体,获得了青岛文昌鱼AHR功能域和ARNT重组蛋白,并利用ELISA结合实验,分析了青岛文昌AHR功能域和ARNT的结合作用。本研究为深入探索文昌鱼AHR和ARNT在化学防御系统中的作用奠定了基础,丰富和拓展对AHR-CYP信号通路进化方面的认识。
1 材料与方法
1.1 实验材料和试剂
实验所用文昌鱼处于繁殖季节(5月下旬—7月中旬),取自青岛市沙子口附近海域,室温避光养殖在装有沙子和海水的水箱中,用气泵保证氧气供给,每天喂食螺旋藻至实验前取用。本研究所进行的动物实验均符合山东省实验动物管理局伦理委员会(许可证号:SD2007695)。PCB126(3,3’,4,4’,5-五氯联苯,纯度>99%)购自Sigma公司。
1.2 文昌鱼ahr和arnt基因克隆和测序
实验前三天停止喂文昌鱼,排空其消化道,取10条文昌鱼放入研钵并倒入液氮,将鱼研磨成粉末并转入RNA专用EP管中(盛有200 μL的TRIZOL试剂),继续研磨使其呈匀浆态,补足1 mL的TRIZOL试剂,得到的样品使用Total RNA Kit Ⅰ试剂盒(生产商:Omega Bio-Tek, Norcross, Georgia, USA),按照说明书步骤进行总RNA的提取。使用Reverse Transcription System反转录试剂盒,按照说明书步骤对RNA进行反转录及cDNA合成。扩增文昌鱼ahr和arnt基因(分别命名为Bjahr和Bjarnt)的全长开放阅读框(ORFs)的方法:首先,在青岛文昌鱼转录组(未公布数据)中BLAST搜索得到青岛文昌鱼ahr和arnt基因候选序列,利用Primer5软件设计两组引物进行PCR扩增,引物序列为:ahr-s:5’-AGTTCGGACGGGATCGCTT-3’,ahr-as:5’-GCACTTCACGGCACAACCTTTA-3’,arnt-s:5’-GACTGCTTAGCCCATCATCGT-3’,arnt-as:5’-TATGCCACATCAACAGACTTTCC -3’;其次,扩增产物用凝胶提取试剂盒(生产商:Omega Bio-Tek, Norcross, Georgia, USA)进行纯化,并将回收产物与pGEM-T载体(生产商:Promega, Madison, Wisconsin, USA)连接;最后,连接好的质粒转化入Trans5α大肠杆菌感受态细胞中进行培养,取阳性克隆株送上海桑尼生物科技有限公司进行Bjahr和Bjarnt测序。
1.3 序列分析和结构预测
利用NCBI数据库(http://www.ncbi.nlm.nih.gov/)、Ensemble数据库(http://asia.ensembl.org/index.html)及UniProt数据库(https://www.uniprot.org)进行同源序列检索。利用DNASTAR软件预测ORF序列,基因编码的氨基酸序列,预测蛋白的分子量(MW)以及等电点(pI)。通过在线分析软件SMART (http://smart.embl-heidelberg.de/)预测蛋白序列的结构域以及该蛋白序列的信号肽序列。蛋白的三级结构通过SWISS MODEL网站(http://swissmodel.expasy.org/),分别以人类AHR和ARNT蛋白的晶体结构为模板进行预测。利用DNASTAR软件中MegAlign下的ClustalW进行蛋白多序列比对。使用MEGA6.0软件以邻接法(NJ)建构系统发生树,Bootstrap 值设为1 000,所用序列编号见表1、2。
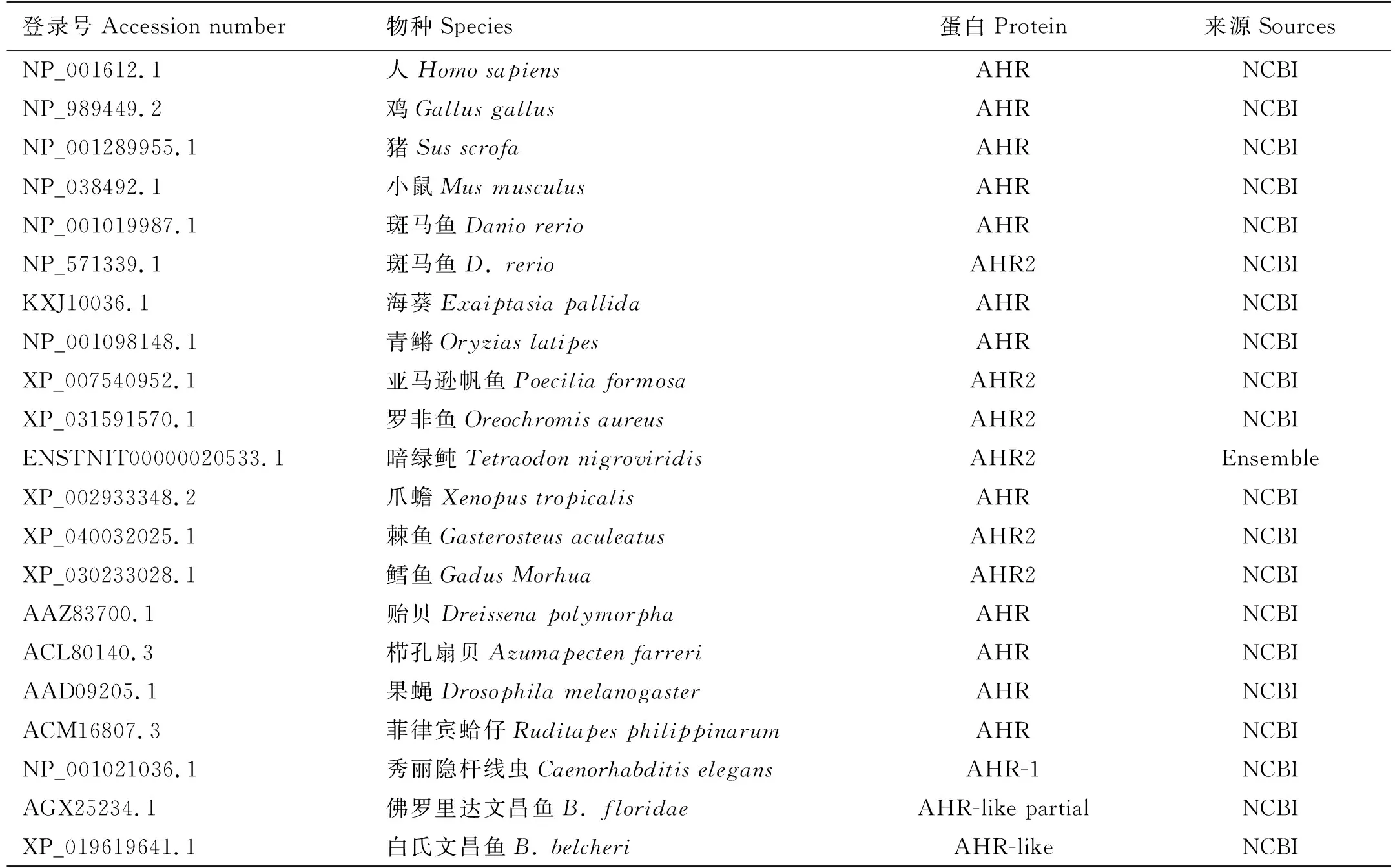
表1 AHR系统进化树分析所用序列编号Table 1 AHR sequences used in phylogenetic analysis
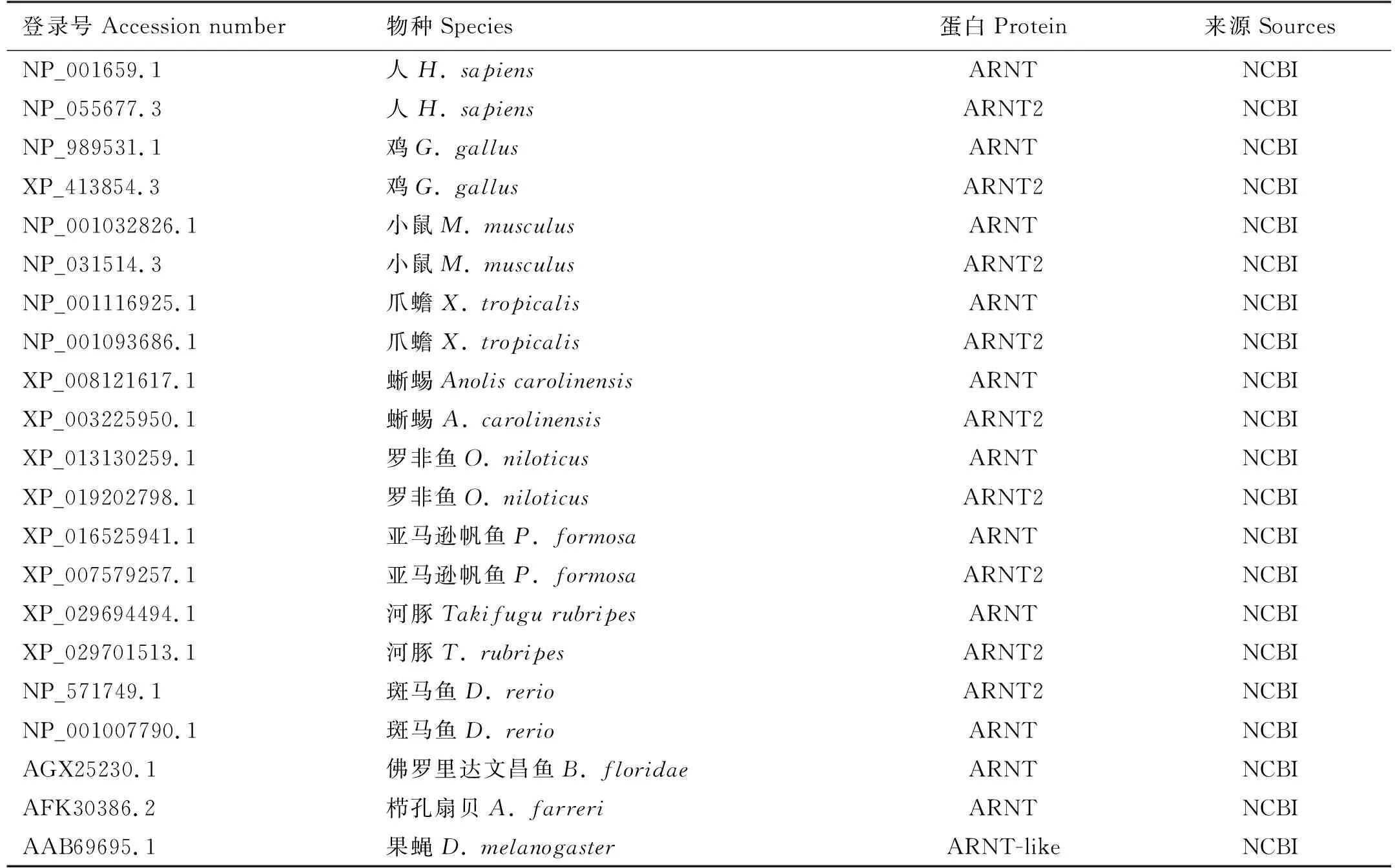
表2 ARNT系统进化树分析所用序列编号Table 2 ARNT sequences used in phylogenetic analysis
1.4 基因表达分析
为检测Bjahr和Bjarnt在文昌鱼不同组织的表达情况,从性成熟的青岛文昌鱼中提取多种组织,包括肠、鳃、肝盲囊、肌肉、脊索、卵巢和精巢。将不同组织样品用TRIZOL研磨固定后,使用上述提到的RNA试剂盒法进行总RNA的提取,用TaKaRa公司PrimeScript RT reagent Kit with gDNA Eraser Real-time专用的反转录试剂盒进行cDNA合成。用Primer5软件设计Bjahr和Bjarnt的qRT-PCR 引物(见表3),以文昌鱼各组织cDNA为模板,文昌鱼β-actin为内参基因,用ABI7500Real-time PCR仪进行qRT-PCR实验。反应程序设定为:(1)1个循环:95 ℃ 15 s;(2)40个循环:95 ℃ 5 s,60 ℃ 15 s,72 ℃ 30 s。使用2-ΔΔCt方法来计算基因相对β-actin的表达量。使用Graphpadprism5软件对实验结果进行作图。

表3 qRT-PCR所用引物序列Table 3 Sequences of primers used in qRT-PCR
1.5 污染物PCB126胁迫实验
将PCB126(3,3’,4,4’,5-五氯联苯,纯度>99%)粉末溶解到DMSO中,溶解后的PCB126溶液加入处理组海水中,使PCB126终浓度为30 nmol/L。对照组海水中加入与处理组等量且浓度低于1%的DMSO。将文昌鱼放入处理组海水和对照组海水中,分别于胁迫后6、12、24、48和72 h,每组各取10条文昌鱼进行肝盲囊组织采集,按照上述方法提取RNA并反转录为cDNA,利用qRT-PCR实验检测Bjahr、Bjarnt、cyp1、cyp3、gst和sult1α的表达情况。实验中用到的引物见表3。
1.6 原核表达载体构建
由于AHR难以纯化获得完整的体外重组蛋白[18],作者对文昌鱼AHR的bHLH、PAS(A)和PAS(B)功能域部分进行了体外表达和纯化。在Bjahr功能域两端设计分别带有HindⅢ和XholⅠ酶切位点的引物,引物序列如下:P1-F: 5’-CCCAAGCTTGGAACCCC AGTAAGCGGCACC-3’; P1-R: 5’-CCGCTCGAGTCTCATCAGG CTGGCATGT-3’,下划线示酶切位点。将PCR产物连接到质粒表达载体pET-28a上,得到重组表达质粒。将质粒转化入Trans5α大肠杆菌感受态细胞中进行培养,取阳性克隆株测序以确认成功构建pET-28a/ahr原核表达载体。为构建Bjarnt原核表达载体,在Bjarnt的ORF两端设计分别带有EcoRⅠ和XholⅠ酶切位点的引物,引物序列如下:P2-F:5’-CCGGAATTCATGTCGTCGGTGACCAC-3’;P2-R:5’-CCGCTCGAGTTTACTCGGAGAAGGTTGT-3’,下划线表示酶切位点。按上述同样方法,成功构建pET-28a/arnt原核表达载体。
1.7 重组蛋白的表达和纯化
将表达载体转化入表达菌Transetta(DE3)中,挑选阳性菌株接种到LB液体培养基(Kan)中,37 ℃振荡培养约6 h后,向菌液中加入终浓度0.5 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG),28 ℃振荡培养8 h(文昌鱼AHR与ARNT均在此条件下诱导表达效果最佳)。将诱导表达的菌液4 ℃,5 000g离心20 min,弃上清,向沉淀加入30 mL裂解液(AHR调至pH=6.8,ARNT调至pH=8),用枪吹打重悬,超声破碎后,取出菌液4 ℃,12 000g离心25 min,分别取上清和包涵体样品,进行SDS-PAGE电泳检测,检测显示AHR和ARNT均在包涵体中表达较多。对包涵体进行洗涤和溶解后,使用镍柱进行纯化,然后用含不同浓度咪唑的溶解液梯度洗脱镍柱。对上样前的蛋白、上样后的蛋白以及不同浓度咪唑洗脱后收集的样品进行SDS-PAGE检测,确定重组蛋白的最适洗脱浓度。选择孔径为3.5 kDa的透析袋进行透析。将透析袋放在1 L含有10 mmol/L NaHCO3,1 mmol/L EDTA的溶液中煮沸30 min,然后向透析袋中注入蛋白溶液,用透析夹夹紧袋口。依次将透析袋放入预冷的透析液(Ⅰ~Ⅵ)中4 ℃透析8 h,磁力搅拌器缓慢搅拌。后于预冷透析液Ⅶ中透析8 h,透析液Ⅶ需要重复透析2次。透析结束后,将透析袋中的液体在4 ℃,12 000g离心20 min,上清即为复性成功的重组蛋白溶液,通过超滤的方法浓缩蛋白,用BCA蛋白浓度测定试剂盒法测定蛋白质浓度。
1.8 ELISA结合实验
将ARNT用PBS稀释至100 μg/mL,取50 μL加到96孔酶标板中,于25 ℃培养箱里过夜后,再放入60 ℃培养箱固定30 min。向酶标板加入1 mg/mL的BSA封闭液200 μL,放入37 ℃培养箱孵育封闭2 h,再用PBST(100 mLPBS+500 μL Tween-20)进行洗板。用PBS将生物素标记的AHR梯度稀释为0、2、4、10、20、40、60、80、100、130、160 和200 μg/mL。取50 μL的各个梯度的AHR加入到含有ARNT的各个孔里(每个样品设置3个平行),室温孵育反应3 h。将生物素标记的BSA设置同样的浓度梯度作为对照组。PBST洗板后,加入100 μL的1∶4 000稀释的带有HRB标记的链霉素室温孵育1 h,PBST再次洗板。加入75 μL显色液(51.4 mmol/L Na2HPO4,24.3 mmol/L的柠檬酸,0.045%H2O2,0.4 mg/mL的邻苯二胺),放入37 ℃培养箱约10~30 min,加入25 μL终止液(2 M H2SO4)终止反应。用酶标仪测定各孔的A492的OD值。为检测PCB126是否能促进AHR和ARNT的结合,用DMSO将PCB126 (3,3’,4,4’,5-五氯联苯,纯度>99%) 粉末稀释至终浓度2.5 μmol/L,重复上述步骤并在AHR和ARNT室温孵育阶段加入1 μL稀释的PCB126,在BSA对照组中也加入同量的PCB126,在溶剂对照组中加入等量的DMSO。
2 结果
2.1 Bjahr基因克隆鉴定和系统进化分析
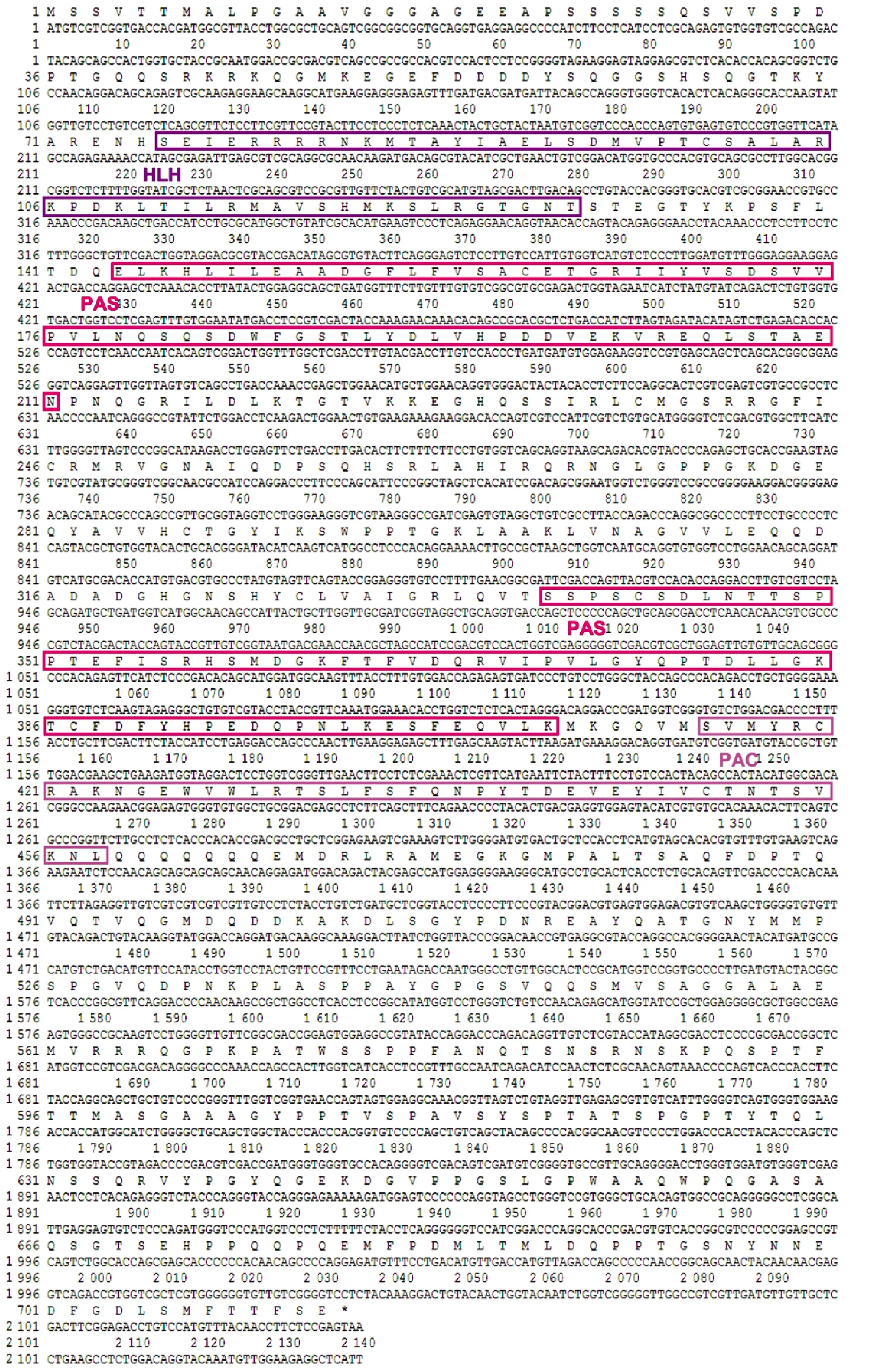
青岛文昌鱼ahr基因的开放阅读框(ORF)长为2 286 bp,编码一个由760个氨基酸组成的蛋白质(见图1), 预测其分子量为85.3 kDa,等电点(pI)为8.38。通过SMART在线软件进行蛋白结构预测显示该蛋白共有四个功能域,无信号肽。第28~83位氨基酸为HLH结构域,110~176位氨基酸为PAS结构域,第264~333位氨基酸为PAS结构域,第339~380位氨基酸为PAC结构域(见图2(a))。因为文昌鱼AHR具有该家族特征功能域PAS和HLH,故属于bHLH-PAS家族。三维结构预测显示青岛文昌鱼AHR蛋白结构与人AHR蛋白结构相似(见图2(b))。这些结果表明所获得的基因正是ahr基因,因此将它命名为Bjahr。

(功能域HLH、PAS和PAC用红色框标注。Domain HLH, PAS and PAC were indicated by red boxes.)图1 文昌鱼Bjahr基因的核酸序列与氨基酸序列Fig.1 The nucleotide and deduced amino acid sequences of Bjahr

图2 BjAHR蛋白的结构域(a)和利用蛋白结构同源建模法预测的BjAHR分子模型,其与人类AHR同源蛋白的三维结构非常相似(b)Fig.2 Domains of BjAHR (a) and molecular model of BjAHR predicted by homology modeling of protein structure,which is closely similar to the 3D structure of human AHR homologues (b)
系统进化分析显示,青岛文昌鱼AHR与佛罗里达和白氏文昌鱼的AHR聚为一支,位于脊椎动物和无脊椎动物之间(见图3)。其他无脊椎动物AHR聚为一支,位于进化树的底部。脊椎动物中,鱼类往往拥有2个AHR,即AHR1和AHR2。进化树显示脊椎动物的AHR和鱼类AHR2聚在一起,其中鱼类AHR2单独聚为一亚支。该进化树很好的反映了AHR在所选物种中的进化关系。
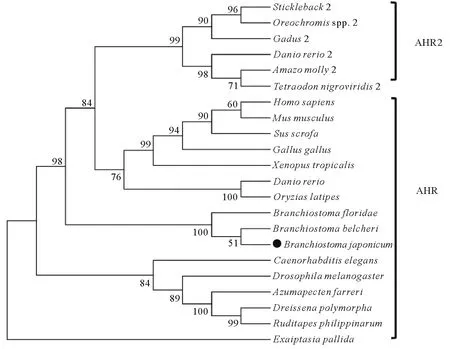
(使用MEGA 6.0软件的邻接(NJ)法进行进化树构建。每个节点的可靠性经过1 000次重复检验,节点处数值表示检验后的bootstrap支持率(%)。建树所用序列的登录号列在表1中。The phylogenetic tree was constructed by MEGA 6.0 using the amino acid-based Neighbor-Joining (NJ) algorithm. The reliability of each node was estimated by bootstrapping with 1 000 replications. The numbers shown at each node indicate the bootstrap values (%). Accession numbers for sequences used are listed in Table 1.)图3 AHR系统进化分析Fig.3 Phylogenetic tree of AHR
2.2 Bjarnt基因克隆鉴定和系统进化分析
青岛文昌鱼arnt基因的开放阅读框(ORF)长为2 142 bp,编码由714个氨基酸组成的蛋白质(见图4),其分子量推断为78.6 kDa,等电点为6.46。结构域预测显示,该蛋白共有四个结构域,无信号肽。第76~129位氨基酸为HLH结构域,第144~211位氨基酸为PAS结构域,第328~398位氨基酸为PAS结构域,第405~448位氨基酸为PAC结构域(见图5(a))。与AHR一样,ARNT也属于bHLH-PAS超家族。蛋白三维结构预测显示,文昌鱼ARNT蛋白结构与人ARNT的结构也十分相似(见图5(b))。这些结果表明所获得的基因正是arnt基因,因此将它命名为Bjarnt。
(功能域HLH、PAS和PAC用红色框标注。Domain HLH, PAS and PAC were indicated by red boxes.)图4 文昌鱼Bjarnt基因的核酸序列与氨基酸序列Fig.4 The nucleotide and deduced amino acid sequences of Bjarnt
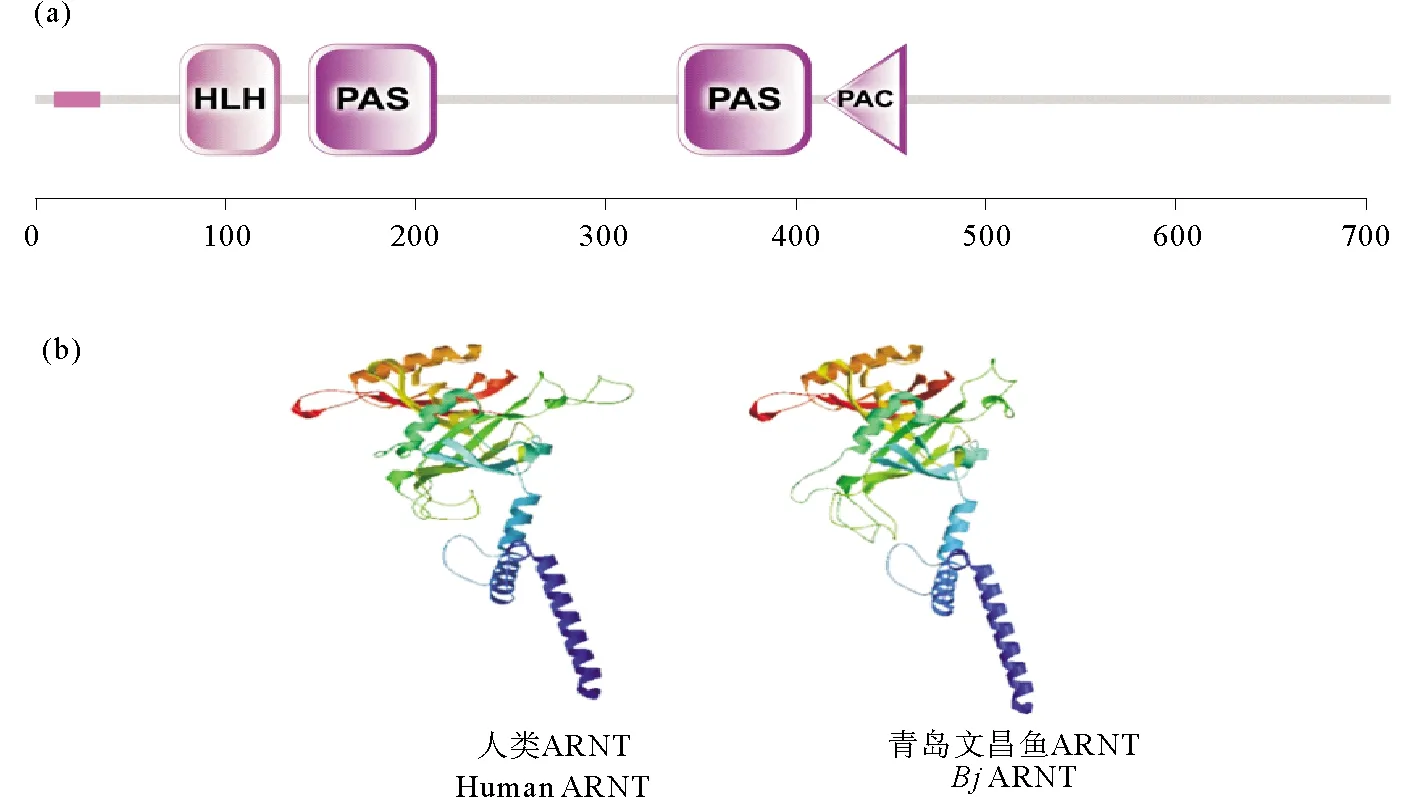
图5 BjARNT蛋白的结构域(a)和利用蛋白结构同源建模法预测的BjARNT分子模型,其与人类ARNT同源蛋白的三维结构非常相似(b)Fig.5 Domains of BjARNT (a) and molecular model of BjARNT predicted by homology modeling of protein structure,which is closely similar to the 3D structure of human ARNT homologues (b)
系统进化分析显示,青岛文昌鱼ARNT与佛罗里达文昌鱼ARNT单独聚为一支,并且与无脊椎动物ARNT聚在一起,位于进化树的底部,表明文昌鱼ARNT较为原始(见图6)。脊椎动物通常拥有两个ARNT,即ARNT1和ARNT2。进化树显示脊椎动物的ARNT1和ARNT2聚在一起,其中ARNT2单独聚为一亚支。该进化树很好的反映了ARNT在所选物种中的进化关系。

(使用MEGA 6.0软件的邻接(NJ)法进行进化树构建。每个节点的可靠性经过1 000次重复检验,节点处数值表示检验后的bootstrap支持率(%)。建树所用序列的登录号列在表2中。The phylogenetic tree was constructed by MEGA 6.0 using the amino acid-based neighberjoinning (NJ) algorithm. The reliability of each node was estimated by bootstrapping with 1 000 replications. The numbers shown at each node indicate the bootstrap values (%). Accession numbers of sequences used are listed in Table 2.)图6 ARNT系统进化分析Fig.6 Phylogenetic tree of ARNT
2.3 组织特异表达分析
利用qRT-PCR分别检测了Bjahr和Bjarnt在青岛文昌鱼不同组织中的表达模式(见图7)。Bjahr在所选取的7种组织中均有表达,在卵巢中的表达量最多,在脊索、精巢、肝盲囊和肌肉中的表达量依次减少,在后肠和鳃中的表达量较低。与Bjahr类似,Bjarnt在七种组织中也均有表达。Bjarnt在脊索和精巢中的表达量较高,在卵巢、鳃、肌肉和后肠中的表达量依次减少,在肝盲囊中的表达量最低。
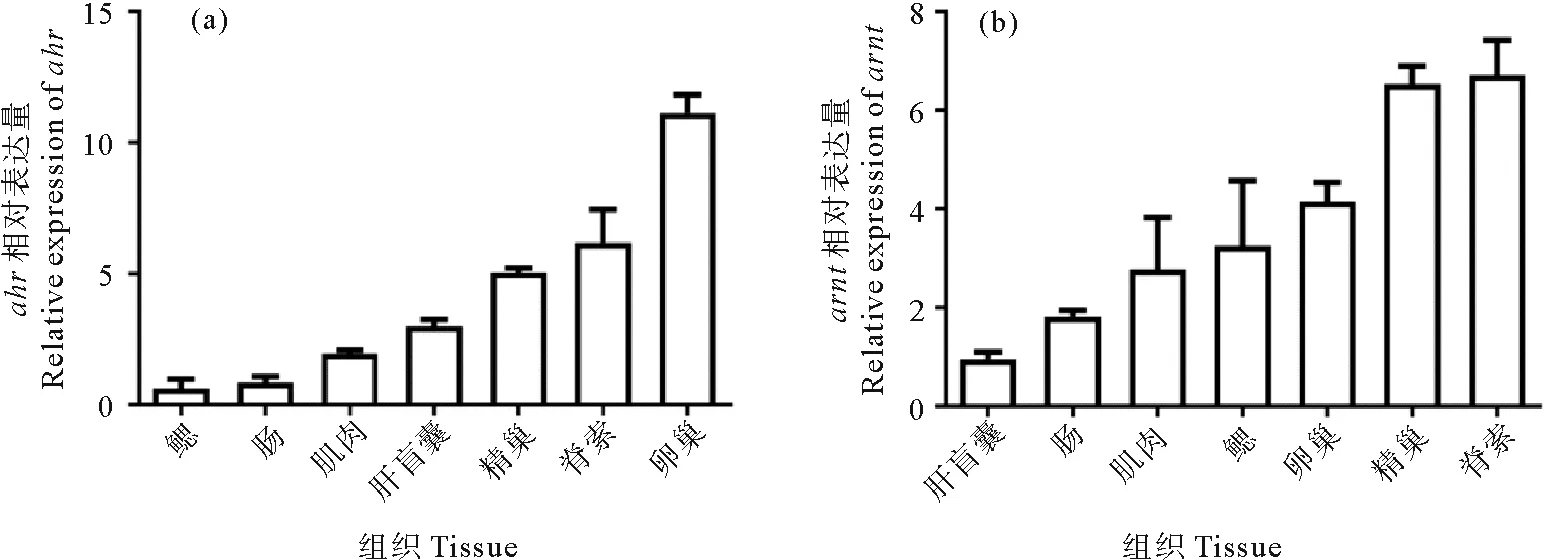
(鳃:Gill;肠:Hind-gut;肌肉:Muscle;肝盲囊:Hepatic caecum;精巢:Testis;卵巢:Ovary, 脊索:Notochord。 从青岛文昌鱼肌肉、鳃、后肠、肝盲囊、卵巢、精巢和脊索不同组织中分别提取总RNA,采用qRT-PCR法检测Bjahr (a)和Bjarnt (b)在不同组织中的表达量。 β-actin基因为内参基因。Total RNAs were extracted from various tissues of B. japonicum, including the, and the relative expression of Bjahr (a) and Bjarnt (b) were determined in the different tissues by qRT-PCR. The β-actin gene was chosen as internal control for normalization.)图7 Bjahr 和 Bjarnt 在7种组织的表达模式Fig.7 Expression profile of Bjahr and Bjarnt in 7 tissues of amphioxus
2.4 污染物PCB126胁迫后的表达分析
为了解环境污染物是否影响文昌鱼ahr、arnt以及其他化学防御相关基因在肝盲囊中的表达,利用qRT-PCR检测了PCB126 (3,3’,4,4’,5-五氯联苯)胁迫后不同时间点Bjahr、Bjarnt以及生物转化酶基因cyp1、cyp3、谷胱甘肽硫转移酶(GSTs)基因和硫酸基转移酶(SULT)基因的表达变化。Bjahr和Bjarnt在PCB126处理6和72 h后,表达量显著升高,且这2个基因随着处理时间的延长,表达变化趋势基本一致,均呈现先升高后降低再升高的模式(见图8)。文昌鱼cyp1在处理后24 h表达显著上升,而cyp3则在处理后72 h表达显著上升,表明这2种cyp基因具有不同的表达模式。另外,gst在处理后12 和24 h表达量显著升高,sult1a在处理后6、12和24 h表达量持续显著升高。结果表明这些基因可能都参与解毒过程。
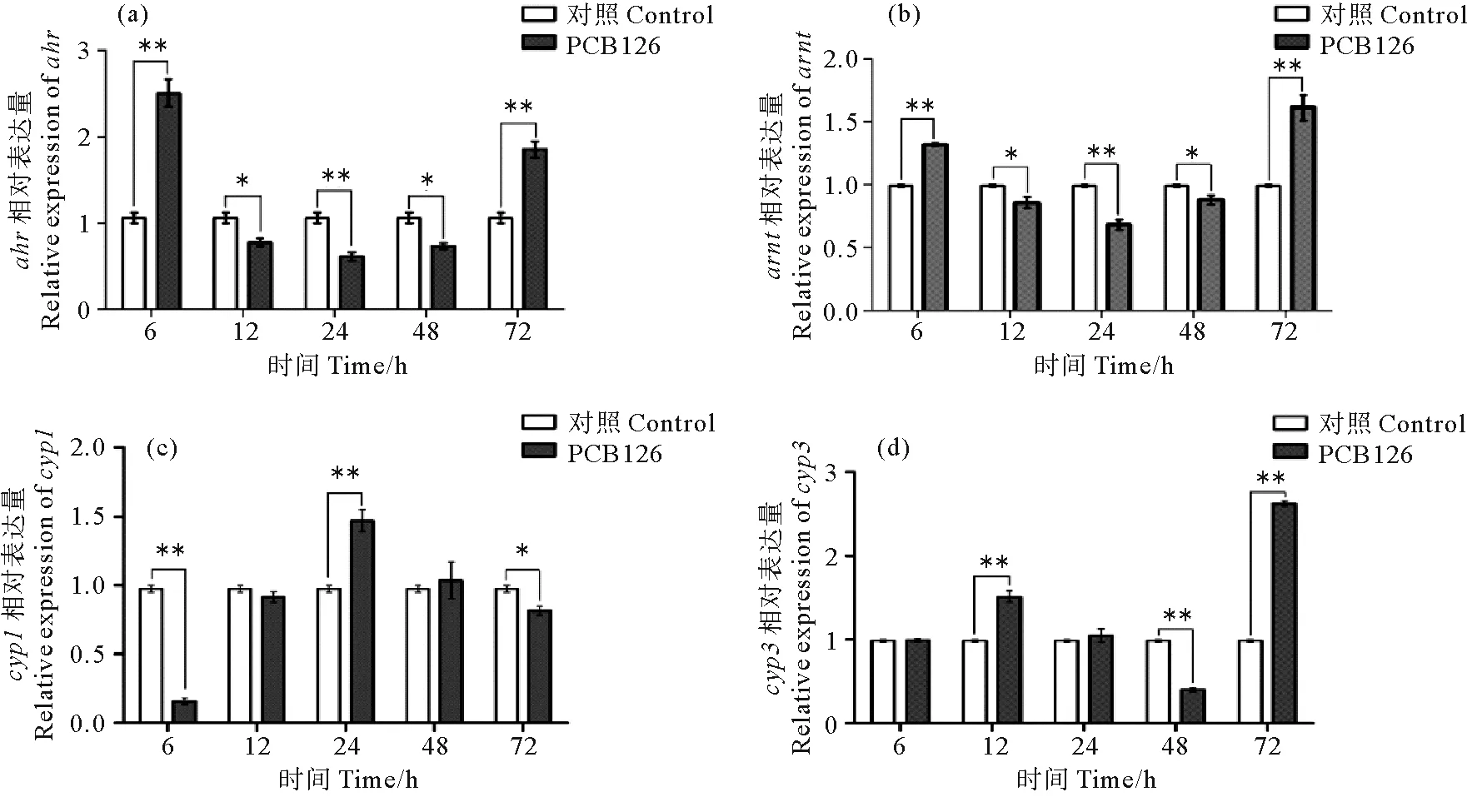
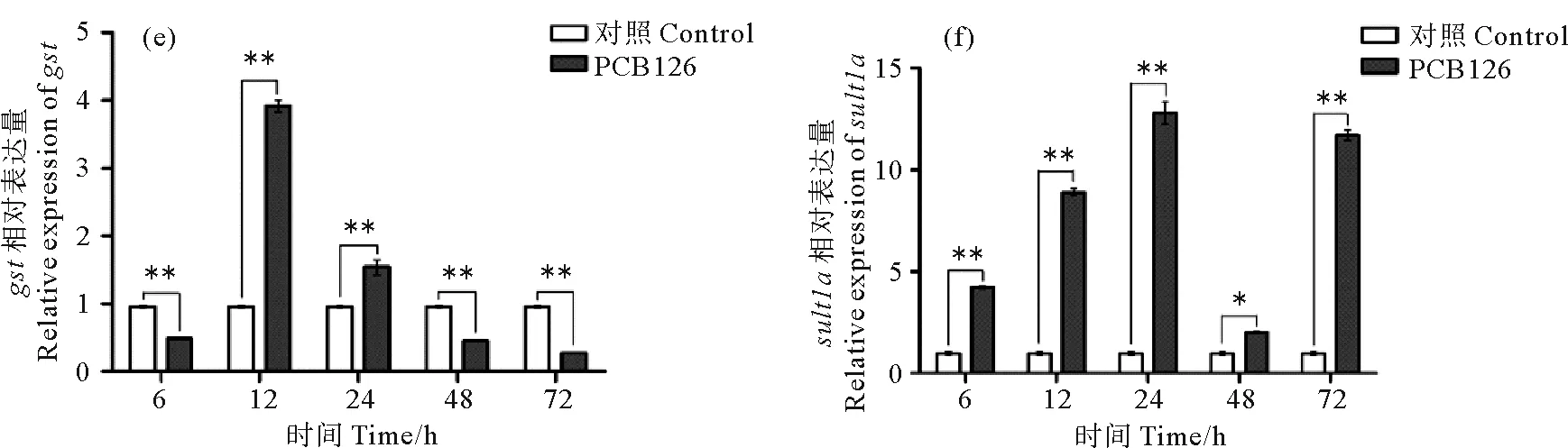
(处理6、12、24、48、72 h后,利用qRT-PCR分别检测ahr (a)、arnt (b)、cyp1 (c)、cyp3 (d)、gst (e)和sult1a (f)的表达。β-actin为内参基因。符号*表示显著差异(P < 0.05),符号**表示差异极显著(P < 0.01)。The expression of ahr (a), arnt (b), cyp1 (c), cyp3 (d), gst (e), sult1a (f) were detected by qRT-PCR after exposing 6, 12, 24, 48 and 72 h. The β-actin gene was used as internal control for normalization. The symbol * indicated a significant difference (P <0.05), and the symbol ** indicated an extremely significant difference (P < 0.01).)图8 浓度30 nmol/L的PCB126处理青岛文昌鱼后肝盲囊中Bjahr、Bjarn和化学防御基因的表达模式Fig.8 Expression profiles of Bjahr, Bjarnt and chemical defense related genes in hepatic caecum of B. japonicum exposed to PCB126 at doses of 30 nmol/L
2.5 重组蛋白AHR和ARNT的结合作用分析
为了解文昌鱼AHR与ARNT能否相互相作用形成异二聚体,利用文昌鱼体外重组蛋白AHR和ARNT开展ELISA结合实验。由于AHR难以在体外获得完整的纯化蛋白,参考Tsuji等[18]方法,纯化得到包含AHR的HLH和2个PAS结构域的蛋白。生物素标记的AHR功能域蛋白能够与ARNT结合,而作为对照组的BSA则显示出与ARNT很弱的亲和性(见图9(a))。脊椎动物中,AHR配体PCB126的存在能够促进AHR与ARNT形成异二聚体[11-14]。为了解文昌鱼AHR与ARNT是否有类似的特性,将溶解于DMSO的PCB126与AHR和ARNT蛋白共同孵育。为排除溶剂DMSO的影响,溶剂对照组添加等量的DMSO与AHR和ARNT进行孵育。结果显示,PCB126能够促进文昌鱼AHR和ARNT的结合。而作为对照组的BSA,在PCB126的存在下,仍显示出与ARNT很弱的亲和性(见图9(b))。
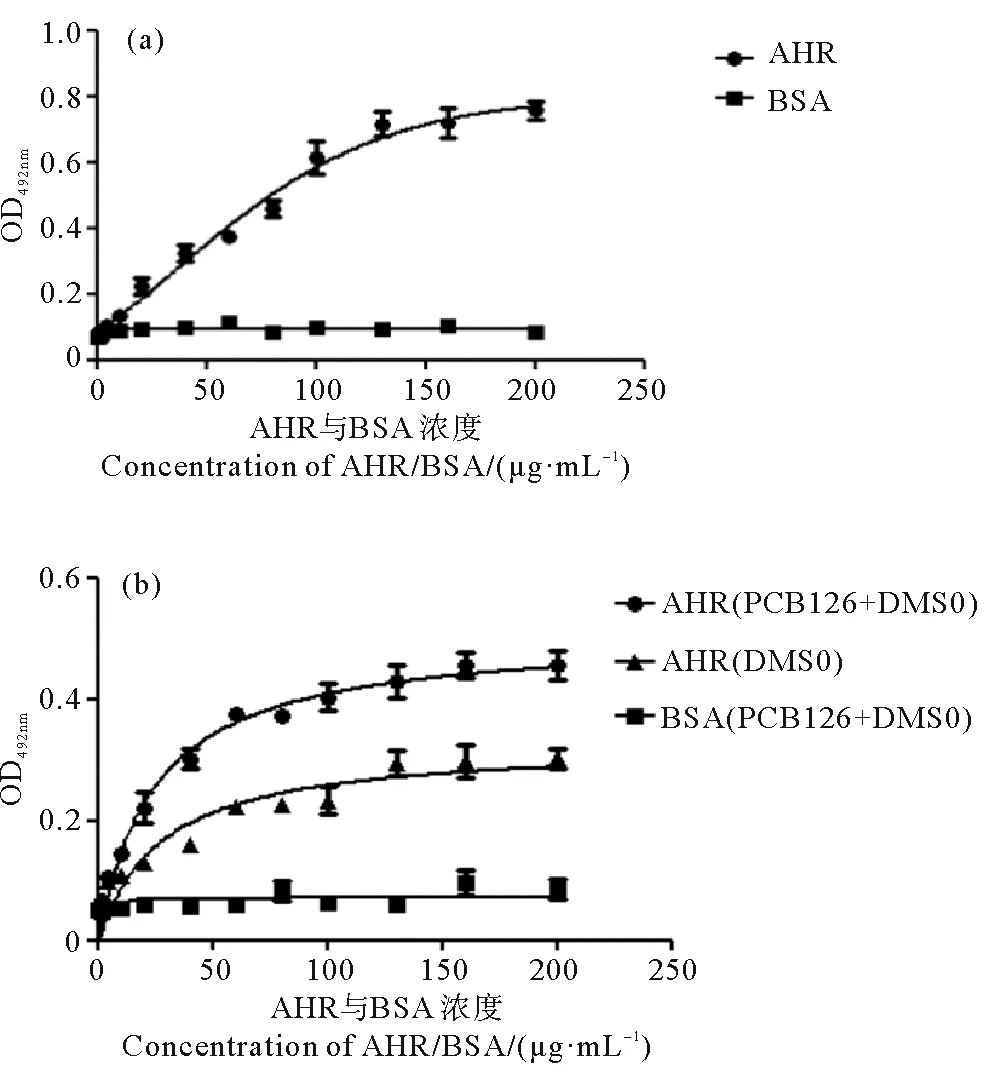
((a) BjAHR与BjARNT的结合分析。(b) PCB126及其溶剂DMSO存在时,BjAHR与BjARNT的结合分析。牛血清蛋白BSA为对照。(a) Binding of BjAHR to BjARNT. (b) Binding of BjAHR to BjARNT when PCB126 and resolvent DMSO exist. BSA was used as control.)图9 BjAHR与BjARNT亲和力的ELISA分析Fig.9 ELISA analysis of the affinity of BjAHR to BjARNT
3 讨论
化学防御系统是生物抵御环境中异生物质如多环芳烃、微生物产物、重金属、植物毒素等的重要机制[1-2]。芳香烃受体 (AHR) 和芳香烃受体核转运蛋白(ARNT)同属于bHLH-PAS转录因子超家族,在化学防御系统中作为化学感受器发挥作用[3-6]。脊椎动物AHR 作为重要的异生物质受体蛋白,能够被环境中的有毒物质如PCBs、TCDD、PAHs 激活,并与细胞核中的ARNT形成异二聚物,进一步调控CYP等生物转化酶以及转运蛋白的表达[11-14]。然而,对无脊椎动物化学防御系统的研究中,目前还没有直接证据证实无脊椎动物中存在同脊椎动物一样的AHR-CYP信号途径[5,15-17]。文昌鱼作为研究脊椎动物起源的模式动物,其化学防御系统的作用机理至今仍不清楚。研究文昌鱼AHR和ARNT在化学防御系统中的作用,对于了解脊椎动物AHR-CYP信号通路以及AHR蛋白作为异生物质受体并参与化学防御的功能在系统演化中何时出现,具有重要意义。
本研究从青岛文昌鱼克隆得到了Bjahr与Bjarnt基因的ORF序列。功能域分析表明,这两个蛋白都包含bHLH-PAS家族的特征功能域bHLH, PAS-A和PAS-B。蛋白三级结构预测显示,青岛文昌鱼AHR和ARNT蛋白结构分别与人的同源蛋白结构相似。这些结果均表明,本研究中克隆获得了正确的目的序列。系统进化树分析显示,文昌鱼AHR位于脊椎动物和无脊椎动物之间;而文昌鱼ARNT则与无脊椎动物的ARNT类聚在一起并位于进化树基部,这些结果说明文昌鱼AHR和ARNT可能代表了较为原始的类型。
为了解Bjahr与Bjarnt的功能,首先分析了这2个基因的组织表达模式。Bjahr在鳃、肝盲囊、肠、肌肉、脊索、精巢和卵巢这7种组织中都有表达,且在卵巢、精巢和脊索中表达量较高。哺乳动物AHR存在于多种组织和器官中,除了参与应答芳香烃类化合物,还参与多种生物信号转导途径,如细胞的生长和分化、神经系统的发育,以内分泌系统等[11,19-20]。AHR和ARNT在多种动物的精巢和卵巢中均有表达且参与调节生殖器官的生理功能[21-24]。AHR蛋白和转录本在包括灵长类、鼠、兔和猪等多类物种的卵巢细胞中表达,并且参与卵巢行使正常功能、建立最佳受精环境、滋养胚胎、维持妊娠、调节生殖周期和生育等生理功能[21-22]。此外,AHR和ARNT在鼠的精巢和人的精巢中均有存在,AHR在精子发育中起重要作用。与野生型精子相比,小鼠的Ahr敲除后,其精子的体外受精率显著降低,且这些精子的头部和尾部存在形态异常[23-24]。另外,脊椎动物AHR是包括神经系统和血管系统在内的多种器官正常发育所必需的[25-26]。佛罗里达文昌鱼2天龄幼体期,可观察到Bfahr在嘴部周围的细胞以及喙的表皮细胞中特异表达,而这些特异表达Bfahr的细胞可能参与化学感应作用[27]。青岛文昌鱼Bjahr在成鱼的卵巢、精巢和脊索中高表达原因,以及其参与的生理功能仍需要今后进一步的研究。
与Bjahr的组织表达模式类似,Bjarnt在上述7种组织中也都有表达,且在脊索、精巢和卵巢中表达量较高。研究表明,ARNT在生物体内广泛表达,其主要功能是作为二聚化配体,与bHLH-PAS家族成员如AHR、HIF和SIM等蛋白形成异二聚体,进而激活或抑制下游基因表达[28-29]。因此,ARNT的功能发挥依赖于它的二聚化配体。而ARNT的二聚化配体的存在与否则依赖于各种因素,例如发育空间因素(果蝇的sim,trh,dys),配体诱导因素(脊椎动物AHR),低氧因素(HIF蛋白家族)。研究发现,佛罗里达文昌鱼发育至神经胚时期,可检测到Bjarnt在胚胎背部的表达信号强烈,并且表达信号集中在靠近第一个体节的前端中枢神经体统(CNS),表明佛罗里达文昌鱼bfarnt可能参与神经系统发育[27]。青岛文昌鱼Bjarnt在成鱼的广泛表达,可能与其他物种ARNT一样,作为二聚化配体存在于各个组织中。然而Bjarnt在成鱼的卵巢、精巢和脊索中高表达原因,且与Bjahr类似的组织表达模式是否因为两者之间存在紧密的功能联系,都需要今后进一步的研究。
脊椎动物中,已证实AHR-CYP信号通路在化学防御系统中发挥重要作用。然而无脊椎动物中是否存在同脊椎动物一样的AHR-CYP途径仍不清楚[5,15-17]。Hahn认为脊椎动物AHR经历了基因复制和功能多样化,使其获得能够与二噁英类异生物质结合的适应性能力[5]。而无脊椎动物AHR功能较为原始,主要在发育过程中发挥作用,缺少与二噁英类物质结合的能力[5]。然而,最新研究显示,经环境污染物苯并(a)芘(BaP)、PCB126和TBT处理后,剑水蚤Tj-AhR和Tj-ARNT表现出时间依赖和剂量依赖的上调表达[16]。另外,在雌性栉孔扇贝(C.farreri)中,低剂量苯并(a)芘能够激活AHR、ARNT、CYP1A1以及雌激素受体的基因表达[17]。这些实验结果则暗示剑水蚤和栉孔扇贝中可能存在潜在的AHR-CYP信号通路。由此可见,无脊椎动物是否存在AHR-CYP通路仍然是一个具有争议的论题。为初步探索文昌鱼中是否存在类似脊椎动物的AHR-CYP通路,用环境污染物类二噁英多氯联苯PCB126处理青岛文昌鱼,并用qRT-PCR检测Bjahr、Bjarnt、cyp1、cyp3、gst和sult1a胁迫后的表达模式。结果显示,基因Bjahr和Bjarnt在PCB126处理6 h后,表达显著升高,且这两个基因的表达模式类似。cyp1在处理后12 h后表达显著升高。基因Bjahr、Bjarnt和cyp1在处理后均表达上调,暗示这些基因可能都参与化学防御过程,文昌鱼中可能存在AHR-CYP信号通路。另外,生物转化酶基因cyp3、gst、sult1a在胁迫后表达量也都显著升高,暗示这些基因也都参与了文昌鱼化学防御过程。
脊椎动物AHR被PCB126、二噁英等配体激活后,分子伴侣离解并导致AHR从细胞质转移到细胞核中,并与ARNT形成异二聚体,进而激活CYP1 家族基因以及其他生物转化酶基因的表达[11-14]。为了进一步了解青岛文昌鱼AHR和ARNT蛋白能否形成异二聚体,开展了ELISA结合实验。由于AHR蛋白难于纯化获得体外重组蛋白[18],作者只表达和纯化了AHR蛋白的bHLH和2个PAS功能域部分。结果显示,青岛文昌鱼AHR功能域蛋白能够与ARNT结合,并且脊椎动物AHR配体PCB126能够促进这2个蛋白的结合。该实验结果暗示,文昌鱼AHR可能具有同脊椎动物AHR相似的功能,即能被二噁英类配体激活并与ARNT形成异二聚体。该发现不同于在尾索动物异体柱囊虫(Oikopleuradioica)的化学防御系统研究结果。多环芳烃苯并芘(BaP)和药类化合物降固醇酸(Clo)处理异体柱囊虫后,未发现AHR和CYP1家族相关基因的表达。对异体柱囊虫基因组进行搜寻,发现其缺失AHR通路的相关基因,如AHR和CYP1 家族的基因,表明异体柱囊虫中不存在AHR-CYP通路[30]。另外,尽管海葵中存在AHR和ARNT同源蛋白,但是海葵的AHR和ARNT不能相互作用形成异二聚体[31]。本研究表明头索动物文昌鱼AHR和ARNT不仅具有结合能力,并且脊椎动物AHR的配体PCB126能够促进这两个蛋白的结合,因此推测文昌鱼中可能存在类似脊椎动物AHR-CYP信号通路。
本研究从青岛文昌鱼克隆获得ahr基因与arnt基因的ORF序列,分别命名为Bjahr和Bjarnt。这两个基因都属于bHLH-PAS家族且代表较为原始的类型。组织表达分析显示,Bjahr和Bjarnt在鳃、肝盲囊、肠、肌肉、脊索、精巢和卵巢这7种组织中都有表达,尤其在卵巢、精巢和脊索中表达量较高,相似的表达模式可能由于2个基因之间存在紧密的功能相关性,具体原因还需要今后进一步的研究。类二噁英PCB126处理后,Bjahr、Bjarnt以及生物转化酶基因cyp1、cyp3、gst和sult1a表达均有显著升高,因而推测这些基因参与文昌鱼的化学防御过程。此外,作者还纯化获得文昌鱼体外重组AHR功能域蛋白和ARNT蛋白。ELISA结果表明文昌鱼AHR能够与ARNT结合,并且脊椎动物AHR的配体PCB126能够促进这2个蛋白的结合。根据这些实验结果推测,文昌鱼中可能存在类似脊椎动物的AHR-CYP信号通路。在今后的研究中,作者所在研究团队还将进一步明确文昌鱼AHR能否直接与二噁英等配体结合,以及文昌鱼AHR和ARNT的二聚物能否调控其下游基因,以丰富对文昌鱼AHR-CYP通路机制和进化地位的认识。

