莓茶决明子固体饮料对大鼠慢性酒精肝损伤的保护作用
湛 莉 汤荃荃 张梓莹 石 昱 滕建造 刘子龙 刘仲华 张 盛
(1. 湖南农业大学园艺学院,湖南 长沙 410128;2. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;3. 湖南艾嘉生物科技有限公司,湖南 长沙 410301)
酒精性肝损伤(ALD)是因长期过量饮酒导致的肝脏疾病,通常表现为酒精性脂肪肝、酒精性肝炎,并逐步演变成肝纤维化、肝硬化,甚至是肝癌等[1]。常用于治疗酒精性肝损伤的方法是药物治疗和手术治疗[2],但两者存在较大副作用[3]。
莓茶又名藤茶,学名为显齿蛇葡萄(Ampelopsisgrossedentata)[4],具有显著的抗炎、抗氧化[5]、抗菌[6]、保肝[7-8]等功效。莓茶中的二氢杨梅素可改善肝纤维化[9],总黄酮可有效缩短小鼠醒酒时间[10]。其他活性成分如莓茶多糖对小鼠体内肝组织 MDA的生成也具有显著抑制作用。
决明子(Cassiasemen)是中国传统药食两用资源[11-12]。研究[13]发现,决明子蒽醌等成分可以通过调节Nrf2介导的ERK/MAPK/JNK等信号通路起到肝脏保护作用。
研究拟建立酒精性肝损伤SD大鼠模型,用不同剂量莓茶决明子固体饮料灌胃模型大鼠,通过细胞毒性试验确定莓茶提取物和决明子提取物颗粒配比,分析模型大鼠肝脏指数、病理学指标、血清和肝脏生化指标,进行转录组分析探究莓茶决明子固体饮料对大鼠酒精肝损伤的保护作用,以期实现植物固体饮料在功能食品领域的深度开发。
1 材料与方法
1.1 主要材料与仪器
莓茶提取物、决明子提取物:湖南艾嘉生物科技有限公司;
大鼠正常肝细胞BRL3A:武汉普诺赛生命科技有限公司;
雄性SD大鼠:SPF级,体重180~220 g,湖南斯莱克景达实验动物有限公司;
MEM培养基:上海中乔新舟生物科技有限公司;
FBS(胎牛血清):赛业生物科技有限公司;
双抗(青霉素、链霉素)、EDTA-胰蛋白酶消化液:北京酷来搏科技有限公司;
RNA裂解液、逆转录试剂盒、荧光定量PCR试剂盒:美国Vazyme有限公司;
细胞计数试剂(CCK8):北京索莱宝科技有限公司;
ELISA检测试剂盒:长沙奥基生物科技有限公司;
D-hanks平衡盐溶液:实验室配制;
43%vol牛栏山陈酿:市售;
CO2培养箱:BPN-80CW(UV)型,上海一恒科学仪器有限公司;
恒温水浴锅:BWS-27型,上海一恒科学仪器有限公司;
超净工作台:Protect-1FD型,赛默飞世尔科技公司;
冷冻离心机:Hettich MIKRO-22R型,德国Hettich公司;
倒置显微镜:DMIL型,德国Leica有限公司;
多功能酶标仪:MK3型,赛默飞世尔科技公司。
1.2 细胞毒性试验
1.2.1 细胞毒性试验
(1) 细胞培养基:10%FBS(胎牛血清)+MEM培养基+1%P/S(双抗)。
(2) 母液制备:将莓茶提取物和决明子提取物分别溶解于蒸馏水中,37 ℃水浴超声至完全溶解,过0.45 μm细菌过滤膜,配制成20 mg/mL的莓茶提取物母液和决明子提取物母液,4 ℃下保存备用。无水乙醇过0.22 μm细菌过滤膜后保存备用。
(3) 细胞传代:当细胞增殖密度为80%~90%时将培养皿中的培养基倒出,用D-hanks清洗2~3次,根据培养皿大小加入0.5~1.0 mL EDTA消化液,放入CO2培养箱静置1 min。取出培养皿并向其中加入1~2 mL培养基混匀终止消化,用移液枪将贴壁细胞轻轻吹打下来,移入15 mL离心管中,1 000 r/min离心5 min;弃上清,加入1~2 mL培养基与收集的细胞轻轻吹打均匀,分别接种在2~3个培养瓶或培养皿中增殖培养。
(4) 毒性试验:取培养皿贴壁细胞消化离心,弃上清,收集细胞加入1 mL培养基吹打均匀,吸取10 μL进行细胞计数板计数,如细胞密度过大稀释10~20倍再计数。计算得到1 mL培养基中细胞数量后按需稀释细胞,接种于96孔板培养24 h使细胞贴壁。24 h后移除96孔板上清。分别取莓茶提取物和决明子提取物母液700 μL,配制成质量浓度为10 000.00,5 000.00,2 500.00,1 250.00,625.00,312.50,156.25,78.13,39.06 μg/mL溶液,分别加入同体积培养基混匀。空白组仅含培养基。乙醇以培养基稀释,初始体积分数为20%,稀释至0.078%,方法同上。
溶液配制完成后加入96孔板中进行干预,各质量浓度6个平行,每孔加入100 μL溶液继续培养24 h。24 h后移除上清,加入90 μL培养基和10 μL CCK-8试剂,培养箱静置1.5~2.0 h后,检测450 nm处吸光度,计算细胞存活率。酒精干预是48 h后进行吸光度检测并计算细胞存活率。最终得出莓茶提取物和决明子提取物安全质量浓度范围及适宜酒精损伤的体积分数范围。确定莓茶提取物和决明子提取物安全质量浓度范围后设置莓茶决明子固体饮料颗粒配比,并进行细胞毒性试验计算细胞存活率,确定安全质量浓度范围并分析固体饮料对大鼠酒精肝细胞模型细胞存活率的影响。
分别按式(1)、式(2)计算试验组和空白组细胞存活率。
(1)
(2)
式中:
RA——试验组细胞存活率,%;
RB——空白组细胞存活率,%;
A——试验组细胞在450 nm处的光密度值;
B——空白组细胞在450 nm处的光密度值;

n——试验平行个数。
1.2.2 细胞RNA提取及QPCR试验 按照RNA提取试剂盒、逆转录试剂盒、荧光定量PCR试剂盒(引物序列见表1)步骤检测不同体积分数酒精损伤细胞后的Nrf2、HO-1的表达量,确定适合损伤的酒精体积分数。根据确定的酒精体积分数检测莓茶决明子固体饮料颗粒配比对BRL3A细胞存活率的影响。
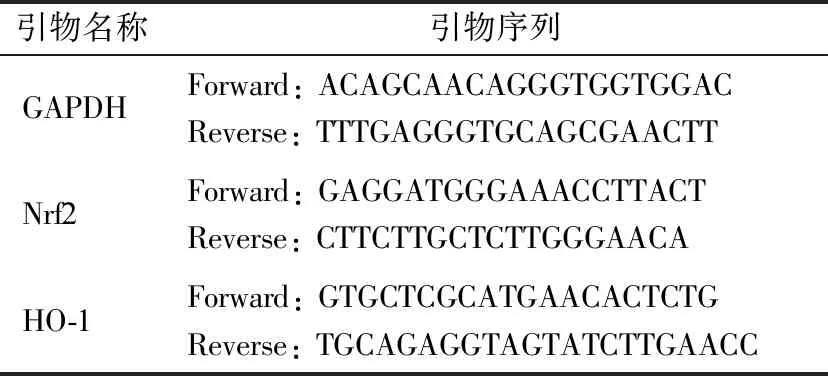
表1 引物序列Table 1 Primer sequence
1.3 试验方法
1.3.1 动物试验 饲养环境保持12 h光照和黑暗交替,室温控制在(25±2) ℃,相对湿度40%~60%。40只SD大鼠随机分成空白组(CON)、模型组(ETOH)、固体饮料组。固体饮料组分低剂量组(L)、中剂量组(M)、高剂量组(H),每组各8只,自由进食进水,适应性喂养1周,第2周开始灌胃,每周2次体重称量;空白组灌胃7.5 mL/kg蒸馏水;模型组灌胃5 mL/kg蒸馏水,固体饮料组灌胃5 mL/kg固体饮料水溶液(L:50.00 mg/kg莓茶提取物+16.70 mg/kg决明子提取物;M:250.00 mg/kg莓茶提取物+83.50 mg/kg 决明子提取物;H:375.00 mg/kg莓茶提取物+125.25 mg/kg决明子提取物),灌胃1 h后,模型组和固体饮料组大鼠第1~29 d灌胃43%vol白酒2.5 mL/kg,第30天灌胃43%vol白酒4 mL/kg。
1.3.2 样品的采集与处理 末次灌胃后,各组大鼠空腹(禁食禁水)16 h后称重,将大鼠麻醉后进行解剖,采集心脏动脉血,摘取肝脏,预冷生理盐水润洗后称重,取一叶肝脏用4%多聚甲醛固定液固定,制作肝组织切片,后期进行组织病理学观察,其余肝脏分装后于液氮速冻,-80 ℃ 冰箱保存。
1.3.3 理化指标检测
(1) 肝脏病理学检查:剪取肝脏一叶组织浸入4%多聚甲醛中固定,制作石蜡切片,苏木精—伊红(HE)染色,并于光学显微镜下观察肝细胞的形态变化、炎症反应、脂肪空泡等病理变化。
(2) 血清生化指标:取心脏动脉血,静置2 h,3 000 r/min 离心15 min,取上层血清,按照ELISA试剂盒方法检测ALT、AST、LDH活性和IL-6、TNF-α浓度,其余血清保存于-80 ℃冰箱。
(3) 肝脏生化指标:用预冷生理盐水冲洗肝脏组织并制备10%肝脏组织匀浆,于4 ℃、3 000 r/min下离心10 min,取上清液,按照ELISA试剂盒说明书方法检测SOD活性和TG、MDA、GSH含量。
1.3.4 转录组测序 每组大鼠肝脏随机取3份用于转录组测序和差异基因表达分析。RNA提取和转录组测序由上海美吉生物医药科技有限公司完成。测序得到的原始数据过滤筛选后得到高质量数据(clean data),将各样品的Clean Reads与指定参考基因组进行序列比对,采用TPM方法计算基因表达量,DEseq2软件筛选差异表达基因,筛选阈值为|log2(Fold change)|≥1和P值<0.05。筛选出上调和下调的差异基因并进行GO功能注释分析和KEGG富集分析从而筛选出差异基因富集通路[14]。
1.4 数据处理
所有试验均设置至少3组生物学重复,数据表示为平均值±标准差,使用GraphPad Prism 8进行数据分析。两两比较用Dunnett-t检验,多组数据比较采用One-way ANOVA进行分析。图中*表示与正常组相比,#表示与模型组相比,*/#表示P<0.05;**/##表示P<0.01;***/###表示P<0.001;****/####表示P<0.000 1。P<0.05认为差异显著,具有统计学意义。
2 结果与分析
2.1 细胞毒性试验
莓茶提取物对细胞BRL3A的安全质量浓度范围为0.00~156.25 μg/mL[图1(a)],决明子提取物对细胞BRL3A的安全质量浓度范围为0.00~39.06 μg/mL[图1(b)]。莓茶提取物安全质量浓度最大值是决明子提取物的3~4倍,因此固体饮料的比例定为ρ莓茶提取物∶ρ决明子提取物=3∶1,在安全质量浓度范围内进行细胞毒性试验,测定固体饮料的安全配比(ρ决明子提取物∶ρ莓茶提取物)范围为0~30∶90[图1(c)]。当细胞存活率为50%左右时的酒精浓度适宜损伤,因此适宜损伤细胞的酒精体积分数为2.5%~5.0%[图1(d)]。
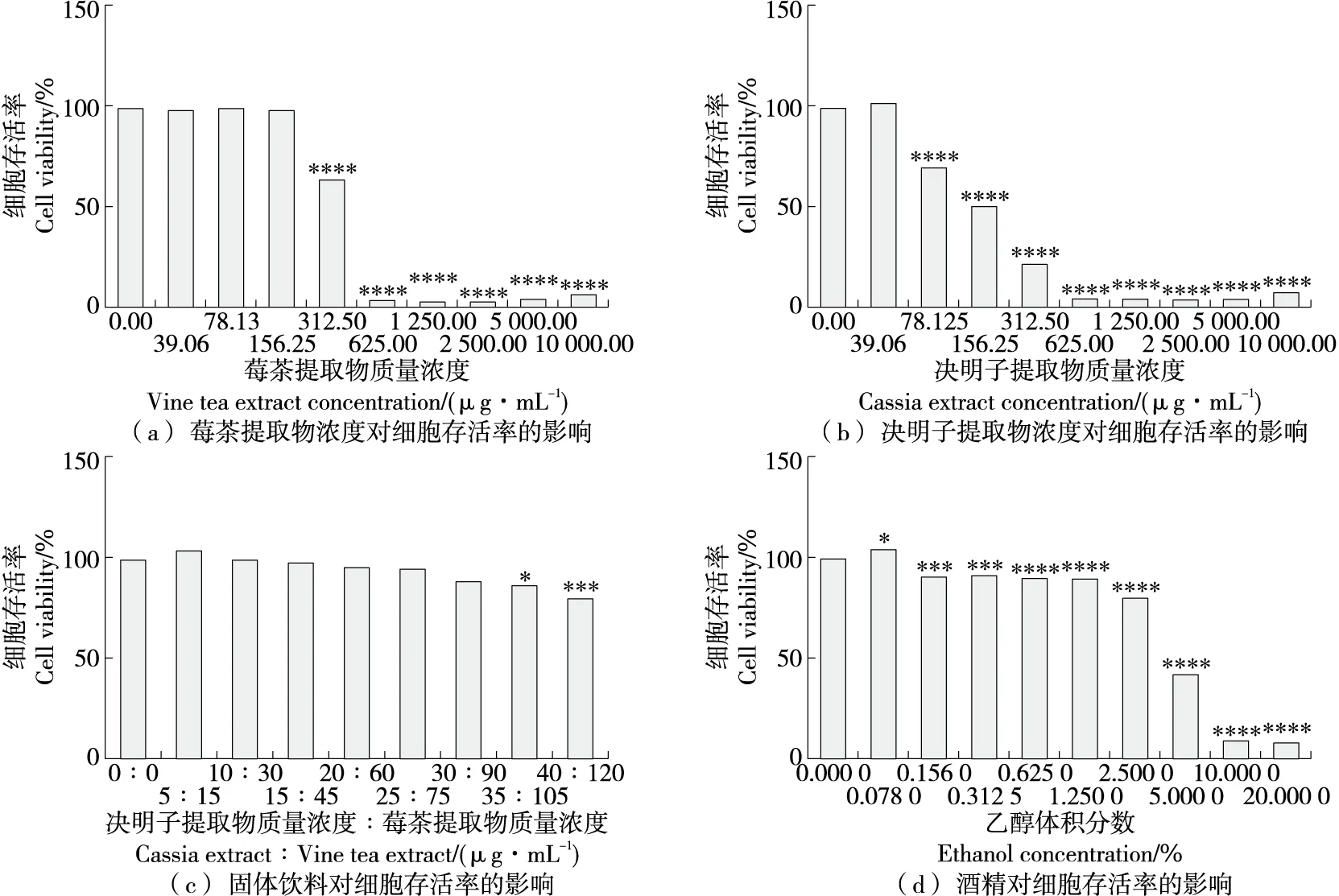
图1 细胞毒性试验结果Figure 1 Cytotoxicity test results
2.2 酒精性肝损伤动物模型的确立
Nrf2是一种重要的细胞保护转录因子,适度增强Nrf2活性可有效抑制细胞氧化应激,提高细胞存活率[15]。Nrf2活性过高会造成细胞氧化损伤,促进肿瘤细胞增殖、增强肿瘤细胞耐药性[16]。HO-1是一种抗氧化酶,正常生理状态下,HO-1表达量较低,当机体发生炎症、感染时,HO-1表达量上升,对机体产生损伤[17]。为探究适宜损伤浓度的酒精处理BRL3A细胞48 h后Nrf2和HO-1的表达量及固体饮料配方对BRL3A细胞存活率的影响,进行了QPCR试验,体积分数为4.5%、5.0% 的酒精处理细胞后RNA浓度过低,未进行后续QPCR试验。结果表明,当酒精体积分数为4.0%时,炎症因子Nrf2和HO-1的表达量均显著上升[图2(a)、图2(b)],所以酒精体积分数为4.0%时可有效建立酒精损伤模型。在安全质量浓度范围内,模型组(ETOH)与处理组细胞存活率显著低于空白组(CON),处理组(L、M、H)细胞存活率显著高于模型组(ETOH),说明固体饮料能够有效缓解酒精造成的细胞存活率降低的问题[(图2(c)])。
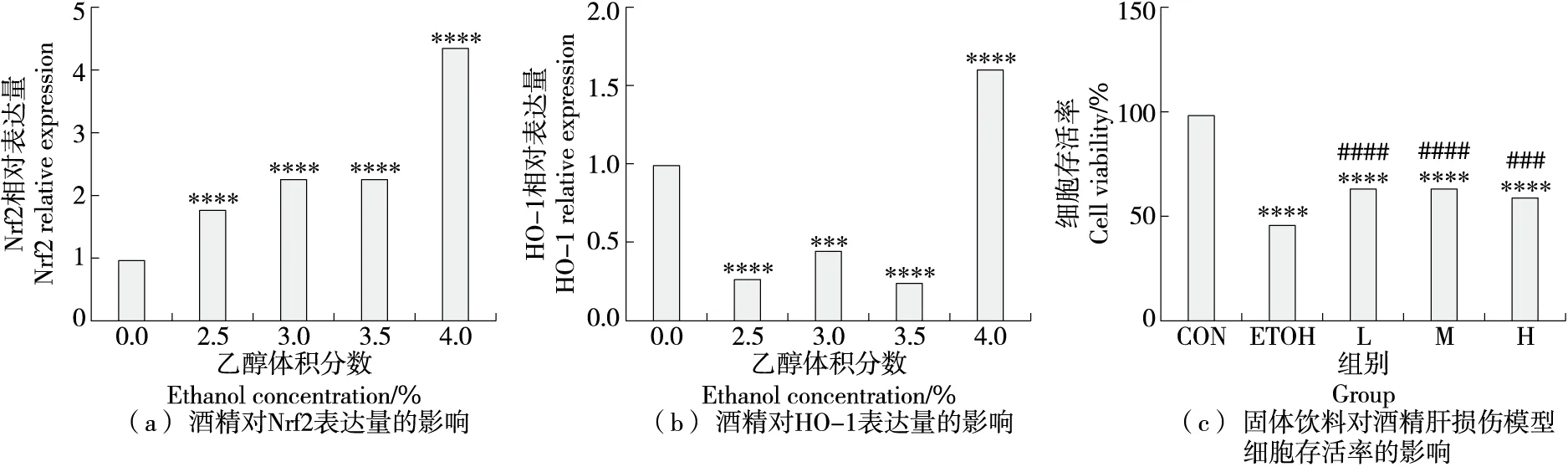
图2 酒精模型的确立及固体饮料对其细胞存活率的影响Figure 2 Establishment of the alcohol model and effects of formulation on cell viability
2.2 动物试验结果
2.2.1 大鼠肝系数情况 肝系数是指肝脏鲜重与大鼠重量的比值,正常情况下肝脏与体重的比值是恒定的,肝系数增大,表示肝脏水肿、炎症或增生肥大;肝系数减小表示脏器萎缩或者其他退行性病变[18]。CON组、ETOH组及固体饮料组的肝系数无明显差异性(P>0.05),说明试验灌胃的酒精浓度对肝脏外在表征无显著影响(表2)。
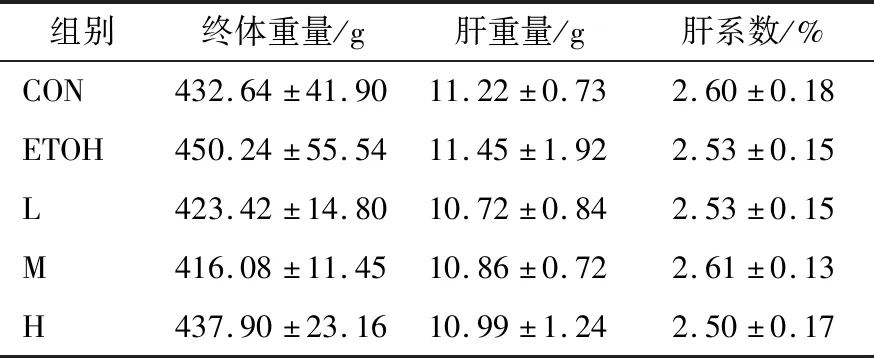
表2 各组大鼠肝系数Table 2 Hepatic index of each group rats
2.2.2 肝组织病理形态 由图3可知,HE染色显示CON组大鼠肝细胞肝索排列整齐,肝小叶、肝窦结构清晰,无水肿、脂肪变性,有少量肝细胞死亡;ETOH组大鼠肝组织切片具有典型的病理特征,肝细胞大小不均,气球样变性,有较多小泡性脂肪空泡,同时伴有炎症浸润、细胞坏死。相较于ETOH组,L组大鼠肝细胞水肿明显改善,空泡变性减少,炎症因子浸润减少,肝细胞排列紊乱情况有所改善。M组和H组与ETOH组相比,肝细胞形态趋于正常,炎症细胞浸润明显改善,细胞空泡变性明显减少,偶有细胞坏死,肝细胞排列与CON相比差异较小。综上,莓茶决明子固体饮料可有效改善大鼠酒精性肝损伤的组织病理学病变。
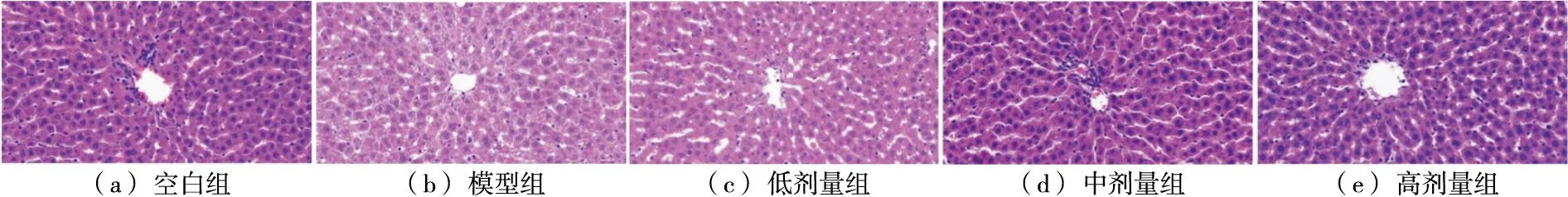
图3 大鼠肝组织H&E染色Figure 3 HE staining of rat liver tissue (40×)
2.2.3 大鼠血清生化指标 临床上,AST、ALT、LDH是反应肝损伤的敏感指标[17-18],AST、ALT和LDH的活性升高与肝损伤呈正比。与CON组相比,ETOH组血清ALT、AST、LDH水平极显著升高(图4,P<0.000 1),说明酒精肝损伤模型建立成功,提示肝细胞坏死、细胞膜通透性增加[18]。固体饮料各剂量组均可显著抑制大鼠饮酒导致的AST、ALT、LDH的酶活增高,且效果呈剂量依赖性。

图4 大鼠血清生化指标水平Figure 4 Serum biochemical index levels in rats
2.2.4 IL-6和TNF-α水平 炎症因子分泌是导致肝损伤的重要途径。IL-6是促炎症细胞因子,参与机体炎症反应。TNF-α在介导肝损伤中起一定作用,可直接导致细胞毒性,造成肝细胞坏死,影响肝内微循环[19]。如图5所示,与CON组相比,ETOH组血清炎症因子IL-6、TNF-α水平极显著升高,相对于ETOH组,固体饮料各剂量组均可极显著降低炎症因子水平(P<0.000 1),且与剂量浓度呈正比。因此,莓茶决明子固体饮料可显著减轻大鼠饮酒造成的炎症反应。

图5 大鼠血清炎症因子水平Figure 5 Rat serum inflammatory factor level
2.2.5 大鼠肝脏生化指标 酒精代谢过程产生活性氧自由基,过多氧化剂会造成自由基脂质过氧化,机体抗氧化酶GSH、SOD活性下降,抗氧化防御系统水平降低[20]。由图6(a)、图6(c)可知,与CON组相比,ETOH组大鼠肝脏中GSH、SOD含量均极显著下降(P<0.000 1)。MDA是脂质过氧化的第二产物,是反映组织损伤的重要指标,ETOH组大鼠肝脏TG、MDA含量较CON极显著升高(P<0.000 1)[图6(b)、图6(d)]。通过固体饮料干预,各剂量组GSH、MDA、TG浓度和SOD活性与ETOH组相比具有显著差异(P<0.05),固体饮料M、H组MDA含量与CON组无显著差异(P>0.05),H组SOD、TG含量与CON组无显著差异(P>0.05),结果表明固体饮料低中高剂量均可有效提高大鼠肝脏抗氧化酶的活力,加速清除氧自由基,缓解脂肪肝形成。
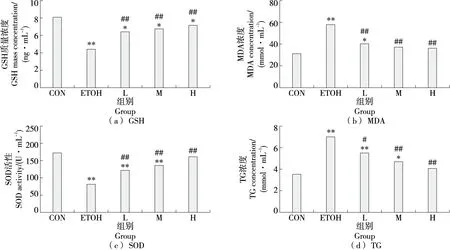
图6 大鼠肝脏生化指标水平Figure 6 Rat liver biochemical index levels
以上研究表明固体饮料低、中、高剂量组均能显著降低血清中肝损伤酶活性和炎症因子表达水平,抑制脂质过氧化和脂肪肝的生成,且呈剂量依赖性,高剂量组效果最佳。
2.2.6 转录组数据评估 将CON组、ETOH组和H组大鼠肝脏的RNA转录组测序结果与参考基因组进行比对共得到原始测序数据399 553 582个,经质控后得到测序数据395 459 552个。获得的质控后的测序数据中,所有样品的唯一比对率均达到82%以上,Q20值均大于96%,Q30值均大于91%,表明测序数量和质量可靠(见表3)。
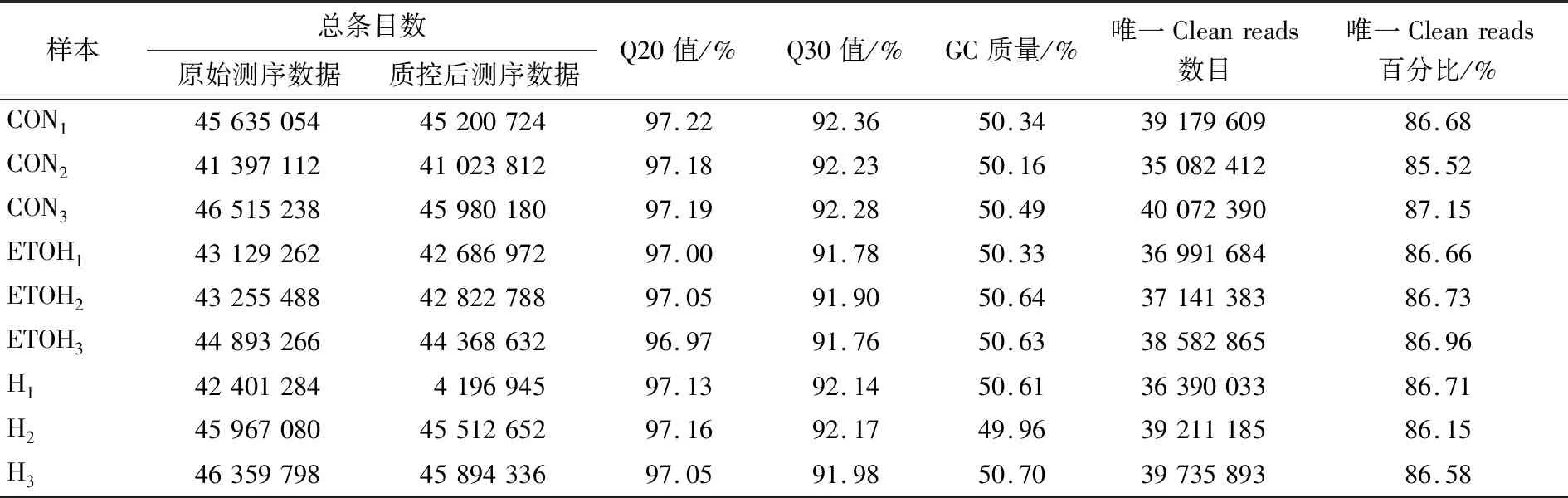
表3 样本测序质量和序列†Table 3 Sample sequencing quality and sequence mapping
2.2.7 差异表达分析 根据1.3.4中筛选标准,ETOH组较CON组,共有229个基因表达存在显著差异。ETOH组中有174个基因上调,55个基因下调。H组较ETOH组,共有106个基因表达存在显著差异,H组中有69个基因上调,37个基因下调。H组较CON组,有72个差异基因,有31个基因上调,41个基因下调。由差异基因结果分析可知,在H组固体饮料的干预下,酒精肝损伤模型大鼠与正常大鼠的差异减小,表达统计图见图7。
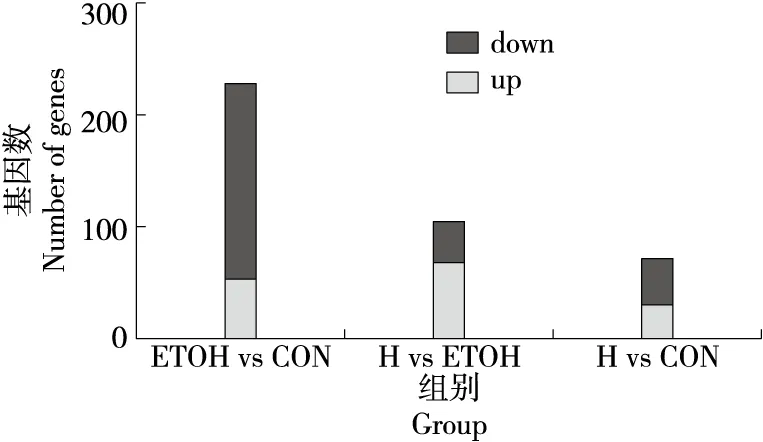
图7 差异表达统计Figure 7 Statistic analysis of the differentially expressed genes
2.2.8 差异表达基因的功能注释和富集分析
(1) GO注释:对ETOH组与CON组的229个差异基因以及H组与ETOH组的106个差异基因进行注释分析,注释结果统计:分子功能分组主要涉及分子功能调节剂、转录调节活性、催化活性和结合等功能;生物过程分组主要涉及免疫系统过程、细胞成分组织或生物发生、定位、多细胞生物过程、发展过程、对刺激的反应、代谢过程、生物调节等功能;细胞组分分组主要涉及胞外区部分、含蛋白质复合物、膜、膜部分、细胞器部分、细胞器和细胞部分等功能(表4)。
(2) KEGG注释:将ETOH组与CON组、H组与ETOH组差异基因进行KEGG注释分析,表5和表6显示了酒精干预和固体饮料干预后上调和下调的差异基因涉及排名前20的通路情况。酒精干预后,上调和下调基因涉及代谢通路分支有代谢、遗传信息处理、环境信息处理、细胞过程、有机系统、人类疾病,上调差异基因主要富集在运输和分解代谢、折叠、分类和降解、其他氨基酸代谢等通路,下调差异基因主要富集在细胞生长与死亡、运输和分解代谢、氨基酸的代谢和脂质代谢等通路(表5)。
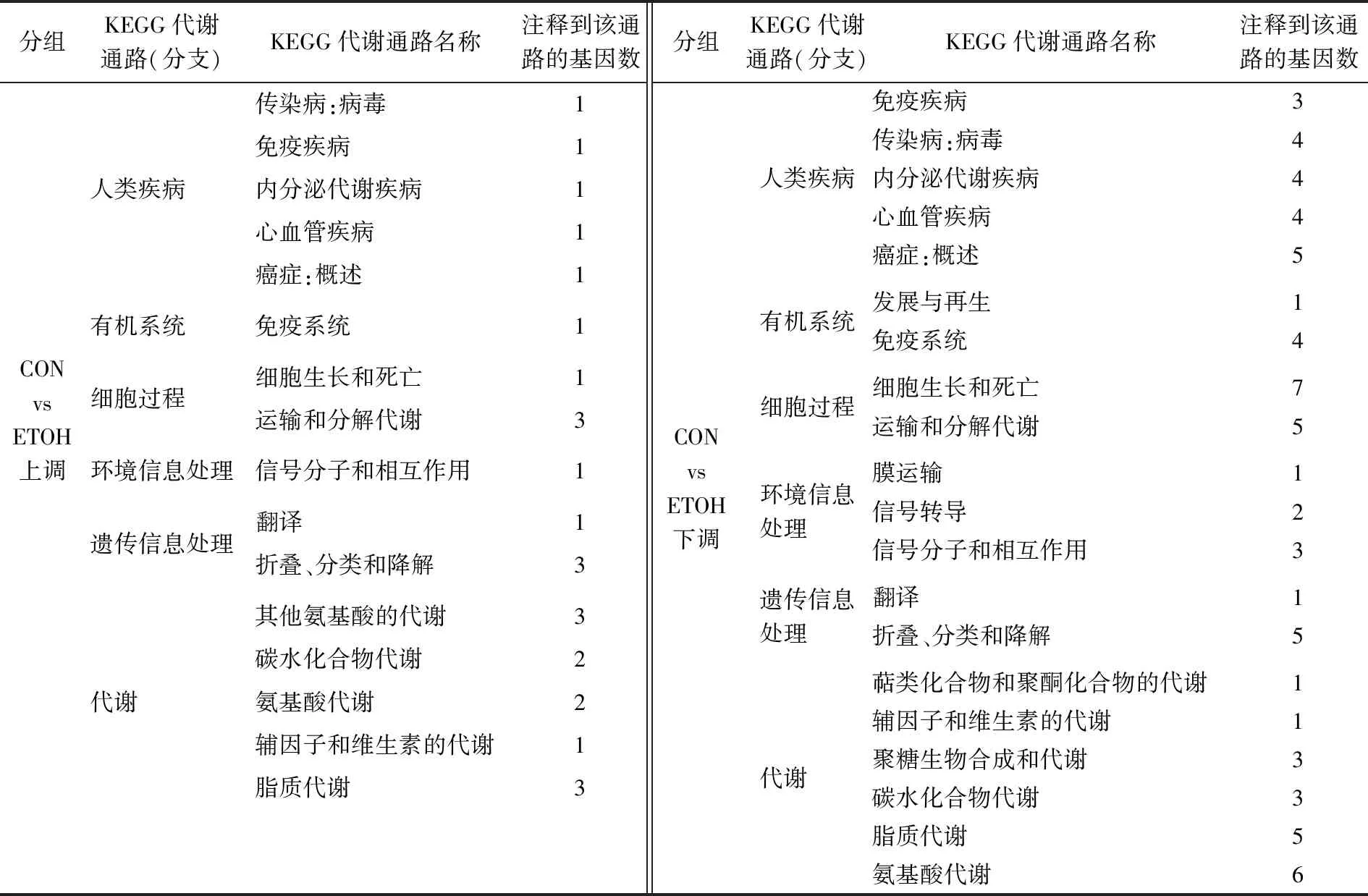
表5 ETOH组与CON组差异基因KEGG分类统计Table 5 KEGG Classification chart CON group vs ETOH group
固体饮料干预后,上调和下调差异基因涉及人类疾病、有机系统、细胞过程、环境信息处理遗传信息处理和代谢等通路分支,上调基因富集包括癌症、心血管疾病、免疫系统、细胞生长和死亡等通路,下调差异基因富集包括氨基酸代谢、辅因子和维生素代谢、碳水化合物代谢等通路(表6)。

表6 H组与ETOH组差异基因KEGG注释统计Table 6 KEGG comment statistics of Classification chart of H group and ETOH group
为明确酒精干预和固体饮料干预后的关键差异基因,进行进一步KEGG富集分析,其校正后的P值<0.05,为显著富集。由表7可知,基因主要富集到氨基酸的生物合成、半胱氨酸和蛋氨酸代谢、代谢途径、精氨酸生物合成和碳代谢。结合上述结果,筛选出关键差异基因spermidinesynthase(亚精胺合酶)、Sirt7(去乙酰化酶7)、RT1-A2(RT1 class Ia,locus A2)、RT1-CE1(RT1 I类,轨迹1)、LOC103692716(热休克蛋白 HSP 90-α)、Acap2(ArfGAP),这些基因与肝脏功能、炎症反应、脂质过氧化等相关。由此推测莓茶决明子固体饮料缓解酒精肝损伤与上述关键差异基因和通路相关。

表7 KEGG富集结果Table 7 KEGG enrichment results
3 结论
将莓茶提取物与决明子提取物颗粒配成的固体饮料应用于酒精肝损伤的护肝功效研究,最终结果表明低、中、高剂量的固体饮料均能改善饮酒大鼠的肝功能,有效缓解酒精引起的肝损伤,且作用机制与spermidinesynthase、Sirt7、RT1-A2、RT1-CE1、LOC103692716、Acap2基因调节及氨基酸的生物合成、半胱氨酸和蛋氨酸代谢、代谢途径、精氨酸生物合成和碳代谢等通路有关。后续可进一步挖掘数据探明更详细的作用机制并开展莓茶与决明子的协同功效研究。

