仿刺参雌性生殖腺皂苷提取分离工艺优化及体外抗氧化活性研究
钟静诗 张 健 刘 芳 王共明 王艺欣
(1. 上海海洋大学食品学院,上海 201306;2. 山东省海洋资源与环境研究院,山东 烟台 264006)
海参营养丰富且商业价值高,年产值达300亿元[1-2]。其中,仿刺参是中国北方养殖的重要经济品种,隶属于棘皮动物门海参纲楯手目刺参科仿刺参属[3],其含有多肽、多糖、磷脂、皂苷等多种生物活性成分,是海参中的珍品。海参加工过程中产生的大量副产物如生殖腺等具有丰富的营养成分,但未被充分开发利用[4]。目前,有关海参生殖腺的研究主要集中于通过生物酶解制备多糖、多肽等[2,5],而有关皂苷的研究较少。动植物皂苷具有抗氧化[6]、抗癌[7]、改善动脉粥样硬化[8]等生物活性,而仿刺参皂苷也被证实具有抗菌[9]、抗肿瘤[10]等作用,但对其抗氧化作用的研究尚未见报道。研究表明,氧化自由基产生于生物体的生长代谢过程中,与多种疾病相关[11],其过量产生后会引起细胞发生脂质过氧化、DNA损伤、蛋白质结构发生变化等[12],进而导致癌症、糖尿病、心血管等多种疾病发生。
目前,采用层析技术进行分离纯化的海参皂苷得率较低。而高速逆流色谱法(HSCCC)是利用液—液萃取达到分离纯化的目的,具有减少固定相对样品的吸附作用、制备量大等优点[13],已被应用于黄酮[14]、香豆木脂素[15]等物质的分离纯化中。研究拟采用超声辅助冷浸提取皂苷的方法,对仿刺参雌性生殖腺中皂苷的提取时间、乙醇体积分数、超声时间、料液比进行优化,对HSCCC溶剂体系配比的选择、流动相体积流量、转速进行优化,并测定粗皂苷及分离纯化后组分对DPPH自由基和ABTS自由基的清除能力,以期为仿刺参生殖腺活性成分的进一步开发利用提供依据。
1 材料与方法
1.1 材料与试剂
仿刺参雌性生殖腺:烟台开发区八角润康海产品经销部;
DPPH自由基清除能力检测试剂盒、ABTS自由基清除能力检测试剂盒:北京索莱宝科技有限公司;
乙醇、正丁醇等化学试剂:国产分析纯。
1.2 仪器与设备
高速逆流色谱仪:TBE200V型,上海同田生物技术有限公司;
高效液相色谱仪:1260型,安捷伦科技(中国)有限公司;
冷冻冻干机:FD-2A型,北京博医康实验仪器有限公司;
超声波清洗器:KQ-600B型,昆山市超声仪器有限公司;
高速中药粉碎机:XFB-200型,吉首市中诚制药机械厂;
旋蒸仪:IKA HB10型,德国IKA公司;
酶标仪:1510型,赛默飞世尔(中国)有限公司。
1.3 方法
1.3.1 粗皂苷提取工艺
仿刺参雌性生殖腺→冻干→粉粹过60目筛→超声辅助乙醇冷浸提取→旋蒸至流浸膏状→分散于水中→7 000 r/min离心30 min→过滤除去不溶性杂质→滤液水饱和正丁醇萃取→正丁醇层旋蒸浓缩→冻干→仿刺参雌性生殖腺粗皂苷粉末
1.3.2 标准曲线的绘制 参照Guo等[16]的方法,得标准曲线方程为y=0.063 4x+0.091 5,R2=0.996 1。
1.3.3 皂苷提取率计算 按式(1)计算皂苷提取率。
(1)
式中:
Y——皂苷提取率,%;
m1——粗皂苷粉末中皂苷质量,g;
m2——原料质量,g。
1.3.4 单因素试验
(1) 提取时间:固定乙醇体积分数60%,超声时间20 min,料液比1∶10 (g/mL),考察提取时间(1,3,6,9,12 d)对皂苷提取率的影响。
(2) 乙醇体积分数:固定提取时间1 d,超声时间20 min,料液比1∶10 (g/mL),考察乙醇体积分数(50%,60%,70%,80%,90%)对皂苷提取率的影响。
(3) 超声时间:固定提取时间1 d,乙醇体积分数60%,料液比1∶10 (g/mL),考察超声时间(10,20,30,40,50 min)对皂苷提取率的影响。
(4) 料液比:固定提取时间1 d,乙醇体积分数60%,超声时间20 min,考察料液比[1∶5,1∶10,1∶15,1∶20,1∶25 (g/mL)]对皂苷提取率的影响。
1.3.5 响应面试验 在单因素试验基础上,应用Box-Behnken中心组合设计原理,以皂苷提取率为响应值,提取时间、乙醇体积分数、超声时间、料液比为自变量,优化皂苷提取工艺并利用Design-Expert 8.0.6软件进行回归分析。
1.3.6 HSCCC分离纯化
(1) HSCCC溶剂体系的选择:参照文献[17]。HPLC分析条件:色谱柱ZORBAX SB-C18,流动相乙腈(A)—0.1%三氟乙酸(B);梯度洗脱:0~25 min,5% A;25~50 min,5%~25% A;50~60 min,25%~35% A;60~70 min,35%~55% A;70~75 min,55%~75% A;75~85 min,75%~100% A;流速1 mL/min;进样量30 μL;柱温30 ℃;检测波长205 nm。
参照马亮亮[18]的方法,在分液漏斗中配制不同比例两相溶剂体系20 mL,充分摇匀后静置分层。精密称取皂苷粗提物20 mg于分液漏斗中,加入上、下相各5 mL,平衡后各取上、下相2 mL,加入50%甲醇定容至10 mL,HPLC测定上、下相溶剂的色谱峰面积,并按式(2) 计算分配系数。
(2)
式中:
K——分配系数;
AU——上相溶剂色谱峰面积;
AL——下相溶剂色谱峰面积。
(2) HSCCC分离纯化工艺优化:在选定HSCCC溶剂体系的基础上,固定流动相体积流量2 mL/min,考察转速(700,750,800,850,900 r/min)对固定相保留率的影响;固定转速800 r/min,考察流动相体积流量(1.0,1.5,2.0,2.5,3.0 mL/min)对固定相保留率的影响。
(3) 粗皂苷的HSCCC分离纯化:配制高速逆流色谱两相溶剂体系于分液漏斗中静置分层,上相为固定相,下相为流动相。称取0.5 g粗皂苷,并加入上、下相各5 mL超声溶解,通过进样环泵入样品。HSCCC条件为转速800 r/min、流动相体积流量2 mL/min。每5 min收集一管样品,真空冷冻干燥后用50%乙腈溶解,测定205 nm下的吸光度,以时间为横坐标,吸光度为纵坐标绘制HSCCC分离纯化图。
1.3.7 仿刺参雌性生殖腺粗皂苷抗氧化能力的测定
(1) DPPH自由基清除率:配置DPPH工作液,96孔板中加入190 μL工作液,质量浓度分别为1,2,4,6,8,10 mg/mL的样品溶液10 μL,混匀后室温下避光静置30 min,测定515 nm下的吸光度。无水乙醇代替工作液为对照孔;提取液代替样品为空白孔。按式(3)计算DPPH自由基清除率。
(3)
式中:
R——自由基清除率,%;
A0——空白孔吸光度;
A1——样品孔吸光度;
A2——对照孔吸光度。
(2) ABTS自由基清除率:根据ABTS自由基清除能力检测试剂盒进行操作,测定405 nm下各孔的吸光度,并按式(3)计算ABTS自由基清除率。
1.4 数据处理
采用Excel 2010整理试验数据,使用Design Expert 8.0.6、SPSS 20.0 软件进行统计分析,分析方法采用单因素方差分析,Waller-Duncan检验,置信区间为95%(P<0.05),使用Origin 2019软件绘图。
2 结果与分析
2.1 单因素试验
2.1.1 提取时间对皂苷提取率的影响 由图1可知,仿刺参雌性生殖腺皂苷提取率在冷浸提取时间为6 d时最大(P<0.05),与朱亚红等[19]的结果接近。因此,选择提取时间3,6,9 d进行响应面试验。
2.1.2 乙醇体积分数对皂苷提取率的影响 由图2可知,皂苷提取率随乙醇体积分数的增大而升高,当乙醇体积分数为80%时达到峰值,且显著高于其他处理组(P<0.05)。皂苷的极性一般较大,根据相似相溶原理,过高体积分数的乙醇可能会降低皂苷的溶解度[20]。同时,过高体积分数的乙醇会促进仿刺参雌性生殖腺中的脂溶性杂质和色素溶出,从而降低皂苷的提取率。这与赵亚东[21]的结论类似。因此,选择70%,80%,90%乙醇体积分数进行响应面试验。
2.1.3 超声时间对皂苷提取率的影响 由图3可知,仿刺参雌性生殖腺中的皂苷提取率随超声时间的延长而增大,当超声时间为30 min时达到峰值,且显著高于其他处理组(P<0.05),而后提取率逐渐下降。超声波波长极短,能产生空化作用和机械效应等,增加细胞的渗透性,使溶剂更易于进入细胞,从而有利于皂苷的溶出[22-23]。
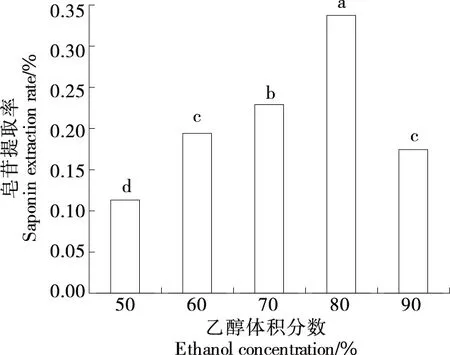
字母不同表示差异显著(P<0.05)图2 乙醇体积分数对皂苷提取率的影响Figure 2 Effect of ethanol concentration on yield of saponins
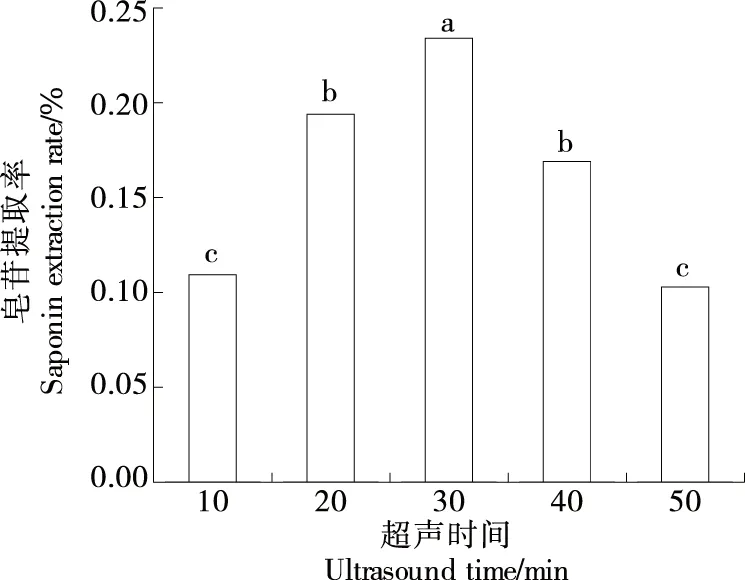
字母不同表示差异显著(P<0.05)图3 超声时间对皂苷提取率的影响Figure 3 Effect of ultrasound time on yield of saponins
随着超声时间的进一步延长,超声过程中不断产生的热量可能导致皂苷成分损失。因此,选择超声时间20,30,40 min进行响应面试验。
2.1.4 料液比对皂苷提取率的影响 由图4可知,随着料液比的升高,皂苷提取率增加,当料液比为1∶20 (g/mL) 时达到峰值,且显著高于其他处理组(P<0.05),而后下降。一般而言,较高的溶剂体积能提高提取率,过高的溶剂体积一方面会浸出较多的杂质,导致溶剂黏度增大,影响皂苷的溶出进而降低提取率[24];另一方面,超声产生的能量被溶剂吸收,能量耗散,导致超声对皂苷提取的作用减小。因此,选择料液比1∶15,1∶20,1∶25 (g/mL)进行响应面试验。
2.2 响应面试验
2.2.1 试验设计与分析 在单因素试验的基础上,选择提取时间、乙醇体积分数、超声时间、料液比4个因素进行Box-Behnken试验设计,因素水平见表1,试验设计及响应结果见表2。

表1 响应曲面因素水平表Table 1 Factors and levels of response surface
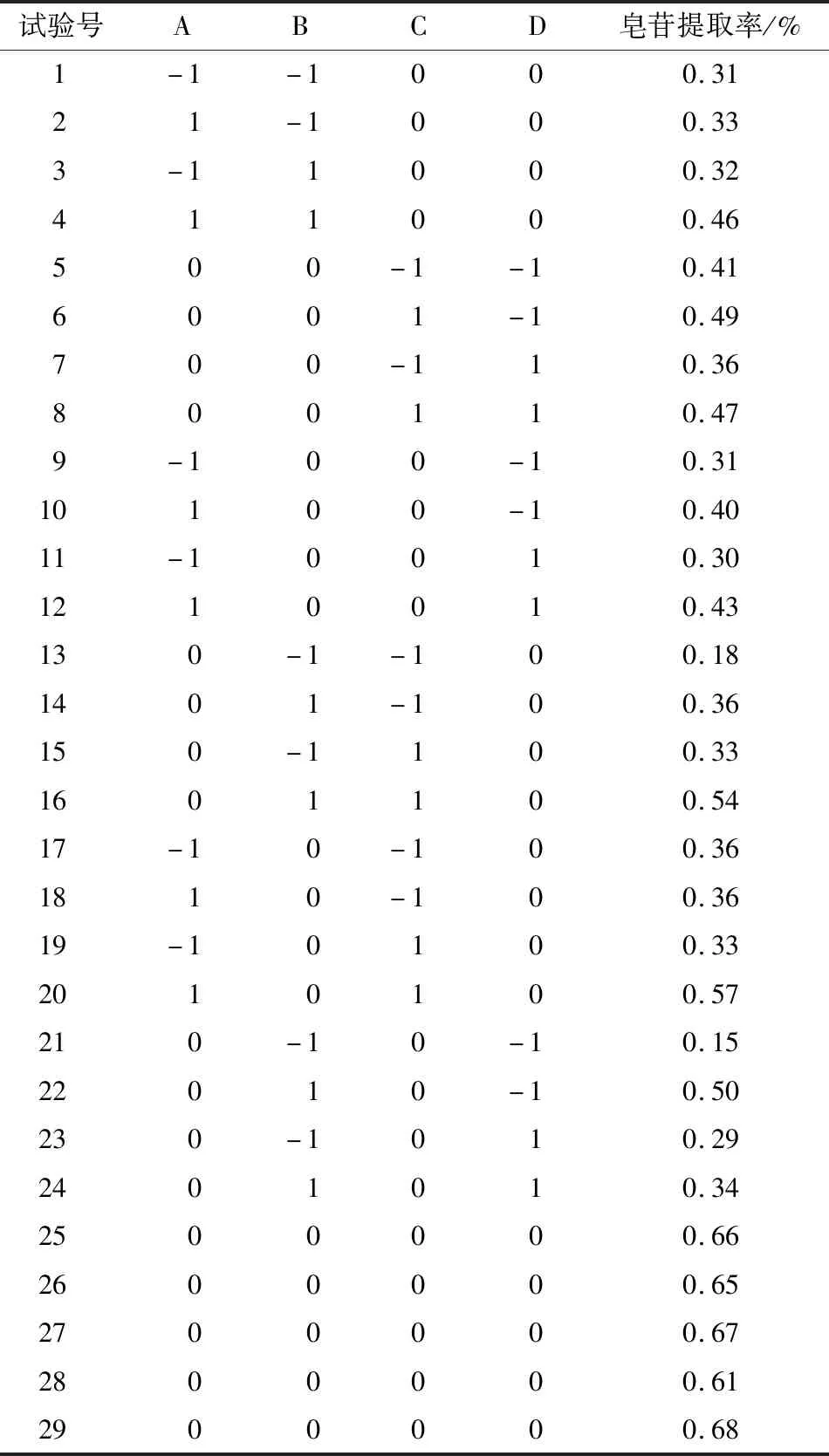
表2 响应面试验设计及结果Table 2 Experimental design and results of the response surface analysis
2.2.2 响应面数学模型建立与方差分析 运用Design-Expert 8.0.6软件对试验数据进行统计分析,得到回归模型方程为:
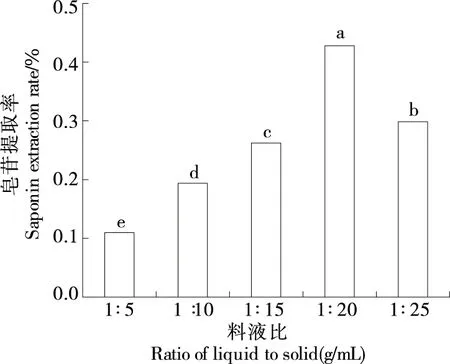
字母不同表示差异显著(P<0.05)图4 料液比对皂苷提取率的影响Figure 4 Effect of solid-to-solvent ratio on the yield of saponins
Y=0.65+0.052A+0.077B+0.058C-5.833×10-3D+0.03AB+0.06AC+0.01AD+7.5×10-3BC-0.075BD+7.5×10-3CD-0.14A2-0.18B2-0.10C2-0.14D2。
(4)
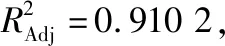
2.2.3 响应面交互作用分析 由表3可知,AC、BD的P值<0.05,与之对应的图5(b)、图5(e)曲面陡峭,等高线较为密集且呈椭圆状,表明提取时间与超声时间、乙醇体积分数与料液比有相互作用。而其他响应面曲面平缓,等高线密度较为均匀且趋近圆形,相互作用不显著,与方差分析的结果相对应。

图5 各因素交互作用对皂苷得率的响应面图Figure 5 Response surface diagrams and contour diagrams of the interactive effects of various factors on the yield of saponins

表3 回归模型方差分析†Table 3 Variance analysis of the regression model
2.2.4 验证实验 回归方程分析得最佳工艺条件为提取时间6.93 d,乙醇体积分数82.61%,超声时间32.78 min,料液比1∶20 (g/mL),此时皂苷提取率理论值为0.68%。鉴于试验的可操作性,将最佳条件适当调整为提取时间7 d,乙醇体积分数83%,超声时间33 min,料液比1∶20 (g/mL)。在此条件下进行3次验证实验,皂苷提取率为(0.66±0.02)%,与理论提取率无显著差异,说明该响应模型具有适用性,工艺参数具有可靠性。
2.3 HSCCC分离条件优化
2.3.1 HSCCC溶剂体系的选择 分配系数(K)反映样品在两相中的分配比例,过小会降低分离度,过大会延长洗脱时间,峰形变宽。一般而言,0.5≤K≤2.0能得到分离效果较好的峰形[25]。由表4可知,溶剂体系4的K值>2,样品在固定相中的保留时间较长,会导致分离时间的延长和溶剂消耗的增加,不宜选用。其余溶剂体系的K值均在0.5~2.0范围内,能较好分离皂苷,最终选定溶剂体系为V乙酸乙酯∶V正丁醇∶V甲醇∶V水=2.0∶3.0∶0.2∶4.8。
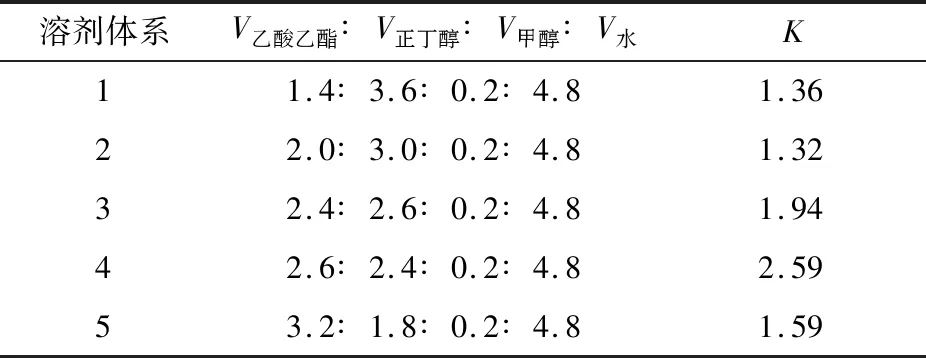
表4 仿刺参雌性生殖腺皂苷在不同溶剂体系中的分配系数Table 4 Distribution coefficient of gonad saponins from the female Apostichopus japonicus in different solvent systems
2.3.2 HSCCC流动相体积流量 一般而言,固定相保留率应大于30%[25]。由图6可知,流动相体积流量的平方根与固定相保留率呈线性关系,其回归方程为y=-16.90x+67.159,R2=0.990 9,线性关系较好,与文献[26]相符。随着流动相体积流量的提高,固定相保留率不断降低,但过低的流动相体积流量会使样品出峰时间延长。因此,选择流动相体积流量为2 mL/min。
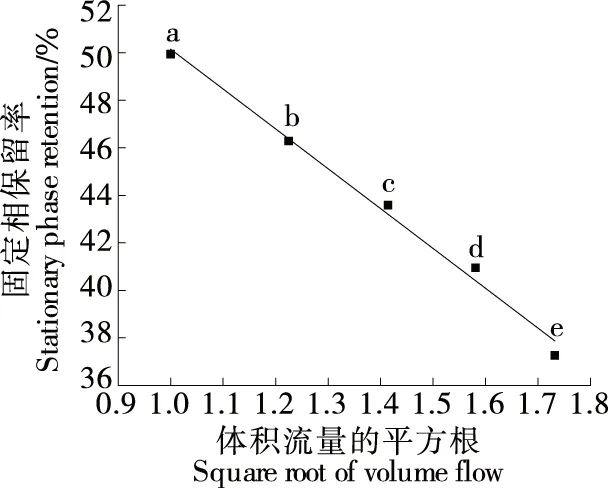
字母不同表示差异显著(P<0.05)图6 流动相体积流量对固定相保留率的影响Figure 6 Effect of volume flows on the retention rate of stationary phase
2.3.3 HSCCC转速 由图7可知,随着转速的提高,固定相保留率不断提高,当转速为900 r/min时,固定相保留率达到最高且各组间差异显著(P<0.05)。皂苷具有起泡性,过高的转速会产生乳化现象[27],不利于皂苷的分离纯化。因此,选择转速为800 r/min。
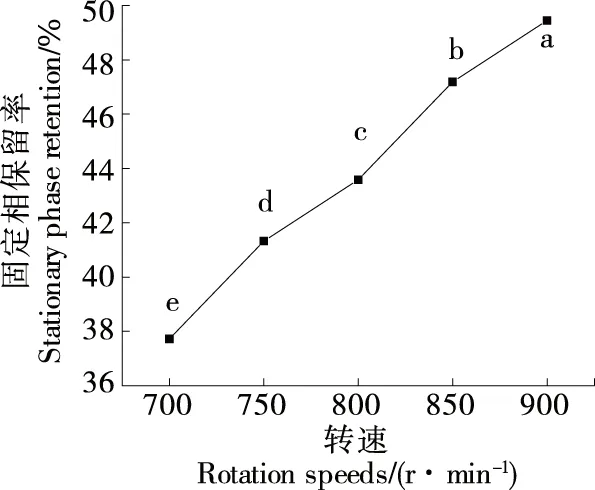
字母不同表示差异显著(P<0.05)图7 转速对固定相保留率的影响Figure 7 Effect of rotation speeds on the retention rate of stationary phase
2.3.4 HSCCC分离纯化仿刺参雌性生殖腺皂苷 按优化条件分离纯化仿刺参雌性生殖腺粗提物,得到分离纯化组分如图8所示。经优化后,得到两组分分别命名为组分1和组分2。
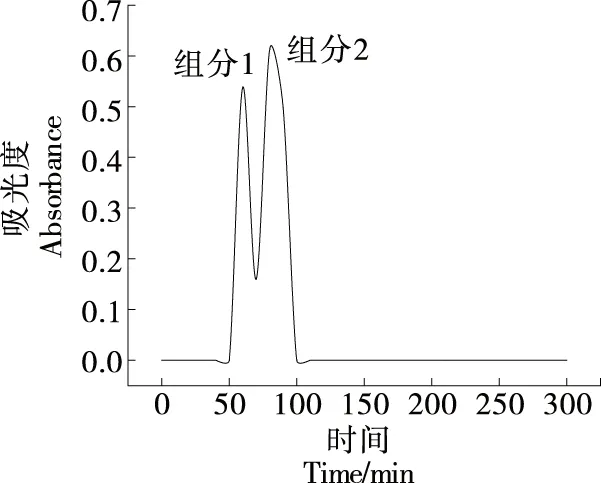
图8 HSCCC分离纯化Figure 8 Separation and purification by HSCCC
2.4 抗氧化能力分析
2.4.1 DPPH自由基清除率 由图9可知,仿刺参雌性生殖腺皂苷粗提物和HSCCC分离纯化后的两组分均具有一定的清除DPPH自由基的能力,且DPPH自由基清除率随样品质量浓度的增加而增大,同一样品不同浓度组间差异显著(P<0.05),其清除DPPH自由基的能力低于维生素C。当样品质量浓度>4 mg/mL时,粗提物的抗氧化活性显著高于组分1而低于组分2(P<0.05),其中10 mg/mL组分2的DPPH自由基清除率最高,可达(38.40±0.14)%,显著高于皂苷粗提物和组分1的,推测经HSCCC分离纯化后,具有较高清除DPPH自由基的活性成分得到了有效分离。
2.4.2 ABTS自由基清除率 由图10可知,仿刺参雌性生殖腺粗提物和HSCCC分离纯化后两组分均具有清除ABTS自由基的能力,且ABTS自由基清除率随样品质量浓度的增加而增大,其清除ABTS自由基的能力低于维生素C。此外,组分1和组分2的ABTS自由基清除率高于同质量浓度的粗提物,其中组分2的清除率又高于组分1,且差异均显著(P<0.05)。当仿刺参雌性生殖腺皂苷质量浓度为10 mg/mL时,组分1和组分2的ABTS自由基清除率可达(24.49±0.50)%和(33.65±0.34)%,显著高于粗提物的,可能与分离纯化后除去部分杂质有关。
3 结论
对仿刺参雌性生殖腺的皂苷提取进行了工艺优化,获得最佳提取工艺条件为提取时间7 d,乙醇体积分数83%,超声时间33 min,料液比1∶20 (g/mL),此条件下粗皂苷提取率为(0.66±0.02)%。在高速逆流色谱法溶剂体系配比V乙酸乙酯∶V正丁醇∶V甲醇∶V水=2.0∶3.0∶0.2∶4.8、流动相体积流量为2 mL/min,转速为800 r/min条件下分离纯化粗皂苷,可得到组分1和组分2,分离效果较好。经测定,仿刺参雌性生殖腺粗皂苷、组分1和组分2均具有一定的抗氧化性,且经分离纯化后组分1的ABTS自由基清除能力显著高于粗提物(P<0.05);组分2对DPPH自由基和ABTS自由基的清除能力均显著高于皂苷粗提物和组分1(P<0.05)。综上,作为一种新型分离手段,高速逆流色谱法可有效分离粗皂苷并获得具有更高抗氧化活性的组分。后续可对组分1和组分2进一步分离纯化并进行物化性质分析和结构解析,以探究其构效关系。
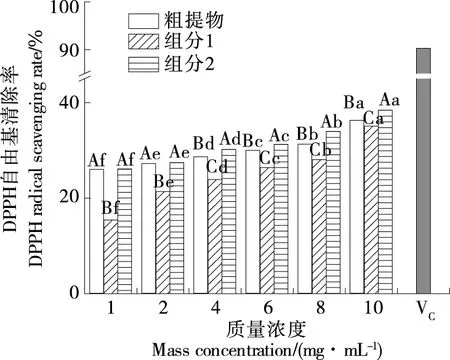
同一浓度不同样品大写字母不同表示差异显著(P<0.05);同一样品小写字母不同表示差异显著(P<0.05)图9 仿刺参雌性生殖腺皂苷的DPPH自由基清除率Figure 9 DPPH radical scavenging rate of saponins from the female gonad of Apostichopus japonicus
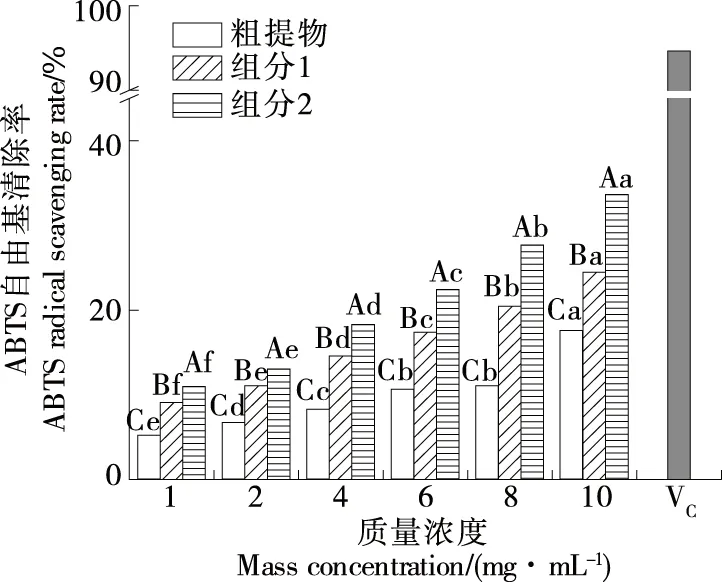
同一浓度不同样品大写字母不同表示差异显著(P<0.05);同一样品小写字母不同表示差异显著(P<0.05)图10 仿刺参雌性生殖腺皂苷的ABTS自由基清除率Figure 10 ABTS radical scavenging rate of saponins from the female gonad of Apostichopus japonicus

