NSCLC骨转移风险预测模型的建立和验证
胡春晓,刘亚锋,苏忆欣,郭健强,张文婷,王雪芹,谢 军, 胡万发,吴 静,3,邢应如,3,胡 东,3,丁选胜
肺癌已成为全球发生率及病死率较高的癌症之一[1],其中非小细胞肺癌(non-small cell lung cancer,NSCLC)比例>80%。随着医疗技术的发展,肺癌患者的生存期有了一定程度上延长,但五年生存率很低[2],仍有57%的患者会发生远处转移,其中骨转移发生率最高,占比30%~40%[3]。
骨转移的早诊断、早治疗,能提高患者的生存期。目前,临床上骨转移常用的诊断方法是全身影像学检查,但在NSCLC的早期检出率较低,成本较高,当影像学显示肿瘤转移时,患者已处于肺癌晚期,预后较差[4]。该研究通过筛选NSCLC患者发生骨转移的危险因素,构建列线图来早期预测NSCLC患者骨转移发生风险,为临床的早期诊治提供可靠依据。
1 材料与方法
1.1 病例资料收集2016年1月—2020年12月在安徽理工大学附属肿瘤医院(淮南东方医院集团肿瘤医院)和安徽理工大学附属医院收治的经病理学确诊的NSCLC患者的临床资料。排除标准:① 腺癌(LUAD)、鳞癌(LUSC)以外的病理类型。② 15 d之内接受手术、放疗、化疗等治疗。③ 严重的骨质疏松、风湿性关节病、外伤性骨折以及其他严重的并发疾病。④ 影响骨代谢的内分泌疾病( 如糖尿病血糖异常、甲状腺和甲状旁腺疾病)。按照排除标准,最终纳入230例患者。
1.2 肿瘤标志物检测采集两组患者空腹静脉血3 ml,分离血清,癌胚抗原(carcinoembryonic antigen,CEA)、甲胎蛋白(alpha fetoprotein,AFP)采用化学发光法测定,CEA参考值范围:0~10 μg/L,AFP参考值范围:0~20 μg/L。
1.3 血清Ca2+、磷(phosphorus,P)、碱性磷酸酶(alkaline phosphatase,ALP)检测采集2组患者空腹静脉血3 ml,对所有患者血清Ca2+采用邻甲酚酞络合酮法测定,血清P采用磷钼酸盐法测定,血清ALP采用NPP-AMP法测定;血清Ca2+参考范围:2.25~2.75 mmol/L,血清P参考范围:0.97~1.61 mmol/L,血清ALP参考范围:50~136 U/L。
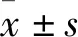
2 结果
2.1 建模组和验证组NSCLC骨转移基线情况描述共纳入230例患者,按照3 ∶2的比例随机分成建模组和验证组,其中138例为建模组,骨转移患者70例(50.7%),无骨转移患者68例(49.3%)。验证组共92例患者,骨转移患者47例(51.1%),无骨转移患者45例(48.9%)(表1)。

表1 建模组和验证组病例的基线数据[n(%)]
2.2 NSCLC骨转移危险因素的单因素及多因素分析对建模组138例患者发生骨转移的危险因素进行单、多因素逻辑回归分析。在单因素分析结果中,以P<0.1为标准将年龄(P=0.018)、性别(P=0.004)、病理类型(P=0.007)、N分期(P=0.089)、ALP(P=0.015)、CEA(P=0.002)纳入多因素Logistic回归分析,结果显示年龄(P=0.034)、性别(P=0.011)、ALP水平(P=0.003)、CEA水平(P=0.003)作为NSCLC骨转移的独立危险因子具有统计学意义,而病理类型(P=0.053)与骨转移密切相关但未显示统计学意义(表2)。
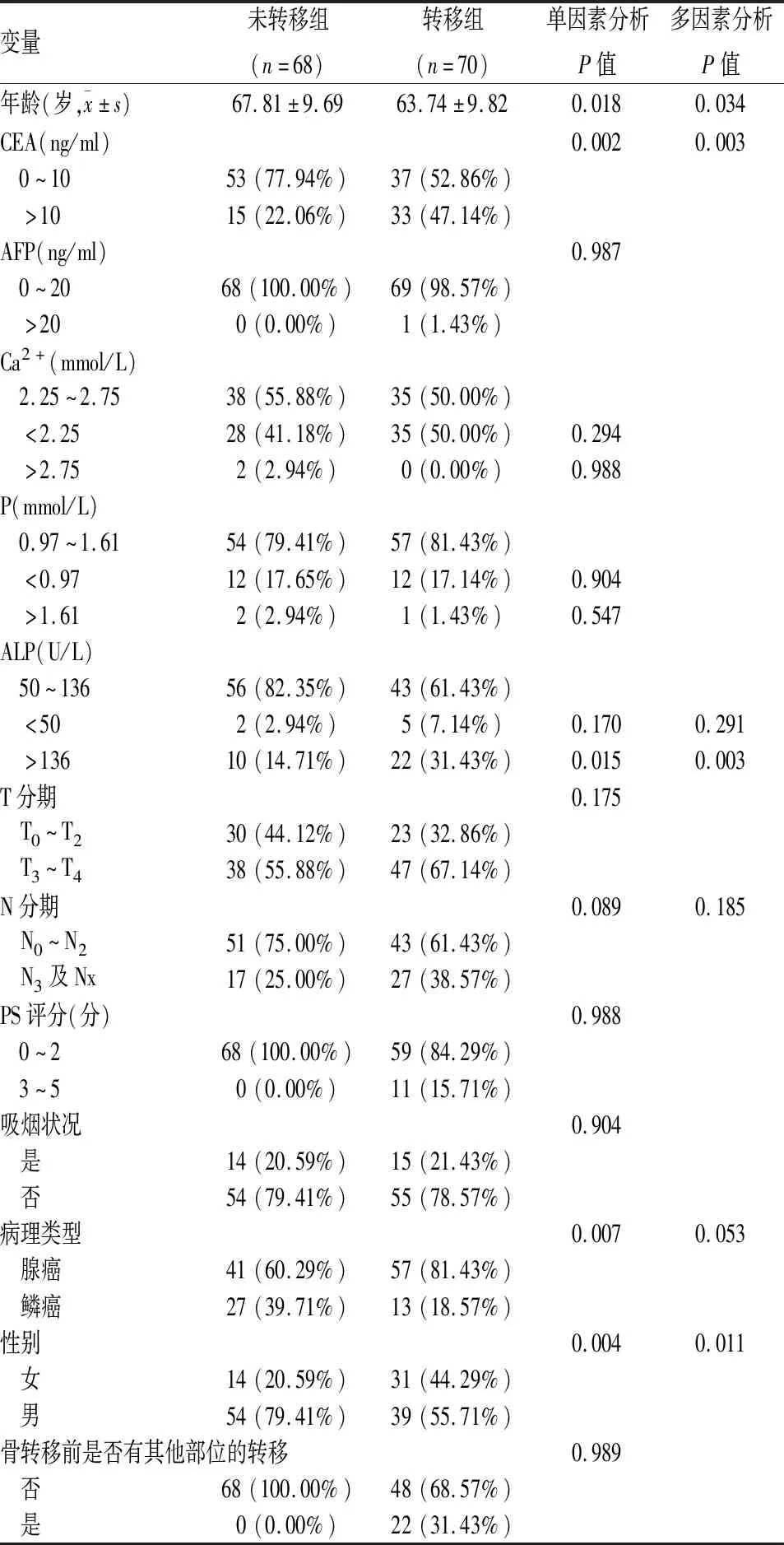
表2 NSCLC患者骨转移单因素及多因素分析[n(%)]
2.3 构建预测模型并验证同样以P<0.1为标准将年龄、性别、病理类型、ALP、CEA为自变量,以是否发生骨转移为因变量,进行Logistic回归,计算相应的回归系数,建立数学预测模型,NSCLC患者发生骨转移的风险为P=2.191 68+1.262 63×CEA+0.764 27×ALP-1.071 16×病理类型-1.122 07×性别-0.043 54×年龄。对建模组绘制ROC,CEA、年龄、ALP、病理类型、性别的AUC值分别为0.625、0.607、0.604、0.394、0.382,其中CEA的AUC值最高,性别和病理类型的预测效能不佳。而联合指标(年龄、性别、病理类型、CEA、ALP)预测的AUC=0.792要高于单一指标预测,说明联合指标预测要比单一指标预测有更高的准确性(图1A)。年龄、CEA、ALP的特异度分别为72.1%、77.9%、82.4%,灵敏度分别为52.9%、47.1%、38.6%,而联合指标的特异度和灵敏度分别为73.5%、77.1%(表3),其综合表现优于单一指标。基于同一个模型,将验证组的92例NSCLC患者进行ROC分析,联合指标预测的AUC值为0.629,特异度为46.7%,灵敏度为83.0%(表3),ROC曲线显示联合指标预测要比单一指标指标预测效能更佳(图1B)。
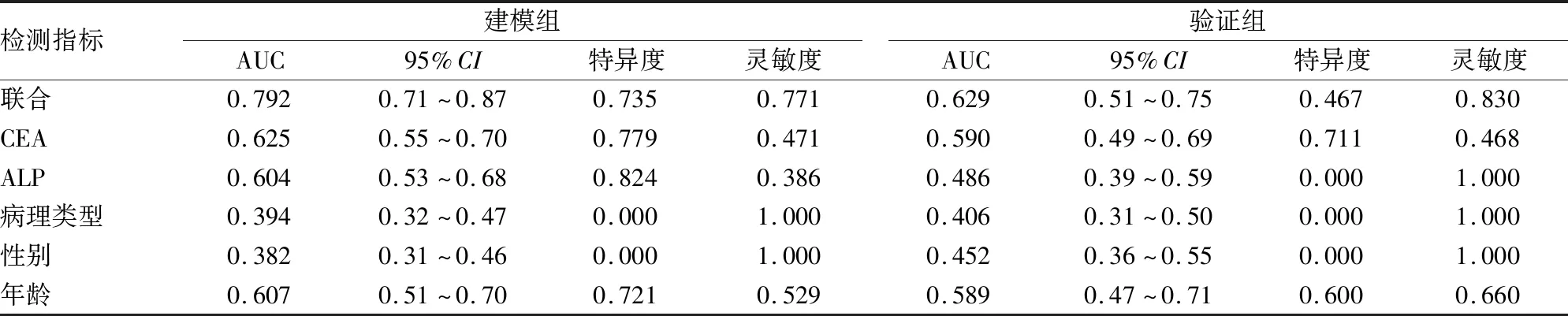
表3 建模组和验证组各因素及联合指标预测的AUC
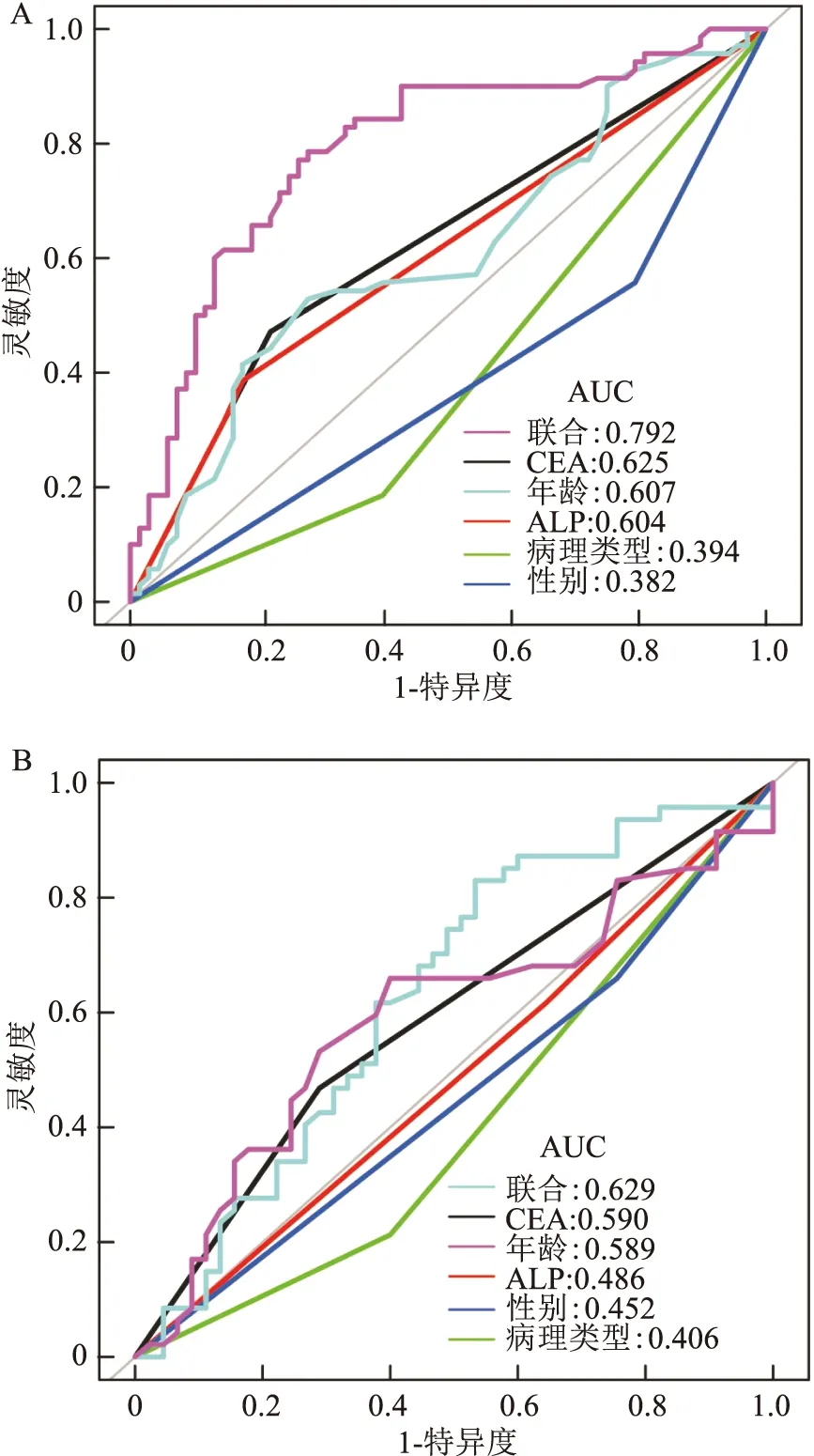
图1 建模组及验证组的ROC曲线分析
2.4 预测模型的可视化将多因素分析筛选出来的因素即年龄、性别、病理类型、ALP、CEA纳入预测模型,使用“RMS”软件包建立列线图。分为每个危险因素对应的分值,总分为全部危险因素对应的分值相加得到的总分数,每一个总分对应下方的骨转移风险,见图2。
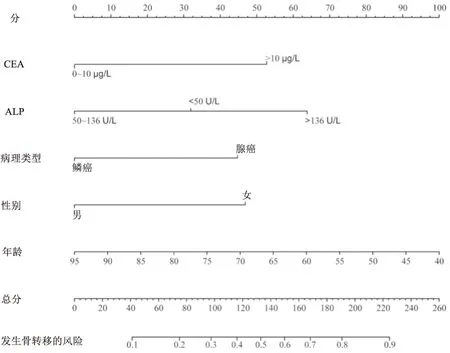
图2 NSCLC患者骨转移列线图预测模型
2.5 绘制列线图的校准曲线及DCA绘制列线图的校准图,红线代表该模型的标准曲线,黑线代表该模型的校准曲线,校准图显示该模型的校准曲线趋势与标准曲线贴合程度尚可,说明该模型用于预测NSCLC患者骨转移风险具有可靠性(图3)。通常应用DCA评价NSCLC骨转移风险预测模型的临床适用性,横线表示所有样本都是阴性,净获益为0;斜线表示所有样本都是阳性,净获益是个斜率为负值的反斜线。决策曲线距离2条极端线越远,说明列线图临床应用价值越高,DCA的结果表明,列线图模型可在很大的风险阈值概率范围内提高对骨转移风险的预测能力。见图4。
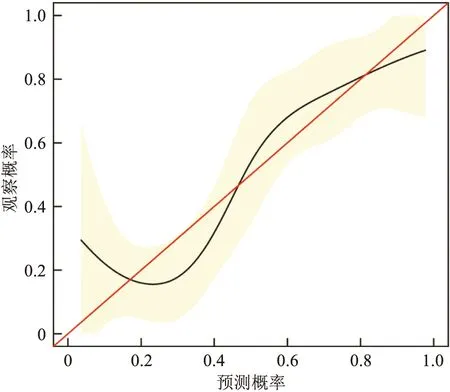
图3 列线图的校准曲线
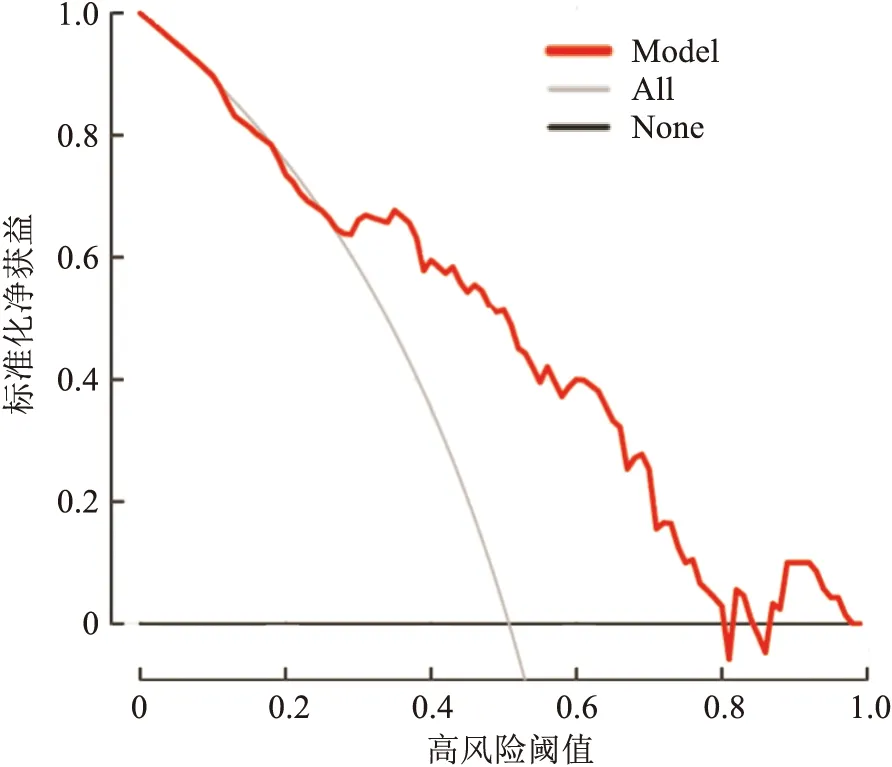
图4 NSCLC骨转移预测模型的DCA分析
3 讨论
骨相关事件(SREs)常在肺癌患者骨转移后发生,包括疼痛、病理性骨折、脊髓压迫、高钙血症等。 其中,疼痛是肺癌发生骨转移后最为明显的临床特征[5]。但是,由于骨转移发病隐匿,骨相关事件大多在晚期才会出现,往往导致医生不能及时发现骨转移发生,使患者错过诊治的最佳时机。CT、MRI、骨X线全身显像等常规影像学技术是目前临床上常用来诊断骨转移的方法,但也有一定局限性,例如患者往往在出现明显的临床特征后才做影像学检查,可能已处于肺癌晚期,此时已不能取得最佳的治疗效果。常规的影像学检查既不能在早期及时发现NSCLC患者骨转移的发生,又会给患者带来一定的经济压力,这就推动人们寻找更加简便适用的方法来预测NSCLC患者发生骨转移的早期风险,其对于延长患者生存期、改善临床治疗效果具有十分重要的意义。本研究共纳入了14个可能与NSCLC骨转移发生相关的的因素,其中CEA(P=0.003)、ALP(P=0.003)、病理类型(P=0.053)、年龄(P=0.034)、性别(P=0.011)可作为NSCLC患者骨转移发生风险的预测因素。韩春明 等[6]研究表明,肺癌骨转移与病理类型具有相关性,腺癌骨转移发生率高,与本研究结果一致。有研究[7]表明,骨转移的患者比未转移的患者更年轻;本研究同样表明年龄小的NSCLC患者更容易发生骨转移。在临床实践中,病理类型(P=0.053)有意义且该指标接近于0.05的统计学标准,所以这个指标可作为预测因素纳入预测模型。
Ayan et al[8]研究NSCLC患者和SCLC患者血清CEA水平,结果显示,发生骨转移的NSCLC患者血清的CEA水平明显高于未发生骨转移患者。与其相符,在本研究中,骨转移组CEA水平显著高于未转移组。ALP是反映成骨细胞活性的重要标志物,不仅由成骨细胞分泌,还可由肝脏、小肠和胎盘等各种器官产生。有文献[9]报道,肺癌骨转移多为溶骨性骨损坏,在发生骨转移的乳腺癌及肺癌患者中,血清骨形成及骨吸收标志物均可见上升表达,骨转移的发生造成骨受损会使成骨细胞分泌大量ALP来修复受损骨骼,因此,肺癌骨转移的患者ALP水平显著增高,这与本研究结果一致。该研究显示,建模组中,骨转移和未转移组的NSCLC患者性别具有显著差异,女性发生NSCLC骨转移的风险更高,这与冯小双 等[10]的研究结果近似,骨转移在肺癌和食管癌患者转移部位中的占比男性低于女性(P<0.01)。有研究[11]报道,血清Ca2+、ALP、细胞角蛋白19片段抗原21-1(CYFRA21-1)联合预测肺癌骨转移的AUC值为0.765,而在本研究中,联合指标预测的AUC值为0.792,提示后者预测效能更高。
列线图能够预测疾病风险或生存结局,整合了各种个体危险因素,量化了每个变量的影响,从而可视化不同患者的结果[12]。该模型可预测10%~90%的骨转移风险。假设一个NSCLC男性患者测得CEA水平为12.3 ng/ml,ALP水平为142 U/L,病理类型为腺癌,年龄68岁,那该患者的总分为53(CEA>10 ng/ml)+64(ALP>136 U/L)+45(腺癌)+49(年龄=68)+0(男性)=211,说明该患者此刻骨转移的风险=86%,发生骨转移的风险较大,建议尽快行骨转移相关检测及治疗。

