FTO诱导TSG-6 mRNA去甲基化对瘢痕疙瘩的影响
梁书宝,李心怡,丁以春,李小静
基于瘢痕疙瘩浸润性生长的特性,故有提出瘢痕疙瘩肿瘤源性学说[1];肿瘤坏死因子-α刺激基因-6(tumor necrosis factor alpha stimulated gene-6,TSG-6)在瘢痕疙瘩中参与多种炎性反应的抗炎基因调节,能够抑制人病理性瘢痕成纤维细胞的增殖并促进其凋亡[2-3],但其上游调控机制尚不明确;N6-甲基腺嘌呤(N6-methyladenosine, m6A) RNA甲基化是指发生在mRNA腺嘌呤(A)第6位N原子上的一种转录后修饰方式,而m6A甲基化过程是可逆性的:去甲基化酶的作用是催化m6A去除甲基,包括去甲基化酶肥胖相关蛋白(fat mass and obesity associated, FTO)和α-酮戊二酸依赖型双加氧酶alkB同源物5(α-ketoglutarate dependent dioxygenase alkB homolog 5,ALKBH5);甲基化酶的作用为促进m6A甲基化,包括甲基转移酶样蛋白3(methyltransferase like 3,METTL3)、甲基转移酶样蛋白14(methyltransferase like 14,METTL14)和肾母细胞瘤1-结合蛋白(Wilms′ tumor 1-associating protein, WTAP)[4-6]。但是目前基于TSG-6 mRNA的m6A RNA甲基化调控机制在瘢痕疙瘩中的作用及其机制研究在国内外均未见报道。该研究通过对瘢痕疙瘩组织和正常皮肤组织中TSG-6 mRNA甲基化水平及FTO表达水平的检测,为瘢痕疙瘩的发病机制研究和防治提供新的思路。
1 材料与方法
1.1 材料来源瘢痕疙瘩组织及正常皮肤组织均来自于安徽医科大学第一附属医院门诊及病房患者术中切除,随机选取新鲜切除组织分为实验组(瘢痕疙瘩组织)和对照组(瘢痕疙瘩患者植皮手术供区或瘢痕疙瘩周围修剪的正常皮肤);所取标本均已获得患者同意并签字确认,所有标本均无感染及溃疡且未接受过任何药物及放射治疗。
1.2 主要试剂DMEM高糖培养基购自美国Hyclone公司;Triton X-100购自北京索莱宝公司;Alexa Fluor 488标记山羊抗小鼠IgG、Alexa Fluor 555标记驴抗兔IgG购自上海碧云天生物技术公司;总RNA提取试剂盒购于德国Qiagen公司;m6A抗体购自德国Synaptic Systems公司;生物素RNA标记混合液购自瑞士Roche公司;羊抗兔HRP标记二抗购自北京中杉金桥生物技术有限公司;链霉亲和素磁珠、荧光定量PCR试剂盒购自美国Thermo Fisher公司。
1.3 实验方法
1.3.1免疫荧光染色 分别收集人瘢痕疙瘩组织与正常皮肤组织,采用组织块贴壁法提取并培养瘢痕疙瘩成纤维细胞和正常皮肤成纤维细胞;成纤维细胞用PBS清洗后用4%多聚甲醛固定30 min,0.5% Triton X-100透化处理10 min,滴加1%牛血清白蛋白封闭液封闭1 h;加FTO(1 ∶100)和TSG-6(1 ∶100)抗体放在湿盒里,放置4 ℃过夜;将细胞与Alexa Fluor 555标记驴抗兔(1 ∶500)和Alexa Fluor 488标记山羊抗小鼠(1 ∶500)在室温下避光孵育1 h。防淬灭封片剂与DAPI 1 ∶500稀释封片,-20 ℃冰箱保存,荧光显微镜拍片。使用Image J软件分析平均荧光强度。
1.3.2生物素标记TSG-6 RNA pulldown实验
1.3.2.1TSG-6 RNA生物素标记 将TSG-6 cDNA构建到pSPT19载体上;将含有pSPT19-TSG6的质粒经XbaI内切酶作用后作为TSG-6正义链,将含有pSPT19-TSG6的质粒经EcoRI内切酶作用后作为TSG-6反义链 ,然后去除未整合的核苷酸;在RNA聚合反应中加入2 μl生物素RNA标记物以形成TSG-6 RNA生物素标记,最后获得的TSG-6 RNA用RNeasy迷你包纯化。
1.3.2.2组织蛋白样品制备 取适量组织加入1 ml RIPA裂解液和10 μl蛋白酶抑制剂,制备组织蛋白样品。
1.3.2.3生物素RNA预处理 取3 μg标记的RNA至PCR管,PCR仪加热90 ℃、2 min,然后置冰上2 min,最后加4 μl RNA凝胶加样缓冲液(5×)室温静置20 min。
1.3.2.4RNA pulldown 取1 mg蛋白液及预处理的生物素RNA加入EP管,4 ℃下摇床作用1 h;取30 μl链霉亲和素磁珠混悬液放入经DEPC处理过的新EP管中并置于磁力架上,用RIPA裂解液洗涤2次。将RNA-蛋白混合液加入有磁珠的EP管中,室温孵育1 h;使用磁力架吸附磁珠,洗涤磁珠3次,去除非特异结合蛋白。样品用10%胶进行SDS-PAGE电泳,随后进行转膜,使用m6A抗体进行Western blot检测。使用Image J软件分析灰度值。
1.3.3qPCR检测瘢痕疙瘩及正常皮肤组织中去甲基化酶和甲基化酶mRNA表达水平 分别收集人瘢痕疙瘩组织与正常皮肤组织,提取其总RNA,逆转录得cDNA;引物根据GenBank中FTO、ALKBH5、MEITTL3、METTL14、WTAP基因序列设计(表1),反应参数设置为:PCR扩增为95 ℃、10 min;95 ℃、15 s,60 ℃、45 s,40个循环。熔解曲线:95 ℃、15 s,60 ℃、1 min,95 ℃、15 s,60 ℃、15 s。数据采用仪器自带软件ABI Prism 7300 SDS Software进行分析。
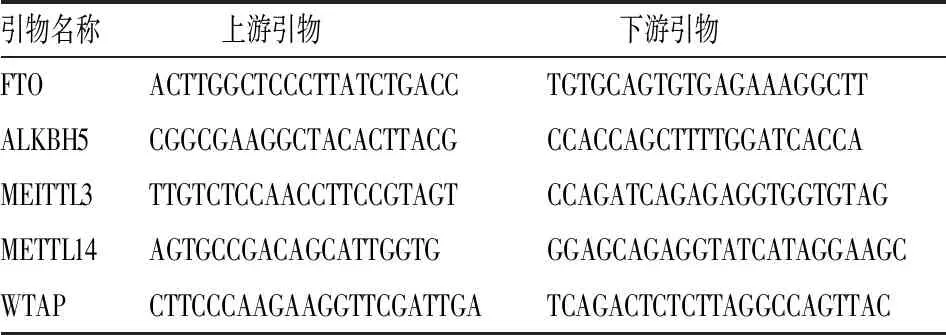
表1 RT-PCR 基因序列设计(5′-3′)
1.3.4Western blot法检测瘢痕疙瘩及正常皮肤组织中去甲基化酶和甲基化酶蛋白表达水平 分别收集人瘢痕疙瘩组织与正常皮肤组织,裂解提取总蛋白,以BCA法蛋白定量。制备好的蛋白样品用12%的胶进行SDS-PAGE电泳后,转移至硝酸纤维素膜。5%脱脂奶粉37 ℃封闭1 h,按METTL3 1 ∶1 000、FTO 1 ∶1 000、β-actin 1 ∶1 000稀释抗体,4 ℃孵育过夜;TBST洗膜后加入1 ∶10 000稀释的羊抗兔二抗室温孵育1 h,TBST洗膜后与化学发光底物孵育5 min,曝光、显影、定影。用β-actin作内参验证蛋白含量。使用Image J软件分析灰度值。
1.4 统计学处理采用SPSS 20.0软件对统计数据进行分析,样本间差异比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞免疫荧光染色结果对TSG-6和FTO进行免疫荧光染色,结果显示,与对照组相比,实验组TSG-6(红色)染色强度较低,而FTO(绿色)染色强度较高;比较平均荧光强度,实验组TSG-6的表达水平低于对照组(t=6.360,P=0.003 1),而FTO的表达水平高于对照组(t=9.979,P=0.000 6),差异有统计学意义。见图1。
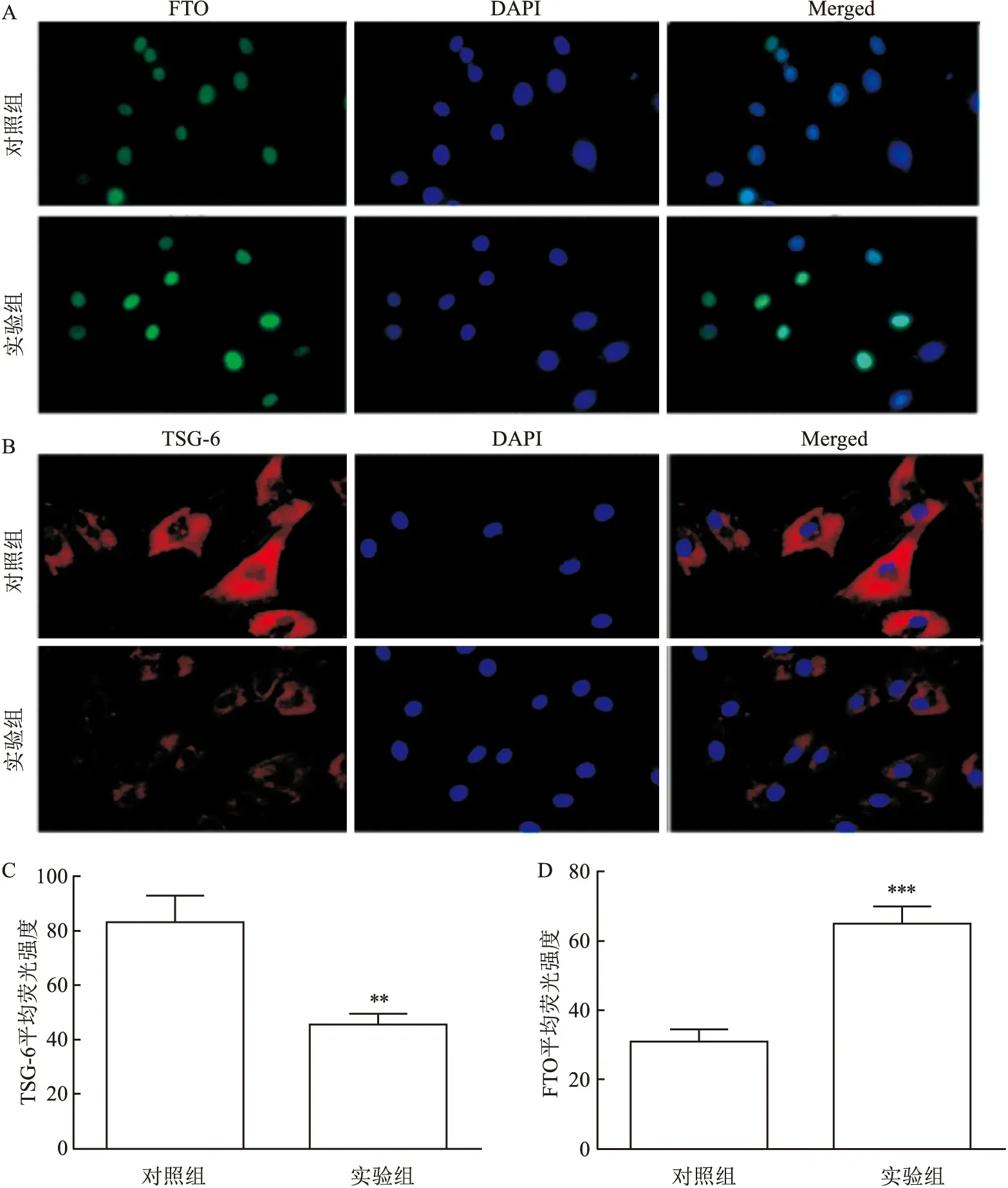
图1 免疫荧光实验检测TSG-6和FTO的表达A:FTO荧光染色 ×400;B:TSG-6荧光染色 ×400;C:TSG-6平均荧光强度;D:FTO平均荧光强度;与对照组比较:**P<0.01,***P<0.001
2.2 TSG-6 mRNA的m6A修饰水平检测结果对RNA pulldown试验得到的蛋白进行Western blot检测,将从组织直接提取的蛋白样品作为阳性对照,用TSG-6正义链探针pulldown得到的结果作为阴性对照;用TSG-6反义链探针pulldown得到的蛋白检测结果为阳性,并对得到的样本蛋白进行RNA酶处理,降解mRNA得到目标蛋白;用m6A抗体对各组样本进行Western blot检测,通过读取条带灰度值分析相对表达水平,实验组TSG-6 mRNA的m6A甲基化水平低于对照组(t=8.101,P=0.001 3),差异有统计学意义。见图2。
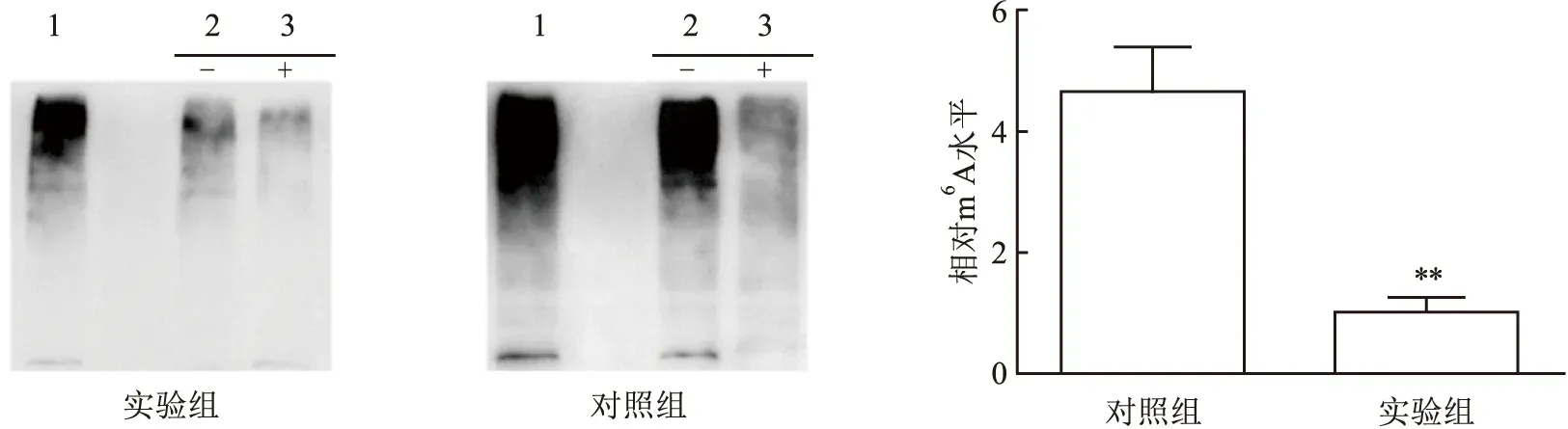
图2 Western blot实验检测TSG-6 mRNA中m6A的表达1:阳性对照;2:阴性对照;3:TSG-6反义链探针pulldown得到的m6A蛋白;-:未加RNA酶;+:添加RNA酶;与对照组比较:**P<0.01
2.3 qPCR及Western blot法检测瘢痕疙瘩及正常皮肤组织中甲基化酶和去甲基化酶结果qPCR检测实验组和对照组中m6A RNA的甲基化酶(METTL3、METTL14、WTAP)、去甲基化酶(FTO、ALKBH5)和甲基化结合蛋白(YTHDF1、YTHDF2)的表达水平,结果显示,实验组中FTO mRNA表达水平高于对照组(t=19.32,P=0.002 7),差异有统计学意义(图3);Western blot检测结果显示,实验组中FTO蛋白表达水平高于对照组(t=10.90,P=0.000 4),差异有统计学意义;而METTL3蛋白表达水平较对照组的差异不明显(t=0.069,P=0.948 3),差异无统计学意义(图4)。
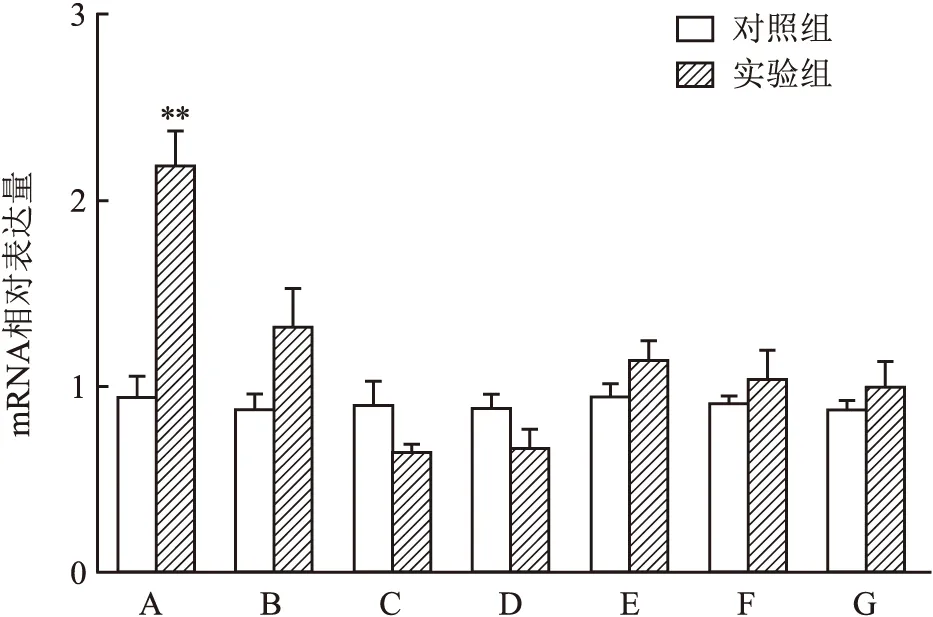
图3 qPCR实验检测RNA m6A相关酶的表达A:FTO;B:METT14;C:WTAP;D:METTL3;E:ALKBH5;F:YTHDF1;G:YTHDF2;与对照组比较:**P<0.01
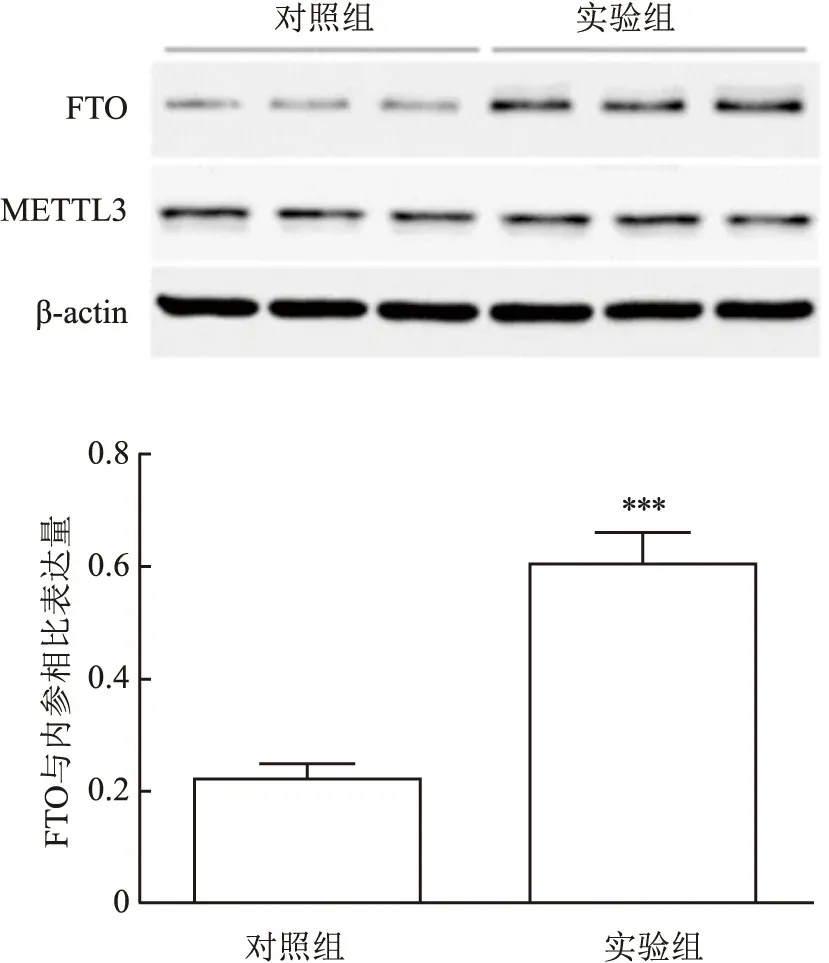
图4 Western blot实验检测FTO和METTL3的表达与对照组比较:***P<0.001
3 讨论
瘢痕疙瘩是由于皮肤外伤等原因造成的良性纤维过度增生性疾病,瘢痕疙瘩不仅影响美容,且会导致一系列并发症,包括疼痛、瘙痒、触觉异常、功能障碍等。有文献[7]报道,相关肿瘤靶向治疗方法在瘢痕疙瘩的治疗中已取得不错的效果,如热休克蛋白90等。瘢痕疙瘩发病机制与良性肿瘤发病机制具有相似之处,因此,借鉴肿瘤浸润性生长分子生物学、遗传生物学和细胞生物学的特性,探讨并揭示瘢痕疙瘩浸润性生长的机制,可为瘢痕疙瘩的临床治疗提供新的思路和方向。
TSG-6基因位于人染色体2q23.3,其编码蛋白由277个氨基酸组成,可以减轻炎性反应,降低炎症对机体的损伤[8]。2011年Tan et al[9]首次证明瘢痕疙瘩组织中的TSG-6表达水平低于无瘢痕修复皮肤组织。Li et al[10]研究表明TSG-6可导致p21、cyclinD1、NF-κB、Bcl-2、Bax、caspase-3等相关基因表达的改变,抑制TGF-β/smad等炎症反应相关信号通路,促进Fas/FasL凋亡通路,进一步说明TSG-6对瘢痕疙瘩的形成具有抑制作用。m6A RNA甲基化是真核生物mRNA中最丰富的表观遗传修饰,可以影响RNA代谢,如mRNA的稳定性和剪接、翻译效率以及微小RNA加工等,在多种肿瘤发生发展中起着调节作用[11-13]。目前有研究[14]报道提出m6A RNA甲基化会影响胚胎时期皮肤的发生发展,在皮肤形态发生过程中,通过METTL3使得mRNA甲基化影响胚胎皮肤形态的选择,同时有报道揭示了METTL3在皮肤鳞状细胞癌样本中的表达上调[15]。但是目前尚未见m6A在瘢痕疙瘩中的作用及其机制研究。
本研究首先对实验组和对照组中TSG-6的表达进行检测,结果表明实验组中的TSG-6蛋白表达水平低于对照组;进一步对实验组和对照组中的TSG-6 mRNA甲基化水平进行检测,结果表明实验组中TSG-6 mRNA的m6A修饰水平低于对照组;这一结果证实了m6A RNA甲基化参与TSG-6的表达,影响了瘢痕疙瘩的发生发展。而m6A RNA甲基化过程可由去甲基化酶和甲基化酶调控,本研究在实验组和对照组中进行相关酶的检测,结果表明在实验组中FTO mRNA表达水平和FTO蛋白表达水平均高于对照组;细胞免疫荧光亦提示实验组中的FTO蛋白表达水平高于对照组;上述实验结果表明,在瘢痕疙瘩组织中,由于FTO的表达水平升高引起TSG-6 mRNA的m6A去甲基化水平升高,导致TSG-6表达水平下降,进而削弱了对瘢痕疙瘩的抑制作用。

