表面活性剂协同超声提取杠板归中 总黄酮及抗氧化活性研究
刘佳豪,李 磊,彭 林
(邵阳学院 食品与化学工程学院,湖南邵阳 422000)
杠板归又名贯叶蓼、蛇倒退等,属于蓼科蓼属(Polygonaceae)植物。杠板归不仅能被加工成可口的菜肴,还是饲养牲畜的优质植物,是一种集食、饲于一身的植物。经研究发现,杠板归中的黄酮能清除自由基,具有一定的抗氧化活性,因此杠板归可作为天然抗氧化剂的来源应用于食品等方面,如从杠板归中提取出的黄酮搭配维生素C、维生素E组成抗氧化活性更高的物质[1-2]。杠板归在我国产量大、生长范围广,但没有被大量开发利用,所以需要加强对杠板归的研究,扩大杠板归的应用范围,优化产业结构。目前,杠板归中总黄酮的提取方法有纤维素酶解法、乙醇回流提取法、超声提取法和微波提取法等,还没有利用表面活性剂或离子液体辅助超声提取法相结合的有关研究[3-5]。表面活性剂超声波协同辅助提取杠板归中的黄酮类物质,能更大程度上使黄酮类物质析出,提高提取效率。经过单因素试验,对表面活性剂辅助超声提取杠板归中总黄酮类化合物的条件筛选,得到最佳提取条件,并探究杠板归黄酮提取物体外抗氧化活性,为杠板归在食品抗氧化剂中的应用提供理论 依据。
1 材料与方法
1.1 材料与试剂
杠板归,湖南省邵阳市本地采摘;芦丁标准品;无水乙醇、硝酸铝、亚硝酸钠、氢氧化钠、十二烷基硫酸钠、十二烷基硫酸铵、十二烷基苯磺酸钠、十六烷基三甲基氯化铵、十八烷基三甲基氯化铵、聚乙二醇600、维生素C和1,1-二甲基-2-三硝基苯肼,均为分析纯。
1.2 仪器与设备
DZ-2BC型真空干燥箱,天津市泰斯特仪器有限公司;SB-4200型超声波清洗器,宁波新芝生物科技股份有限公司;UV-2600型紫外可见分光光度计,日本岛津仪器有限公司;FW400A型高速万能粉碎机,北京科伟永兴仪器有限公司。
1.3 方法
1.3.1 杠板归样品预处理
取适量杠板归,晒干、粉碎,过80目筛,真空干燥后放入密封袋中保存备用。
1.3.2 溶液的制备
①芦丁标准溶液。精密称取干燥后的芦丁对照品10 mg置于烧杯中,以70%乙醇溶解并定容至 50 mL容量瓶,摇匀,得质量浓度为0.2 mg/mL的芦丁标准溶液。②亚硝酸钠溶液。称取2.50 g NaNO2固体,定容至50 mL容量瓶,制得5%的亚硝酸钠溶液。③硝酸铝溶液。称取5.00 g Al(NO3)3固体,定容至50 mL容量瓶,制得10%的硝酸铝溶液。④氢氧化钠溶液。称取2.00 g NaOH固体,定容至50 mL容量瓶,制得4%的氢氧化钠溶液。
1.3.3 芦丁标准曲线的绘制
精确吸取0 mL、0.25 mL、0.50 mL、1.00 mL、 1.50 mL、2.00 mL、2.50 mL和3.00 mL放入10 mL容量瓶中,加5%的亚硝酸钠溶液0.3 mL,静置6 min; 加入10%的硝酸铝溶液0.3 mL,静置6 min;再加4%的氢氧化钠溶液2.0 mL,最后以70%的乙醇溶液定容至10 mL刻度线摇匀,静置15 min[6-7]。
以试剂空白作为参比,在波长为510 nm处测定不同浓度芦丁标准溶液的吸光度,以芦丁标准液的浓度作为横坐标,相应的吸光度值为纵坐标,绘制芦丁标准曲线。
1.4 单因素试验
1.4.1 表面活性剂种类对提取率的影响
称取7份5.000 g杠板归置于7个锥形瓶中,分别加入质量分数为1%(0.050 0 g)的表面活性剂。表面活性剂种类为十二烷基硫酸钠、十二烷基硫酸铵、十二烷基苯磺酸钠、十六烷基三甲基氯化铵、十八烷基三甲基氯化铵、聚乙二醇600以及空白组。用70%乙醇溶液定容,料液比为1∶20(g∶mL),40 ℃下超声提取60 min,抽滤得杠板归黄酮提取液。将提取液定容至100 mL,取5.0 mL杠板归黄酮提取液置于10 mL容量瓶中,按照1.3.3的操作步骤测吸光度,计算出总黄酮得率。
1.4.2 表面活性剂用量对提取率的影响
称取8份5.000 g杠板归置于8个锥形瓶中,分 别 加 入0.025 0 g(0.5%)、0.050 0 g(1.0%)、 0.075 0 g(1.5%)、0.100 0 g(2.0%)、0.125 0 g(2.5%)、0.150 0 g(3.0%)、0.175 0 g(3.5%)和0.200 0 g(4.0%)十八烷基三甲基氯化铵,用70%乙醇溶液定容,料液比为1∶20(g∶mL),40 ℃下超声提取60 min, 抽滤得杠板归黄酮提取液。将提取液定容至100 mL, 取5.0 mL杠板归黄酮提取液置于10 mL容量瓶中,按照1.3.3的操作步骤测吸光度,计算出总黄酮得率。
1.4.3 乙醇浓度对提取率的影响
称取6份5.000 g杠板归置于6个锥形瓶中,加入质量分数为3%的十八烷基三甲基氯化铵,锥形瓶中分别加入浓度不同的乙醇溶液,乙醇浓度分别为50%、60%、70%、80%、90%和100%,料液比为1∶20(g∶mL),40 ℃下超声提取60 min,抽滤得杠板归黄酮提取液。将提取液定容至100 mL, 取5.0 mL杠板归黄酮提取液置于10 mL容量瓶中,按照1.3.3的操作步骤测吸光度,计算出总黄酮 得率。
1.4.4 超声时间对提取率的影响
精确称取7份5.000 g杠板归置于7个锥形瓶中,分别加入质量分数为3%的十八烷基三甲基氯化铵,用70%乙醇溶液定容,料液比为1∶20(g∶mL),40 ℃下超声提取。分别在30 min、40 min、50 min、60 min、70 min、80 min和90 min时取出一个锥形瓶,做好标记,超声处理后抽滤得杠板归黄酮提取液。将提取液定容至100 mL,取5.0 mL杠板归黄酮提取液置于10 mL容量瓶中,按照1.3.3的操作步骤测吸光度,计算出总黄酮得率。
1.4.5 超声温度对提取率的影响
精确称取6份5.000 g杠板归置于6个锥形瓶中,分别加入质量分数为3%十八烷基三甲基氯化铵,用70%乙醇溶液定容,料液比为1∶20(g∶mL),分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃和70 ℃下超声提取70 min,抽滤得杠板归黄酮提取液。将提取液定容至100 mL,取5.0 mL杠板归黄酮提取液置于10 mL容量瓶中,按照1.3.3的操作步骤测吸光度,计算出总黄酮得率。
1.4.6 料液比对提取率的影响
精确称取4份5.000 g杠板归置于4个锥形瓶中,分别加入质量分数为3%十八烷基三甲基氯化铵,用70%乙醇溶液定容,60 ℃下超声提取70 min,考察料液比分别为1∶10(g∶mL)、1∶20(g∶mL)、1∶30(g∶mL)和1∶40(g∶mL)时对杠板归中总黄酮提取率的影响。超声处理后抽滤得杠板归黄酮提取液。将提取液定容至100 mL,取5.0 mL杠板归黄酮提取液置于10 mL容量瓶中,按照1.3.3的操作步骤测吸光度,计算出总黄酮得率。
1.4.7 总黄酮提取率计算
黄酮提取率计算如公式如下:

式中:ρ为由标准曲线方程的提取液所计算得到的样品黄酮质量浓度,g/L;V0为黄酮提取液的定容体积,L;V1为显色反应中提取液样品的定容体积,L;V2为所称量的提取液样品的体积,L;m为所称取的质量,g。
1.5 杠板归中黄酮类化合物的抗氧化能力测定
1.5.1 样品制备
精确称取5.000 g杠板归粉末置于锥形瓶中,加入质量分数为3%十八烷基三甲基氯化铵,在乙醇浓度为70%,料液比为1∶30,60 ℃下超声提取70 min, 超声处理后趁热抽滤得杠板归黄酮提取液,药渣用70%的乙醇溶液冲洗3遍,抽滤、合并收集杠板归黄酮提取液,旋转蒸发仪旋干溶液,得到提取浸膏,待用。
1.5.2 DPPH自由基清除
精密称取避光冷藏的1,1-二甲基-2-三硝基苯肼(DPPH)自由基粉末0.005 0 g,加入无水乙醇溶解,倒入100 mL容量瓶中,用无水乙醇定容,制得 0.05 mg/L DPPH自由基溶液,避光保存,备用。
取杠板归黄酮提取浸膏,用无水乙醇配制浓度分别为0.4 mg/mL、0.8 mg/mL、1.2 mg/mL、1.6 mg/mL和 2.0 mg/mL的样品作为杠板归黄酮提取液,贴好标签。此外在贴有标签的试管中分别加入2 mL上述杠板归黄酮提取液和2 mL 0.05 mg/L的DPPH自由基溶液,将试管放置于自制的避光纸盒中,轻微摇晃使其混合均匀,室温条件下放置30 min,于517 nm处测得吸光度(A1);同样的方法制备样品对照组,其中采用无水乙醇替代DPPH溶液,贴好标签(A2);空白组也是一样,无水乙醇替代杠板归黄酮提取液,贴好标签(A0)。然后根据顺序,依次测量各管吸光度值。维生素C为阳性对照。每个测试管做3组平行,结果取平均值。样品对DPPH自由基清除率的计算公式如下:

式中:A0为2 mL无水乙醇+2 mL DPPH自由基溶液的吸光度值;A1为2 mL杠板归黄酮提取液 +2 mL DPPH自由基溶液的吸光度值;A2为2 mL杠板归黄酮提取液+2 mL无水乙醇的吸光度值。
2 结果与分析
2.1 芦丁标准曲线
芦丁标准曲线的线性回归方程为Y=3.774 8X-0.000 7(Y为吸光度,X为浓度,单位为mg/mL),R=0.994 8>0.99。
2.2 单因素试验结果分析
2.2.1 表面活性剂对提取率的影响
由图1可知,在其他条件相同的情况下,加入表面活性剂组比不加表面活性剂的空白组的总黄酮提取率高,说明表面活性剂协同超声提取杠板归中总黄酮的效果明显,其中十八烷基三甲基氯化铵的提取效果最好,总黄酮提取率为5.95%。因此,在后续采用十八烷基三甲基氯化铵协同超声提取杠板归中总黄酮。

图1 表面活性剂种类对提取率的影响
2.2.2 表面活性剂用量对提取率的影响
由图2可知,开始时杠板归中总黄酮的提取率随着十八烷基三甲基氯化铵的质量分数增加而增大,当十八烷基三甲基氯化铵质量分数为3.00%时,提取率达到最大值6.16%,随后再增加十八烷基三甲基氯化铵的用量,提取率反而降低。这是由于随着十八烷基三甲基氯化铵用量的增加,溶液中形成的胶束数目增多,对杠板归中黄酮的增溶作用变强,当达到临界胶束浓度后,对黄酮的增溶能力变化不大,反而对其他杂质有了一定的增溶作用,从而导致黄酮的得率下降。因此,十八烷基三甲基氯化铵的最佳提取质量分数为3.00%。
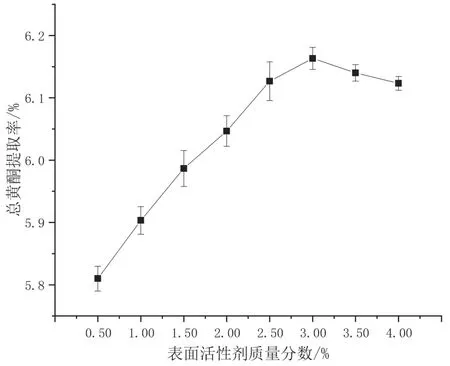
图2 十八烷基三甲基氯化铵的用量对提取率的影响
2.2.3 乙醇浓度对提取率的影响
由图3可知,随着乙醇浓度的增大,杠板归中总黄酮的提取率也相对提高,这是因为杠板归中的黄酮类化合物在乙醇中的溶解度大于在水中的溶解度,乙醇浓度的增加能够促进黄酮类化合物的析出。当乙醇浓度达到70%时,提取率达到最大值6.15%,之后再增加乙醇浓度,提取率反而下降,这可能是由于高浓度的乙醇使得杠板归中醇溶性杂质的溶出率增加,反而抑制杠板归中总黄酮的提取。因此选择最佳提取乙醇浓度为70%。
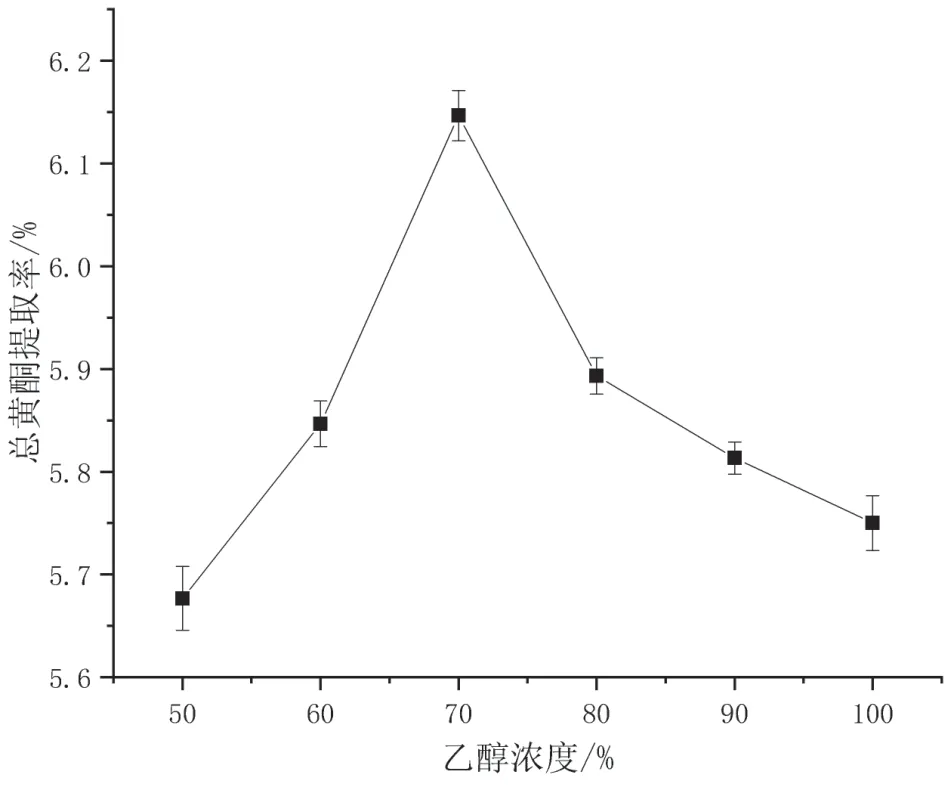
图3 乙醇浓度对提取率的影响
2.2.4 超声时间对提取率的影响
由图4可知,随着超声提取时间的延长,杠板归中总黄酮的提取率也在增加,当时间达到70 min时,杠板归中总黄酮的提取率达到最大值6.24%。随后继续增加超声时长,总黄酮提取率反而下降,可能是由于长时间的超声导致醇溶性杂质的溶出率增加,反而抑制杠板归中总黄酮的提取。因此,选定最佳超声时长为70 min。

图4 超声时间对提取率的影响
2.2.5 超声温度对提取率的影响
由图5可知,随着温度的升高,总黄酮提取率也在增加,当温度升至60 ℃后,提取率达到最大值6.34%,温度超过60 ℃后,总黄酮提取率反而降低。说明当温度超过某一临界值时,会阻碍表面活性剂与杠板归的结合,导致提取效率降低。因此,设定杠板归中总黄酮的最佳提取温度为60 ℃。

图5 超声温度对提取率的影响
2.2.6 料液比对提取率的影响
由图6可知,随着料液比的增大,杠板归中总黄酮提取率呈先增加后降低的趋势,当料液比为1∶30时总黄酮的提取率达到最大值6.43%。料液比的增加会增加杠板归与提取液之间的黄酮浓度差,使得提取率增大,随后再增加料液比,其他杂质也被析出,从而降低黄酮提取率。因此,料液比为1∶30时最佳。

图6 料液比对提取率的影响
2.3 杠板归中黄酮类化合物的抗氧化能力测定
由图7可知,随着提取物和维生素C浓度的增加,DPPH自由基清除率也逐渐升高,表明两种物质都具有清除DPPH自由基的能力,并且与浓度相关,随着样品浓度的增加,清除作用也不断增强,具有一定的量效相关性。当浓度达到1.0 mg/mL时,DPPH自由基清除率达到91.7%,与维生素C的清除率几乎相同,结果表明,杠板归黄酮提取物对DPPH自由基具有良好的清除能力,具有一定的抗氧化 能力。

图7 杠板归黄酮提取物对DPPH自由基清除能力图
3 结论
表面活性剂协同超声提取杠板归中总黄酮产生了明显的效果,其中增效最明显的是十八烷基三甲基氯化铵。通过单因素试验,得到表面活性剂协同超声波提取杠板归中总黄酮的最优条件为十八烷基三甲基氯化铵质量分数为3.00%,乙醇浓度为70%,料液比为1∶30,60 ℃下超声提取70 min,在此条件下,杠板归中总黄酮提取率为6.43%。与单纯的超声提取法相比,表面活性剂协同超声提取杠板归中总黄酮,明显提高了目标产物的得率,降低了生产成本,具有良好的应用前景。
通过杠板归总黄酮体外抗氧化验证,确定了杠板归中总黄酮的抗氧化能力特征。在DPPH自由基清除中,杠板归总黄酮提取物在浓度为1.0 mg/mL时,DPPH自由基清除率达到91.7%,与维生素C的清除率几乎相同。同时发现杠板归黄酮提取物对DPPH自由基具备一定的清除能力,其清除能力主要依赖于自身的质量浓度,随着样品浓度的增大,清除作用也不断增强,具有一定的量效相关性。对杠板归黄酮抗氧化性的研究,有助于扩大杠板归的用途范围,优化产业结构,为以后的研究提供参考数据。

