鼠巨细胞病毒感染C57BL/6小鼠急性肝炎动物模型的建立与鉴定
阮宇菲,刘琦,吴博,许智勇,陈珂,蒋敏之,张俊玲,余金生,陈益平
1.温州医科大学附属第二医院育英儿童医院 儿童感染科,浙江 温州 325027;2.安徽医科大学 基础医学院,安徽 合肥 230000
巨细胞病毒(cytomegalovirus, CMV)是一种在自然界中广泛存在的人致病的疱疹病毒,是疱疹病毒亚科家族中的一员。在我国一般人群CMV抗体阳性率为86%~96%,育龄期女性达90%以上[1],婴幼儿期为60%~80%,CMV初次感染一般发生于儿童时期甚至胎儿期,肝脏是其主要的靶器官之一[2]。临床上患CMV感染的婴幼儿,绝大多数都有肝脏受累的表现,从亚临床感染到出现血清转氨酶的升高,肝脾肿大、黄疸及胆汁淤积等严重表现[3-4],此外CMV感染是实体器官移植或骨髓移植后最常见的机会性感染之一,且治疗难度大[5-8]。目前CMV的致病机制仍不明确。研究表明,鼠巨细胞病毒(murine cytomegalovirus, MCMV)感染的小鼠模型能够模拟除先天性CMV感染以外的多种临床疾病[9],如眼部疾病[10-11]、呼吸系统疾病[12-13]及肿瘤[14]等。但对于肝炎的研究较少见,因此,本研究通过建立MCMV感染小鼠急性肝炎模型,为进一步深入研究HCMV感染所致的肝炎的致病机制、疫苗研制以及探索新型更有效的生物学治疗手段提供科学的理论依据。
1 材料和方法
1.1 材料
1.1.1 实验动物及实验室要求:无特定病原体(specific pathogen free, SPF)级C57BL/6小鼠, 4~6周龄,雄性,体质量16~20 g,购自安徽医科大学实验动物中心[许可证号:SCXK(皖)2017-001],本研究获安徽医科大学实验动物伦理委员会的批准,并按照美国国立卫生研究院《实验动物护理和使用指南》进行。CMV属于生物安全等级2级(biosafety level-2, BSL-2)[15],本研究在安徽医科大学具有P2等级标准的实验室开展。
1.1.2 病毒和细胞株:MCMV Smiths株由安徽医科大学临床病毒学研究所赠予,在原代小鼠胚胎成纤维细胞(mouse embryonic fibroblast, MEF)上进行传代增殖培养。根据BRIZI等[16]的研究,取孕14 d的BALB/c小鼠胚胎自行制备原代MEF细胞,按常规条件培养,实验用细胞为2~5代培养物。实验结束后所有耗材经煮沸、高压灭菌后按医疗垃圾处理。
1.1.3 抗体及引物序列:Mouse Anti M112-113/E1 (MCMV)mAb,CROMA103 Kappa IgG,1 mg/mL,由安徽医科大学临床病毒研究所赠予,按1∶500稀释,MCMV早期蛋白1(E1)由MCMV M112-113基因区编码,主要定位于MCMV感染细胞的细胞核。引物序列见 表1。

表1 引物序列
1.1.4 其他试剂:细胞培养用DMEM培养基、胎牛血清、胰蛋白酶均购自美国Gibco公司;RNA提取试剂盒MiniBEST Viral RNA/DNA Extraction Kit、反转录试剂盒PrimeScript RT reagent Kit(Perfect Real Time)、Premix Taq、实时荧光定量PCR试剂TB Green Premix Ex Taq II,均购自日本TaKaRa公司;甲基纤维素购自北京索莱宝公司。
1.2 MCMV感染小鼠急性肝炎模型建立
1.2.1 MCMV扩增及滴度检测:将MCMV接种于原代MEF上进行传代培养及扩增,致细胞病变效应(cytopathic effect, CPE)达90%时收获病毒,并制备MCMV Stocks冻存于-80 ℃备用。使用空斑形成实验检测病毒滴度,将MEF按2×105/孔接种至6孔板中,于37 ℃、5% CO2细胞培养箱中培养24 h,至细胞单层长满后,将10倍系列稀释的10-6~10-2病毒悬液接种至MEF单层上,200 μL/孔,于37 ℃、5% CO2细胞培养箱中吸附1 h后弃去病毒悬液,按3 mL/孔加入甲基纤维素培养液,于37 ℃,5% CO2细胞培养箱中继续培养,每日镜下观察空斑形成情况,第7天终止,弃去孔板中甲基纤维素培养液,使用含甲醛的结晶紫染色液染色3 min,流水冲洗,进行空斑计数,按公式计算空斑形成单位(plaque forming unit,PFU/mL)=平均空斑数×稀释倍数/接种病毒悬液(mL)。
1.2.2 实验动物分组及病毒接种:实验小鼠适应性饲养5 d后,将其随机分为阴性对照组及病毒感染组(每组n=12)。阴性对照组经腹腔注射200 μL的MEF悬液,病毒感染组小鼠经腹腔注射1.0×106PFU (200 μL)MCMV悬液,观察1周内小鼠变化。
1.3 MCMV感染小鼠急性肝炎模型鉴定
1.3.1 肝组织内病毒分离:在感染后第3天和第7天随机抽取6只小鼠,无菌条件下采集小鼠肝脏。取约100 mg的肝组织于无菌条件下进行研磨,加1 mL DMEM制备组织匀浆,转移至无菌EP管内,3 000 r/min 离心15 min,取上清液,经0.22 μm过滤器过滤后,取500 μL组织匀浆接种于MEF细胞上,置于37 ℃、 5% CO2细胞培养箱中吸附1 h后弃去组织匀浆,加入维持液继续培养7 d,每日观察是否出现CPE现象,以明确病毒分离是否阳性。
1.3.2 免疫组织化学检测MCMV M112-113/E1蛋白:石蜡切片浸泡于二甲苯中进行脱蜡,而后用100%、90%和70%系列不同梯度乙醇水化后进行抗原修复,消除内源性过氧化物酶,室温条件下用1% BSA封闭1 h,滴加一抗Mouse Anti M112-113(MCMV)单克隆抗体,4 ℃孵育过夜,PBST清洗后滴加二抗室温孵育1 h,DAB显色,HE复染后,封片镜检。
1.3.3 RT-PCR检测小鼠肝组织内MCMV IE及M55基因片段表达情况:取20 mg肝组织根据试剂盒说明书提取总RNA,测定RNA浓度,于冰盒上配置反转录体系。25 μL总体系,上、下游引物(MCMV即刻早期基因IE及晚期基因M55引物序列见表1)各0.5 μL,cDNA 1 μL。PCR扩增反应条件:95 ℃预变性4 min; 每循环:94 ℃变性35 s,55 ℃退火35 s,72℃延伸40 s,35循环;72 ℃终延伸10 min。1.5%琼脂糖凝胶120 V电泳30 min,显影观察。
1.4 MCMV感染小鼠肝炎模型特点分析
1.4.1 血清肝功能酶学检测:麻醉后摘除小鼠眼球取外周血,于37 ℃温箱中静置1 h,2 000 r/min离心30 min,分离血清,于全自动生化分析仪中检测谷丙转氨酶(alanine aminotransferase, ALT)及谷草转氨酶(aspartate aminotransferase, AST)水平。
1.4.2 肝组织HE染色:取实验小鼠的肝中叶,经4%多聚甲醛固定后,石蜡包埋、切片,进行HE染色,镜下观察并随机选取3个非重叠视野进行病理学评分,根据临床病毒性肝炎组织病理常用评分系统之一Ishak评分系统进行定量评估[17]。
1.4.3 RT-qPCR检测实验小鼠肝组织内炎性细胞因子mRNA表达水平:RNA提取及反转录条件同上1.3.3,RT-qPCR反应为20 μL体系,上、下游引物各0.8 μL,cDNA 1 μL,反应条件:预变性95 ℃ 30 s,PCR反应95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。
1.5 统计学处理方法 使用SPSS23.0及Graphpad 8.0.2软件进行统计学分析,计量资料使用±s表示,两组间比较采用独立样本t检验,重复测量数据采用重复测量资料的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 病毒滴度检测结果 空斑形成实验结果显示,细胞对照孔细胞单层完整,染色均匀,不同稀释倍数下空斑数量呈现近似线性分布。镜下观察空斑中央MEF裂解死亡,边缘细胞肿胀变圆,空斑周边正常细胞呈长梭形仍保持正常的成纤维细胞形态(见图1)。经计算MCMV滴度为6.5×106PFU/mL。

图1 空斑形成实验检测MCMV滴度结果(结晶紫染色)
2.2 一般情况 接种病毒后,各实验组小鼠存活率均为100%,病毒感染组小鼠较阴性对照组小鼠活动减少,进食及饮水量减少,体质量下降,以病毒感染后第3和第4天下降最为显著(P<0.05),而后趋于缓慢的增长,阴性对照组小鼠一般状况良好,体质量呈稳定增长(见图2)。

图2 2组小鼠体质量变化曲线
2.3 肝组织整体外观变化及肝指数 肝脏外观对比可见,阴性对照组小鼠肝脏呈棕红色、光滑,边缘锐利,质地较软,肝指数为(4.43±0.47)%;病毒感染组小鼠感染后第3天肝脏出现充血,轻微肿胀,边缘稍圆钝,肝指数为(5.87±0.51)%,较阴性对照组明显升高(P<0.05)。感染后第7天,肝脏出现明显肿大,边缘圆钝且表面呈颗粒样改变,肝指数为(6.87±0.31)%,较阴性对照组[(5.00± 0.47)%]仍保持较高水平(P<0.05),见图3。
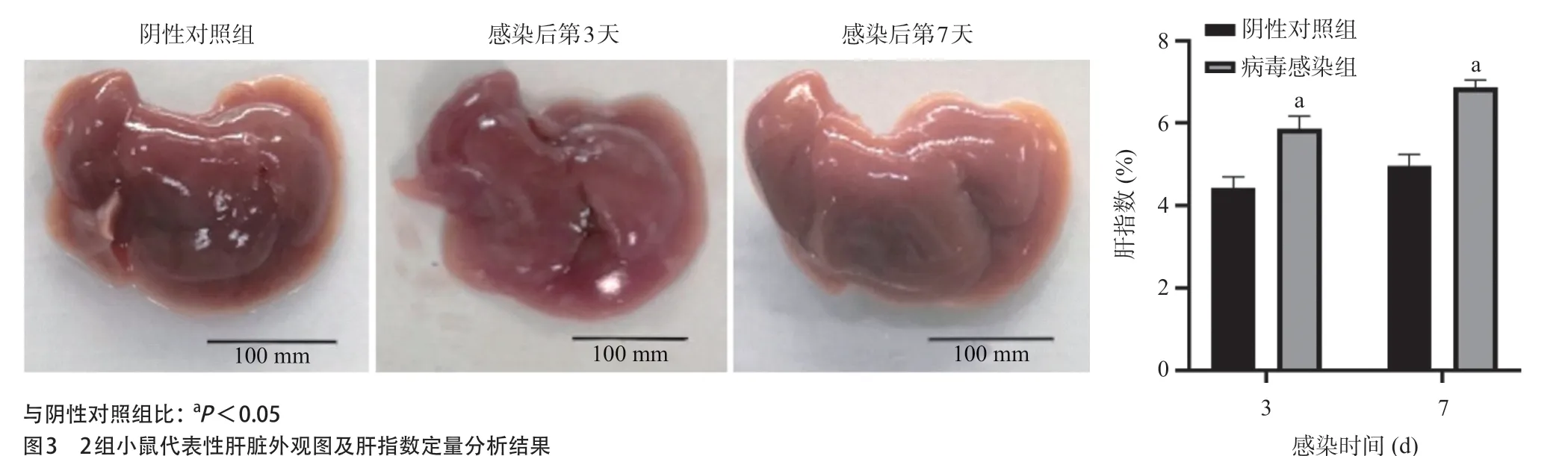
图3 2组小鼠代表性肝脏外观图及肝指数定量分析结果
2.4 血清ALT和AST检测结果 肝功能检测结果显示,根据《实验动物血液生理生化参考手册》[18],阴性对照组小鼠肝功能指标ALT[(27.0±5.0)U/L] 及AST[(126.0±16.17)U/L]均在正常参考值范围 内[ALT(23.58~49.30 U/L),AST(122.16~ 235.17 U/L)],病毒感染组于感染后第3天ALT [(103.0±28.618)U/L]及AST[(253.0± 12.530)U/L]明显升高(P<0.01),呈现急性肝损害;感染后第7天基本恢复正常,见图4。

图4 感染后第3天及第7天2组小鼠血清ALT及AST检测结果
2.5 肝组织病理结果 肝组织HE染色结果显示,阴性对照组小鼠肝组织结构正常,肝细胞完整,围绕中央静脉大致呈放射状排列。病毒感染组感染后第3天肝组织HE染色结果可见肝细胞呈气球样变,肝细胞排列紊乱,出现局灶性的炎性细胞浸润及肝细胞点灶状坏死,汇管区出现淋巴细胞浸润,以感染后的第3天最为显著,该现象持续至感染后第7天。感染后第3天及第7天病毒感染组Ishak评分分别为(6.22±1.39)和(3.67±0.71),较阴性对照组(1.33±0.71)和(1.10±0.45)明显升高,差异有统计学意义(P<0.01),出现明显的急性病毒性肝炎病理改变,见图5。

图5 感染后第3天和第7天2组小鼠肝组织HE染色结果及定量分析结果
2.6 肝组织病毒分离结果 病毒检测结果显示,阴性对照组小鼠肝组织病毒分离阴性;感染后第3天及第7天病毒感染组小鼠肝组织病毒分离培养物于接种后96 h,细胞首先出现局灶性肿胀变圆、细胞内颗粒增多、折光性增强等现象,继而病变区域及病变部位变大变多,最终出现细胞聚集后脱落,表现出明显CPE,病毒分离结果阳性(见图6A)。病毒分离培养物经测序,测序峰图未见套峰、杂峰,经Genbank比对匹配度达95%以上,明确为MCMV(见图6B)。

图6 肝组织病毒分离培养及测序结果
2.7 实验小鼠肝组织免疫组织化学染色结果 通过免疫组化检测小鼠肝组织内MCMV特异的M112-113/E1蛋白,可见感染后第3天和第7天病毒感染组小鼠肝组织MCMV M112-113/E1蛋白阳性的信号散在分布,主要出现在细胞核,见图7。
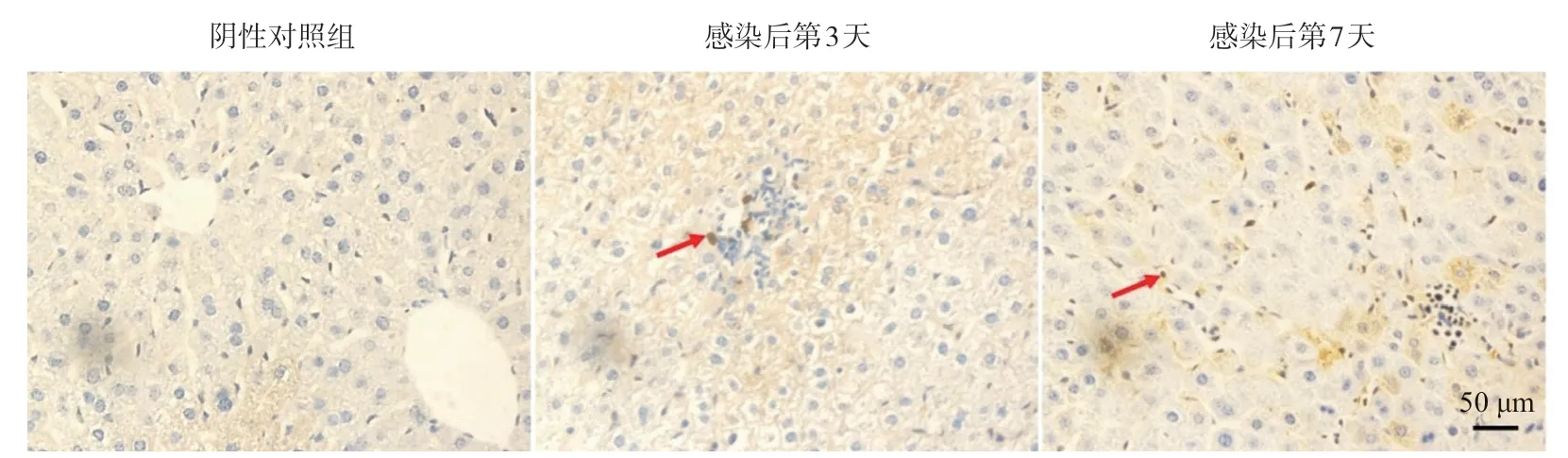
图7 感染后第3天和第7天病毒感染组小鼠肝脏免疫组织化学结果
2.8 病毒感染组小鼠肝组织内MCMV IE1及M55基因片段检测结果 RT-PCR实验结果发现,病毒感染后第3天病毒感染组小鼠肝组织内MCMV IE基因及M55基因片段检测结果均为阳性,证明病毒感染组小鼠肝组织内病毒处于活动性感染阶段。感染后第7天实验小鼠肝组织MCMV IE基因检测仍阳性,M55基因检测阴性,仍存在MCMV感染。见图8。

图8 病毒感染组小鼠肝组织内MCMV IE及M55基因DNA片段检测结果
2.9 实验小鼠肝组织炎性细胞因子检测结果 通过qRT-PCR检测实验小鼠肝组织内炎性细胞因子mRNA的表达水平,发现病毒感染后,IL-1β于感染后第7天较阴性对照组显著上升(P<0.01);TNF-α于感染后第3天较阴性对照组明显上升,并在感染后第7天上升更为显著(P<0.01);IL-6同样在病毒感染后的第3天出现显著上升(P<0.01),而后第7天出现下降(P<0.05),表明MCMV感染肝炎情况下炎性细胞因子表达水平明显上调。见图9。
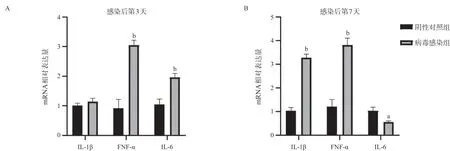
图9 实验小鼠肝组织炎性细胞因子mRNA表达水平检测结果
3 讨论
CMV属于单纯疱疹病毒β亚科[19],存在严格的种属特异性,因此对其研究存在一定的局限,而HCMV和MCMV有许多遗传上的相似之处,有多个同源基因,包括结构基因和免疫逃避基因[20]。FISHER等[9]研究表明,MCMV感染小鼠模型能够模拟除外先天性感染的多种疾病模型。既往有实验利用BALB/c小鼠建立MCMV全身感染模型,分析了全身感染时炎症及免疫应答的情况,表明BALB/c小鼠对MCMV易感,并且由于BALB/c小鼠黑色素瘤缺失基因2 (absent in melanoma, AIM2)炎性小体活化时间短,导致其感染后易呈现慢性化,肝脏直至感染后第28天仍可见炎性细胞浸润[21]。现阶段关于MCMV感染的小鼠模型仅限于野生型BALB/c小鼠,国内外关于其他品系小鼠与MCMV感染的研究鲜有报道。目前基因编辑小鼠多基于C57BL/6小鼠背景,因此有必要建立C57BL/6小鼠感染MCMV相关疾病模型。通过构建MCMV感染C57BL/6小鼠急性肝炎模型,分析其感染特点,为该模型在抗CMV药物研究中的应用奠定理论和实验基础。
本研究采用组织细胞培养的方式扩增病毒,将1.0×106PFU病毒悬液经腹腔注射感染C57BL/6小鼠。病毒感染组肝组织出现的改变及感染特点:感染后第3天肝组织RT-PCR检测结果发现MCMV IE基因与M55基因均为阳性,而第7天IE基因阳性,M55转为阴性,第3天血清ALT及AST明显升高,第7天趋于正常水平;第3天起肝组织出现充血及肿大,病理学上第3天肝组织出现明显的炎性细胞浸润、肝细胞点灶性坏死,第7天炎症缓解,但仍可见炎性细胞浸润;第3天及第7天肝组织免疫化学染色可见特性性MCMV M112-113/E1蛋白表达;肝组织匀浆病毒分离阳性,测序为MCMV。肝组织内炎性细胞因子mRNA表达水平明显升高,第3天起促炎细胞因子IL-6及TNF-α明显上调,第7天IL-1β出现显著上调。
以上研究结果表明以1.0×106PFU的病毒悬液经腹腔注射的方式感染C57BL/6小鼠急性肝炎模型以第3天最为显著,此时肝脏损害最为严重,且肝组织内病毒处于复制增殖及活动性感染状态,而后急性肝炎损害趋于好转,转氨酶水平恢复正常,HE染色结果肝细胞坏死及炎性细胞浸润情况减轻,病毒活动性感染的M55基因检测阴性,而IE基因仍为阳性,表明感染后第7天起仍存在病毒感染,但感染趋于进入潜伏感染状态。不同小鼠品系对MCMV感染的免疫效应机制不同,例如,BALB/c、BALB.B、B10.D2、B10.A和A/J品系小鼠对MCMV易感;C57BL/10对MCMV中度抵抗。既往刘志峰等[22]构建BALB/c小鼠感染MCMV模型可用于14 d内急性感染,而本研究C57BL/6小鼠感染MCMV模型7 d内有效,其机制可能为C57BL/6小鼠有高活性的自然杀伤细胞(natural killer cells, NKs),在C57BL/6小鼠中已经发现了几种基因控制的先天宿主对MCMV的抗性机制,包括Cmv1、Cmv2、Cmv3和Cmv4,其遗传位点Cmv1编码NK细胞受体Ly49H,激活NK细胞应答,从而使MCMV感染病程相对较短[16]。
综上,MCMV感染C57BL/6小鼠急性肝炎模型成功建立,可用于7 d内短期的药物研究,该模型能够为进一步研究HCMV感染肝炎的发病机制及探索新的生物学治疗方式提供基础依据。

