三种天然植物水溶物对H2O2损伤草鱼原代肝细胞的保护作用
■石瑶瑶 马 杰 王卓君, 叶元土* 蒋 蓉 孔庆伟
(1.苏州大学基础医学与生物科学学院,江苏省水产动物营养重点实验室,江苏 苏州 215123;2.无锡三智生物科技有限公司,江苏 无锡 214000;3.辽宁省农业发展服务中心,辽宁 沈阳 110033)
氧化损伤是导致鱼体损伤的主要损伤方式,其实质为体内氧化与抗氧化的动态失衡。主要表现在自由基含量增加、脂质过氧化物增加,蛋白质、DNA、脂质等大分子物质被损伤,体内抗氧化酶活性下降[1]。体内自由基产生的主要位点在线粒体,线粒体是ATP产生的能量代谢中心,通过氧化作用和氧化磷酸化作用的偶联,氢和电子在呼吸链传递过程中将化学能转移到ADP上产生ATP,在氢和电子给氧的过程中会产生过氧化氢和过氧自由基。正常情况下,线粒体产生的过氧化物、自由基等可以经体内的抗氧化系统清除,维持过氧化物、自由基产生与清除的动态平衡[2]。而一旦失衡,过氧化物、自由基含量增加,对细胞、器官组织造成氧化损伤。这时,可以通过饲料途径,在饲料中增加维生素C(VC)、维生素E(VE)和一些具有抗氧化作用、具有自由基清除作用的物质,如天然植物来增强鱼体、细胞的抗氧化能力和自由基清除能力,同时对氧化损伤的细胞进行修复。这也是水产动物营养和饲料在满足养殖水产动物营养需要为基本目标的前提下,增强饲料抗氧化功能的发展方向之一。
VC是维生素中较为理想的抗氧化剂,但在水产饲料中过量使用也会产生不良反应,需要限量添加,农业农村部第2625 号公告《关于饲料添加剂安全使用规范》中,VC在草鱼和鲤鱼配合饲料中的推荐添加量为300~500 mg/kg[3-4]。需要探索其他功能完整、在多条途径中发挥作用的抗氧化性物质促进动物健康生长。天然植物可作为实现该目标的最优选择,依据《饲料原料目录》[5],一些药、食同源的天然植物允许在饲料中使用。本课题组前期的研究发现天然植物应用在黄颡鱼和异育银鲫的养殖中具有良好的抗氧化能力,可降低肝脏通透性,维护肠道菌群稳态,减轻体内氧化应激[6-7]。
在前期研究的基础上,文章以天然植物复合物1(RAT 组)、天然植物复合物2(JLT 组)和诃子(TCR组)水溶物冻干粉以及VC作为试验材料,探讨天然植物抗氧化能力的评价方法,以草鱼原代肝脏细胞作为试验对象,探讨不同天然植物水溶物对肝细胞氧化损伤的保护作用效果及机制,从细胞层面探究天然植物修复损伤肝脏的作用机理,为研制具有抗氧化性或氧化损伤修复作用的天然植物饲料提供依据。
1 材料与方法
1.1 试验草鱼
用于原代肝细胞采集的草鱼为平均体重(50.0±2.6)g的一冬龄幼鱼,饲养于苏州大学室内养殖系统,每天投喂草鱼商品饲料(粗蛋白28%、粗脂肪7%的膨化饲料)1次,养殖系统水体温度(24.0±5.0)℃。
1.2 天然植物及其水溶物
天然植物复合物1(RAT)和天然植物复合物2(JLT)由无锡三智生物科技有限公司提供,原料组成为葛根、绞股蓝、甘草、诃子、金银花、黄芪等,是将不同的单一天然植物饮片分别进行超微粉碎后的混合品;诃子(TCR)为中药店购买的饮片粉碎后过60目筛样品。RAT 和JLT 中多酚、多糖、黄酮和皂苷活性成分含量测定结果如表1。
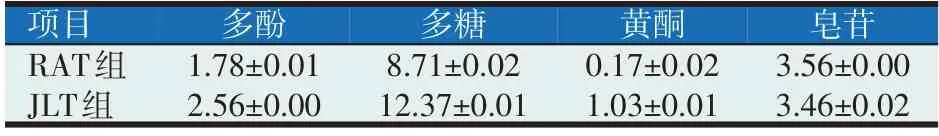
表1 RAT和JLT部分活性成分含量(%)
分别称取TCR、RAT和JLT粉末,各按料液比1∶10加双蒸水搅拌均匀,4 ℃浸泡24 h,滤膜过滤2 遍,将滤液置冷冻干燥机冻干后制成水溶物冻干粉,-80 ℃冷冻保存待用。
1.3 肝细胞的分离与培养
草鱼原代肝细胞的分离参照秦洁等[8]的试验方法并稍作调整。将草鱼消毒后取出肝脏,PBS(0.01 mol/L、pH 7.4)清洗3 遍,剪碎后按体积1∶3 的比例加入0.25%胰蛋白酶、27 ℃摇床消化15 min,1 000 r/min离心1 min,弃上清液。按1∶3 的比例加入PBS 和红细胞裂解液,1 000 r/min离心4 min弃上清液。PBS清洗细胞、800 r/min离心1 min弃上清后,加入含10%胎牛血清的M199培养基制成细胞悬液。细胞计数仪(Cyto SMART Technologies B.V.)计数后于5% CO2、27 ℃的培养箱(ESCO,新加坡)中培养,24 h换培养液。
1.4 天然植物水溶物对自由基清除率的测定
1.4.1 1,1-二苯基-2-三硝基苯肼(DPPH·)清除率
参照陈旭丹等[9]测定DPPH·的方法并稍作改进。DPPH溶于无水乙醇中,配成终浓度为8.62×10-5mol/L DPPH。称取0.128 g 待测样品(冻干粉),加入20 mL 75%乙醇,超声提取5 min,8 000 r/min 离心8 min,收集上清,得到初始浓度为6.4 g/L 的待测液母液,用无水乙醇稀释成不同浓度。操作步骤及DPPH·清除率计算公式按照陈旭丹等[9]试验的方法,可见分光光度计测量吸光值。
1.4.2 羟基自由基(·OH)清除率
参照刘茹等[10]测定方法,采用水杨酸法测定样品对·OH清除率。用纯化水将样品稀释成不同浓度,操作步骤及·OH清除率计算公式按照刘茹等[10]试验的方法。
1.5 细胞活力测定
1.5.1 天然植物水溶物试验浓度的确定
接种2.5×105个/mL细胞到96孔板中,24 h后待其覆盖培养孔底面积80%左右时,更换培养基,使培养液中RAT、JLT、TCR和VC的浓度为0.01、0.05、0.10、0.50、1.00、5.00 mg/mL,培养24 h后,每孔加入10 μL噻唑蓝(MTT)溶液,继续培养4 h后弃去旧培养液,每孔加入100 μL纯度为99.5%的二甲基亚砜,遮光振摇10 min,充分溶解甲瓒(Formazan)。用酶标仪(Gene Company Limited)检测570 nm波长下的各孔吸光度值,根据公式计算细胞活力,筛选对细胞无毒性的天然植物水溶物浓度,用于后续修复损伤细胞试验。
细胞活力(%)=处理组OD570nm/对照组OD570nm×100
1.5.2 天然植物水溶物对H2O2损伤肝细胞活力的测定
取培养24 h后处于对数生长期的细胞(细胞贴壁生长且贴壁细胞约占80%的培养孔面积),按照前期试验结果[11],用浓度为200 μmol/L 的H2O2处理细胞1 h后建立H2O2损伤模型。对照组和H2O2组换正常培养基,其余组更换浓度为0.10 mg/mL 的RAT、JLT、TCR 和VC 4 种物质的培养液培养细胞24 h,MTT 检测细胞活力,操作与计算方法同1.5.1。
1.6 细胞抗氧化酶活性的检测
接种4×106个/mL细胞到12孔板里,分组按照1.5.2处理细胞,加入0.25%胰蛋白酶200 μL 消化细胞2-3 min,加入等体积完全培养基终止消化,弃上清,收集细胞后,加入1 mL PBS,利用细胞超声破碎仪低温裂解细胞(功率30%,裂解3 min),按照南京建成生物研究所有限公司的试剂盒方法检测超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性和丙二醛(MDA)、谷胱甘肽(GSH)含量。
1.7 细胞内活性氧(ROS)水平的检测
按照1.6 中的方法收集各组细胞,按南京建成生物研究所有限公司ROS试剂盒方法加样,用流式细胞仪(Beckman Coulter,美国)进行检测。
1.8 细胞凋亡的检测
按照1.6 中的方法收集各组细胞,处理细胞按试剂盒(杭州联科生物技术有限公司)方法,Annexin VFITC和PI双染,流式细胞仪检测。CXP Analysis软件分析计算结果。
1.9 线粒体膜电位(MMP)的检测
按照1.6 收集各组细胞后,按照南京建成生物研究有限公司MMP试剂盒方法操作,流式细胞仪检测。
1.10 透射电镜观察肝细胞超微结构
细胞分组及处理同1.5.2,每个样本处理3 个复孔,用2.5%的常温戊二醛避光固定细胞5 min,细胞刮轻轻刮下细胞,用吸管把细胞吸进离心管,1 000×g离心2 min,换上新的固定液室温避光30 min,经过PBS冲洗后1%锇酸固定2 h,PBS冲洗,先用50%乙醇脱水逐渐过渡到用100%乙醇脱水,使用环氧树脂和硬化剂对样品浸透包埋,3 mm直径铜网收集、切片,柠檬酸铅和醋酸铀进行染色,于透射电镜下观察细胞超微结构,选取2 000倍镜和10 000倍镜下各10个视野,观察线粒体、细胞核、内质网、溶酶体形态数量及分布情况。
1.11 Western Blot试验
①将各处理组的细胞弃掉上清,离心后收集细胞,按1∶10 的比例加入样本和裂解液,充分裂解细胞,离心收集上清。用BCA检测试剂盒测定细胞蛋白质含量。
②制备SDS-PAGE 凝胶电泳,将蛋白Marker 和细胞样品加到胶孔内,电压设置在80~100 V。待溴酚蓝未接触胶的底端即结束电泳。
③转膜(PVDF 膜)后加入Western 封闭液,加入一抗4 ℃过夜,TBST 缓冲液洗膜30 min(3 次),室温加入二抗2 h,同前步骤洗膜3 次,清洗完毕后放入Chemiscope 6000 Pro化学发光成像系统,扫描拍照。
1.12 转录组分析
将各组细胞分别进行收集后,委托北京百迈客生物科技有限公司进行RNA-seq测序和基因注释。
1.13 数据处理和分析
采用SPSS 25.0 统计软件进行单因素方差分析(one-way ANOVA),组间差异显著性用Duncan’s 法多重比较进行统计分析(Duncan’s multiple range test),试验数据以“平均值±标准差(Mean±SD)”表示,P<0.05 表示显著差异,P<0.01表示极显著差异。
2 结果与分析
2.1 天然植物水溶物体外抗氧化效果(见表2)
以VC 为阳性对照,测定天然植物水溶物清除自由基的效果,结果都以IC50值来表示。IC50定义为:自由基数目减少50%时所需要的样品浓度,即为自由基清除率下降50%时样品的浓度,IC50值越小表明清除能力越强。由表2 所示,VC 是清除DPPH·和·OH能力最强的,RAT和JLT清除·OH能力二者之间无显著性差异,IC50值约为1.50 mg/mL,其清除能力是诃子的7.8 倍;诃子清除DPPH·IC50值为0.01 mg/mL、RAT IC50值为0.26 mg/mL,JLT IC50值为1.31 mg/mL。

表2 不同天然植物对自由基的清除率(IC50,n=3,mg/mL)
2.2 天然植物水溶物在细胞培养液中的适宜浓度(见图1)
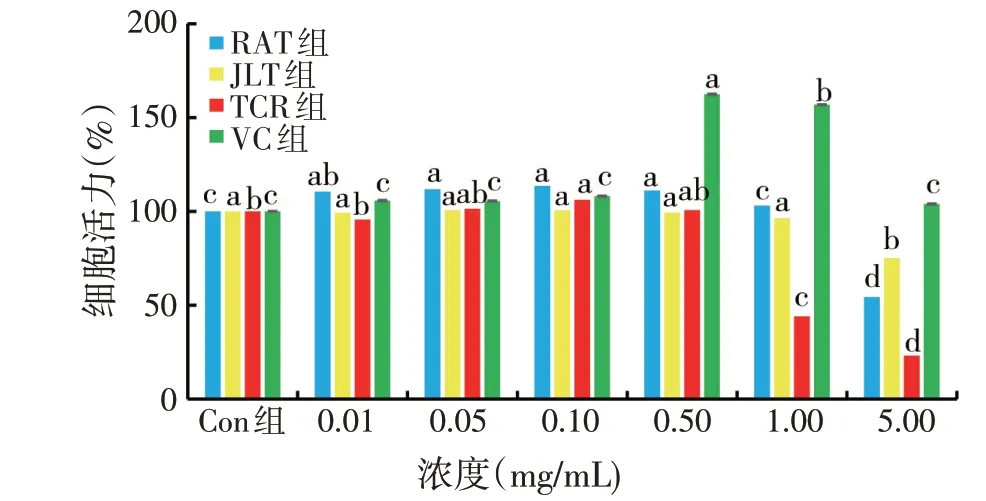
图1 同浓度天然植物水溶物和VC对细胞活力的影响(n=3)
由图1 结果所示,0.01~1.00 mg/mL 浓度的JLT 组水溶物培养肝细胞24 h 的细胞活力无显著性差异(P>0.05),JLT 浓度增加到5.00 mg/mL 时细胞活力显著降低(P<0.05);0.01~0.50 mg/mL 浓度的RAT 组培养肝细胞24 h 细胞活力随浓度的升高呈显著性上升趋势(P<0.05);同等浓度范围的TCR培养肝细胞24 h,细胞活力无显著性差异(P>0.05);RAT和TCR浓度达到1.00~5.00 mg/mL时肝细胞活力显著降低(P<0.05);VC 作为阳性对照在0.01~0.10 mg/mL 浓度范围内与Con 组(正常细胞)相比无显著性差异,0.50 mg/mL和1.00 mg/mL 两个浓度下细胞活力显著升高,但在5.00 mg/mL时又出现了下降。因此,可以选用浓度为0.01~0.50 mg/mL的3种天然植物水溶物和VC阳性对照进行后续试验。
2.3 天然植物水溶物对H2O2损伤肝细胞活力的影响(见图2)
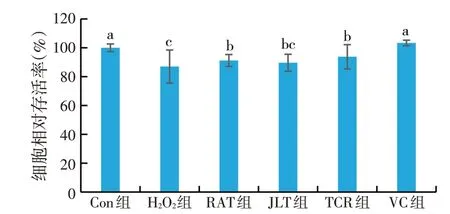
图2 天然植物水溶物和VC对损伤细胞活力的影响(n=3)
从筛选出来的安全范围浓度中,选择相同浓度(0.10 mg/mL)的4 种物质,分别加入到H2O2损伤的细胞中,作用24 h 后检测细胞活力,结果如图2 所示,H2O2组与对照组(Con组)相比有显著降低的趋势(P<0.05);除JLT 组外,RAT、TCR 和VC 组与H2O2组相比都能显著性提高细胞活力(P<0.05);VC组效果最好,达到与Con组无显著差异水平;RAT和TCR组间无显著性差异(P>0.05),且均高于H2O2组的结果。结果表明,JLT、RAT、TCR和VC均具有恢复H2O2损伤草鱼肝细胞生长活力的功能,且以RAT、TCR和VC活性更强。
2.4 天然植物水溶物对H2O2损伤肝细胞抗氧化酶活性的影响(见图3)
如图3所示,与Con组相比,H2O2组的MDA含量极显著上升(P<0.01),与H2O2组相比,加入不同天然植物水溶物和VC 后,MDA 含量呈显著下降趋势。H2O2组GSH含量与Con组相比极显著降低;与H2O2组相比,天然植物水溶物和VC组都极显著提高了GSH含量(P<0.01)。与Con 组相比,H2O2组CAT 活性极显著降低;与H2O2组相比,天然植物水溶物和VC 组CAT 活性有升高趋势,除JLT 组,其余3 组都具有极显著性差异(P<0.01)。与Con 组相比,H2O2组的SOD 活性显著提高,加入天然植物水溶物组和VC后SOD活性与H2O组相比极显著下降(P<0.01)。结果表明,添加天然植物水溶物能够降低H2O2损伤细胞MDA含量,提高CAT活性,增加GSH含量。

图3 天然植物水溶物和VC对损伤细胞酶活性的影响(n=3)
2.5 天然植物水溶物对H2O2损伤肝细胞内活性氧(ROS)含量的影响(见图4)
由图4 所示,H2O2组胞内ROS 水平极显著高于Con组(P<0.01);与H2O2组相比,加入天然植物水溶物和VC 培养细胞24 h后,细胞内的ROS 水平均极显著降低(P<0.01),其中VC 组降低最显著。RAT 和JLT两组之间无显著性差异(P>0.05)。结果表明,JLT、RAT、TCR 和VC 均具有降低H2O2损伤草鱼肝细胞内多余活性氧的功能。

图4 天然植物水溶物和VC对细胞内ROS水平的影响(n=3)
2.6 天然植物对H2O2损伤肝细胞凋亡率的影响(见图5)
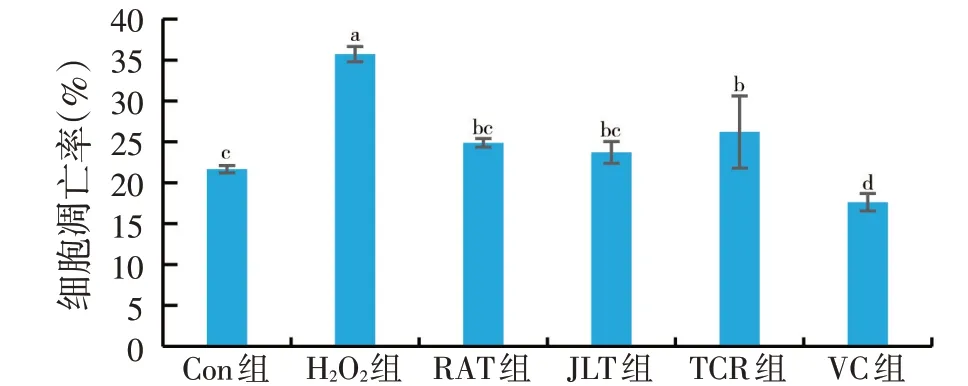
图5 天然植物水溶物和VC对肝细胞凋亡率的影响
如图5所示,H2O2组的细胞早期凋亡率为(35.72±0.93)%,与Con组相比增加14.07%(P<0.01)。RAT组和JLT组细胞凋亡率分别为(24.87±0.53)%和(23.71±1.32)%,两者与H2O2组相比凋亡率显著降低(P<0.05)。VC 组细胞凋亡率达到了最少,为(17.61±1.06)%,TCR组细胞凋亡率为(26.21±4.41)%,与H2O2组有显著性差异(P<0.05),但是活细胞明显减少。试验结果表明,JLT、RAT、TCR和VC均能降低H2O2损伤草鱼肝细胞的凋亡率,效果较强的是VC、RAT和JLT。
2.7 天然植物水溶物对H2O2损伤肝细胞线粒体膜电位的影响(见图6)
由图6所示,与Con组相比,H2O2组的线粒体膜电位极显著下降(P<0.01)。与H2O2组相比,加入天然植物水溶物和VC 后,仅JLT 组和TCR 组有显著性上升的趋势。尤其是TCR组的MMP最高,RAT组和VC组MMP 与H2O2组无显著性差异(P>0.05)。结果表明,RAT、JLT 和TCR 能够升高H2O2损伤草鱼肝细胞细胞膜电位,缓解线粒体途径诱导的细胞凋亡。
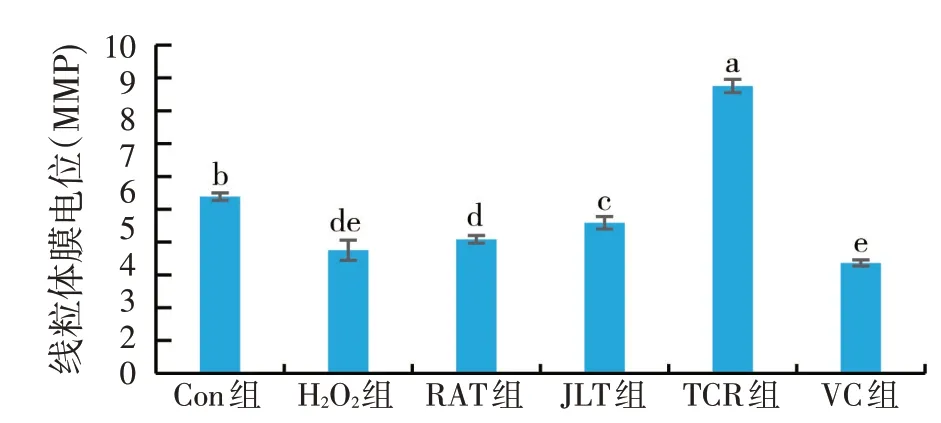
图6 天然植物水溶物和VC对MMP的影响(n=3)
2.8 天然植物对H2O2损伤肝细胞透射电镜的观察结果(见图7)

图7 肝细胞超微结构变化
由图7 所示,Con 组肝细胞细胞核呈现圆形或者椭圆形,染色质集中于细胞核中央,细胞质均匀分布,线粒体丰富,结构完整,嵴清晰(见图7A 和图7A1);H2O2组的细胞有严重空泡化现象,细胞质分布不均匀,大片面积缺失,细胞核染色质边集化特征显著,线粒体肿胀,嵴消失,细胞器减少,内含脂滴,有少量自噬小体和自噬溶酶体(见图7B 和图7B1);RAT 组(见图7C 和图7C1)、JLT 组(见图7D 和图7D1)、TCR 组(见图7E和图7E1)和VC组(见图7F和图7F1)与H2O2组相比,嵴消失情况有所缓解,但依旧有线粒体肿胀现象,线粒体数量略有升高,自噬小体和自噬溶酶体聚集趋于增多。上述结果表明,H2O2损伤肝细胞后能够造成肝细胞微观结构显著性的改变,天然植物水溶物和VC 能够缓和细胞受损情况,主要是通过线粒体形态、自噬溶酶体数量的变化起到作用。
2.9 凋亡蛋白的检测结果(见图8)
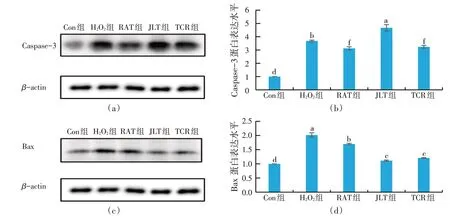
图8 天然植物水溶物对细胞凋亡蛋白相对表达量的影响
Western Blot 试验检测结果发现,与Con 组相比,H2O2组的凋亡蛋白Caspase-3 的表达极显著性升高(P<0.01);与H2O2组相比,RAT 组和TCR 组的Caspase-3的表达极显著性降低(P<0.01),凋亡蛋白活性被抑制,说明RAT 和TCR 能够通过抑制Caspase-3 的表达活性对草鱼原代肝细胞起到保护作用。H2O2组Bax 蛋白的表达较Con 组有极显著性升高趋势(P<0.01),RAT 组、JLT 组和TCR 组与H2O2组相比有显著或极显著降低的趋势(P<0.05或P<0.01),RAT、JLT和TCR能抑制Bax蛋白的表达活性,缓解细胞凋亡。
2.10 基因差异表达和通路分析
采用EdgeR 软件对Con 组、H2O2组、TCR 组、RAT组、JLT 组和VC 组细胞进行差异表达基因统计分析,默认参数:p-adjust<0.05、| |log2FC ≥1,结果见表3。H2O2组与Con 组相比,有1 073 个基因差异表达,其中有363 个基因差异表达上调、710个基因差异表达下调;H2O2组与TCR组相比,有3 637个基因差异表达,其中1 565 个基因差异表达上调,2 072个基因差异表达下调;H2O2组与JLT组相比,有482个基因差异表达,其中有156个基因差异表达上调,326个基因差异表达下调;H2O2组与RAT 相比,有200 个基因差异表达,其中有89 个基因差异表达上调,111 个基因差异表达下调;H2O2组与VC 相比,有359 个基因差异表达,其中有103个基因差异表达上调,有256个基因差异表达下调。

表3 差异表达基因
对部分GEGs 进行整理,结果见表4,H2O2组“内质网中的蛋白质加工通路”中Calpain-2catalytic subunit基因表达上调,造成细胞内Ca2+紊乱;“胰岛素信号通路”中Insulin receptor substrate2 基因表达下调,receptor-type tyrosine-protein phosphatase F-like基因差异表达倍数上调9.48倍,影响胰岛素的信号转导;“类固醇生物合成通路”中Delta(24)-sterol reductase基因表达下调,影响固醇合成途径,氧化还原酶失衡造成氧化损伤。TCR 组中Glutathione peroxidase4 基因表达上调,“铁下垂通路”中Phospholipid hydroperoxide glutathione peroxidase基因表达上调,transferrin receptor protein1-like基因表达下调,表明TCR可能通过抑制铁死亡保护细胞。JLT组“自噬通路”中high mobility group protein基因差异表达上调,death-associated protein kinases基因差异表达倍数下调7.43 倍,beclin-1protein基因差异表达倍数上调10.25倍,可通过促进细胞自噬保护细胞。RAT 组“自噬通路”中beclin-1protein基因差异表达倍数上调10.80倍,“内分泌和其他因素调节钙重吸收通路”中calbindin-like基因表达上调,参与钙离子的结合、调节钙平衡。VC 组“甲状腺激素合成通路”中Thyroxine基因表达上调,促进甲状腺激素合成缓解细胞凋亡。

表4 差异表达基因
3 讨论
3.1 天然植物的抗氧化作用
本试验结果表明,三种天然植物水溶物都具有较好的清除DPPH·和·OH 的能力,VC 是清除DPPH·和·OH 能力最强的,RAT和JLT清除·OH能力较强且两者无显著性差异,清除率是TCR 的7.8 倍;清除DPPH·能力由强到弱分别是TCR、RAT 和JLT,说明3种物质都具有较强的抗氧化效果。
具有药食同源的天然植物具有很高的营养价值和药用功效,尤其是含有多酚类物质而具有较强的抗氧化能力和清除自由基的能力,这是希望通过饲料途径筛选单一或复合的天然植物进入饲料配方的基本依据。需要关注的问题:一是不同天然植物产品含有的抗氧化、清除自由基的有效成分种类有差异,因而会在相同条件下显示出不同的抗氧化、清除自由基的效率;二是不同于体外试验,对于活体动物或活体细胞,不同的天然植物产品、不同的有效成分在抗氧化、清除自由基效率等方面存在一个适宜剂量效应的问题,过多的添加量可能导致活体动物或活体细胞出现损伤的情况。例如,有研究表明,当植物多糖超过一定范围后,会对细胞的生长造成负面影响[12]。首先确定天然植物水溶物试验浓度用于后续修复损伤细胞是必要的工作。与H2O2组相比,4种物质都有提高细胞活力的趋势,且RAT、TCR和VC组具有显著性差异。除VC组外,细胞相对活力提升效果由高到低分别是:TCR>RAT>JLT,这也显示了对H2O2损伤肝细胞修复能力的大小顺序。
MDA是生物膜中不饱和脂肪酸被氧化后的代谢产物,对细胞有毒性,能反映细胞损伤和动物脂质过氧化程度[13]。SOD、CAT作为体内重要的抗氧化酶,其活性能够检测水生动物的抗氧化能力[14]。GSH 是动物体内一种天然的抗氧化剂,具有多个特殊功能的化学基团,能清除体内O2-·,保护细胞膜的完整性,具有抗脂质氧化作用,能提高动物抗氧化应激能力[15]。本试验观察到H2O2组CAT的抗氧化酶活性显著性降低,MDA水平显著上升,说明细胞膜受损且脂质发生过氧化,抗氧化酶系统受损。在损伤细胞培养液中加入RAT、JLT、TCR的水溶物以及VC后,培养细胞24 h后,检测到胞内的CAT活性及GSH水平上升,MDA含量显著下降。说明天然植物水溶物可以增加损伤细胞的抗氧化酶活性,减少MDA积累,逆转草鱼肝胰脏细胞氧化应激标志物(O2-·、MDA)的变化。但是SOD活性却在H2O2损伤后呈现上升的趋势,这可能因为SOD是机体内清除O2-·唯一的清除剂。由于受到适当的氧化应激后出于自身的保护作用呈现升高趋势,Futakawa等[16]研究与本研究结果一致。
线粒体在调节细胞能量代谢中起关键作用,线粒体动力学被认为对维持细胞稳态的重要生理作用。线粒体动力学降低,说明线粒体功能已损害,细胞可能已经处于衰老或者死亡状态。氧化应激时自由基的增强进一步恶化线粒体损伤,并打开线粒体通透性转变孔(mtPTPs),这个过程诱导细胞凋亡[17]。本试验检测结果显示:与Con 组相比,H2O2组胞内ROS 水平显著升高,MMP显著降低,RAT、JLT和TCR组的MMP与H2O2组相比有上升趋势,降低胞内ROS水平,保护线粒体膜的完整性。H2O2组的细胞凋亡百分比达到(35.72±0.93)%,与Con组相比有显著升高趋势,而加入天然植物水溶物和VC后降低了细胞凋亡率。自噬属于细胞调控应激和防御应激的适应性反应,能降解受损细胞器,参与损伤修复,维持细胞稳态[18-19]。有相关研究表明药根碱能够清除细胞ROS,可能与其对线粒体自噬有促进作用有关[20]。本试验透射电镜结果显示,细胞受损伤后线粒体肿胀,嵴消失,加入RAT、JLT、TCR和VC后能够缓解线粒体嵴消失情况,并且自噬小体和溶酶体数量增加,说明天然植物水溶物能促进H2O2损伤细胞自噬,并缓解线粒体结构的损伤促进细胞清除受损结构,抑制细胞氧化损伤。
细胞凋亡的两条主要途径都与Caspase-3有关[21]。半胱天冬酶在凋亡的启动中发挥重要作用,Caspase-3 蛋白位于细胞质中,是细胞凋亡的主要执行者[22]。有报道称H2O2能够增加促凋亡蛋白Bax、Caspase-3和Caspase-9的表达,介导线粒体途径凋亡[23]。本试验中显示H2O2组的Caspase-3蛋白和Bax蛋白表达显著升高,说明H2O2能够通过线粒体途径引起细胞凋亡,3种天然植物水溶物处理细胞后Caspase-3 蛋白(除JLT组外)和Bax蛋白表达呈现降低趋势,推测3种物质可能通过抑制促凋亡蛋白的表达,从而抑制H2O2诱导线粒体途径的肝细胞凋亡。
3.2 天然植物对损伤肝细胞的保护机制
H2O2组与Con组的基因差异表达主要涉及“内质网中的蛋白质加工”“胰岛素信号通路”“MAPK 信号通路”“类固醇生物合成”等通路。
“铁死亡”是一种铁离子依赖性的程序性细胞死亡方式,能引起线粒体改变的氧化损伤[24]。与H2O2组相比,TCR组的基因差异表达主要涉及的与细胞凋亡相关通路有“铁下垂”,TCR可能通过上调GPX4,降低铁死亡的发生来缓解细胞凋亡;细胞自噬能调节物质合成、平衡代谢、清除受损细胞器、促进发育和分化,是细胞在恶性环境下确保生存的应激反应[25]。JLT组主要涉及“自噬”相关通路,影响其上游的HMGB1、DAPK基因引起Beclin-1上调来降解和回收利用细胞内受损蛋白质和细胞器,缓解受损细胞发生严重凋亡;钙结合蛋白在体内参与钙离子的结合、调节钙平衡、防止细胞损伤中起到了积极作用[26]。RAT组主要涉及“内分泌和其他因素调节钙重吸收”以及“自噬”相关通路,通过上调CALB1、CaBp28k、ATG6 和ATG9 的表达,调节细胞自噬以及细胞内Ca2+平衡,恢复内质网稳态,修复细胞损伤凋亡;甲状腺合成的甲状腺素在维持动物体的正常发育和促进新陈代谢中起重要作用[27],VC组主要涉及“甲状腺激素合成”相关通路,通过TG表达上调促进甲状腺素合成以缓解细胞凋亡,有研究表明甲状腺素可以改善重型颅脑损伤后的神经细胞凋亡[28]。
4 结论
H2O2可能通过线粒体途径导致草鱼肝细胞氧化性损伤。天然植物复合物1、天然植物复合物2、诃子水溶物对草鱼原代肝细胞的氧化应激损伤具有缓解、修复作用,表现在具有清除体内自由基和过氧化物的功能作用,具有提高细胞相对活力、提高细胞抗氧化能力的作用,具有促进H2O2损伤细胞自噬、并缓解细胞核和线粒体结构的损伤,通过调节内质网稳态、下调Caspase-3和Bax蛋白的表达等途径,从而减轻Caspase-3介导的线粒体途径的凋亡和氧化损伤的作用,对肝胰脏的损伤修复和氧化损伤的保护具有一定的作用效果。

