35例妊娠期乳腺癌临床病理特征及预后分析
钟镇铧,范凤凤,姜文强,李占文
0 引言
妊娠期乳腺癌(pregnancy-associated breast cancer,PABC)被定义为在怀孕期间或分娩后一年内确诊的乳腺癌[1]。随着越来越多的女性选择推迟生育以及乳腺癌发病率的上升,妊娠期乳腺癌的发病率也有所增加[2]。妊娠是否会对乳腺癌患者的预后造成不良影响仍然存在争议,因为PABC患者年龄偏轻且诊断时疾病分期偏晚,这些特征会成为混杂因素。此外,由于PABC的治疗可能会因担心治疗对胎儿有影响而受到限制或延迟[3]。荟萃分析显示即使在调整了混杂因素后PABC患者的生存结果仍然较差[4-5]。一些研究认为妊娠是导致PABC预后较差的独立危险因素[6-7],但一些研究发现PABC的预后与同龄非妊娠期乳腺癌相比没有显著性差异[8-9]。
PABC的预后还与肿瘤生物学行为有关。PABC患者的激素受体(HR)阴性、三阴性乳腺癌(triple-negative breast cancer,TNBC)比例较高[9-10]。本研究通过与年龄、肿瘤分期和IHC分子分型匹配的非PABC对照组相比,评估妊娠是否会影响PABC的生存及影响生存的危险因素。
1 资料与方法
1.1 一般资料
收集2008年1月至2020年1月在我院治疗的35例PABC患者资料,对照组(non-PABC)按TNM分期、分子分型、发病年龄和诊断时年份进行匹配,以排除选择偏倚。根据诊断年龄(±2岁)、诊断年份(±1年)、临床分期和分子分型,每位PABC患者与non-PABC患者以1:2比例匹配。如果同时有几个患者符合特定病例的对照组标准,则按相同病理分期和(或)相同全身治疗方案选择对照组病例。肿瘤分期基于AJCC第7版分期系统。分子亚型根据2013年圣加仑共识会议推荐分为Luminal-A、Luminal-B/HER-2-、Luminal-B/HER-2+和TNBC[11]。
资料信息包括:确诊时的年龄、诊断日期、家族史、病理特征、肿瘤大小,淋巴结状态、肿瘤分级,雌激素受体(ER)、孕激素受体(PR)的状态、人表皮生长因子受体2(HER2)的状态、Ki-67指数、治疗方式(包括手术类型、化疗和放疗)、复发日期和复发部位。
1.2 病理
组织病理学评估由两名病理学专家进行,标本用福尔马林固定、石蜡包埋。根据第7版AJCC指南,有1%肿瘤细胞表达雌激素和(或)孕激素受体认为是HR受体阳性。HER2表达基于免疫组织化学膜染色的完整性,0~+为阴性,++为可疑阳性,+++为阳性。可疑阳性通过荧光原位杂交检测(FISH)进一步评估。Ki-67的cut-off值设为20%,分值>20%被认为是高表达。组织学分级基于改良的Scarff-Bloom-Richardson分级系统。
1.3 治疗方案
治疗方案的制定遵循国际指南并基于临床分期和免疫组织化学(IHC)分子分型进行。外科手术方式包括乳腺癌改良根治术、单纯乳房切除术、保乳手术。大多数接受化疗的患者采用基于蒽环类和(或)紫杉类方案。所有HR阳性患者均接受内分泌治疗,所有HER2阳性患者均接受曲妥珠单抗为基础的靶向治疗。怀孕患者在孕中晚期开始化疗;分娩后给予辅助放疗、内分泌治疗和(或)曲妥珠单抗为基础的靶向治疗。
1.4 统计学方法
用SPSS23.0、Graph Pad Prism 8.0统计软件进行数据分析,连续变量使用中位数和四分类数表达(IQR25,75),组间计数资料比较使用χ2检验或Fisher精确检验进行,P<0.05为差异有统计学意义,连续变量使用独立t检验进行比较。DFS被定义为从局部区域治疗到疾病复发的时间(局部区域或全身性)或任何原因导致的死亡。OS计算为从诊断到任何原因死亡的时间。Cox比例风险模型进行单因素和多因素分析,并计算95%CI和风险比(HR)。Kaplan-Meier法估计患者生存率和绘制生存曲线,Log rank检验比较两组患者的生存率差异。
2 结果
2.1 临床病理特征及治疗情况
共有35例PABC患者(妊娠期10例;产后1年内25例)纳入本研究,并与70例non-PABC患者匹配,见表1。主要组织学类型为浸润性导管癌,与non-PABC组相比,PABC组中特殊型乳腺癌(即微乳头状癌、黏液癌或化生性癌)的比例较高(25.7%vs.10%)。与对照组相比,PABC组中三阴性乳腺癌比例较高(45.7%),PABC组中患者更容易出现淋巴结转移,PABC组TNM分期更晚,有更多的患者需要进行新辅助化疗。
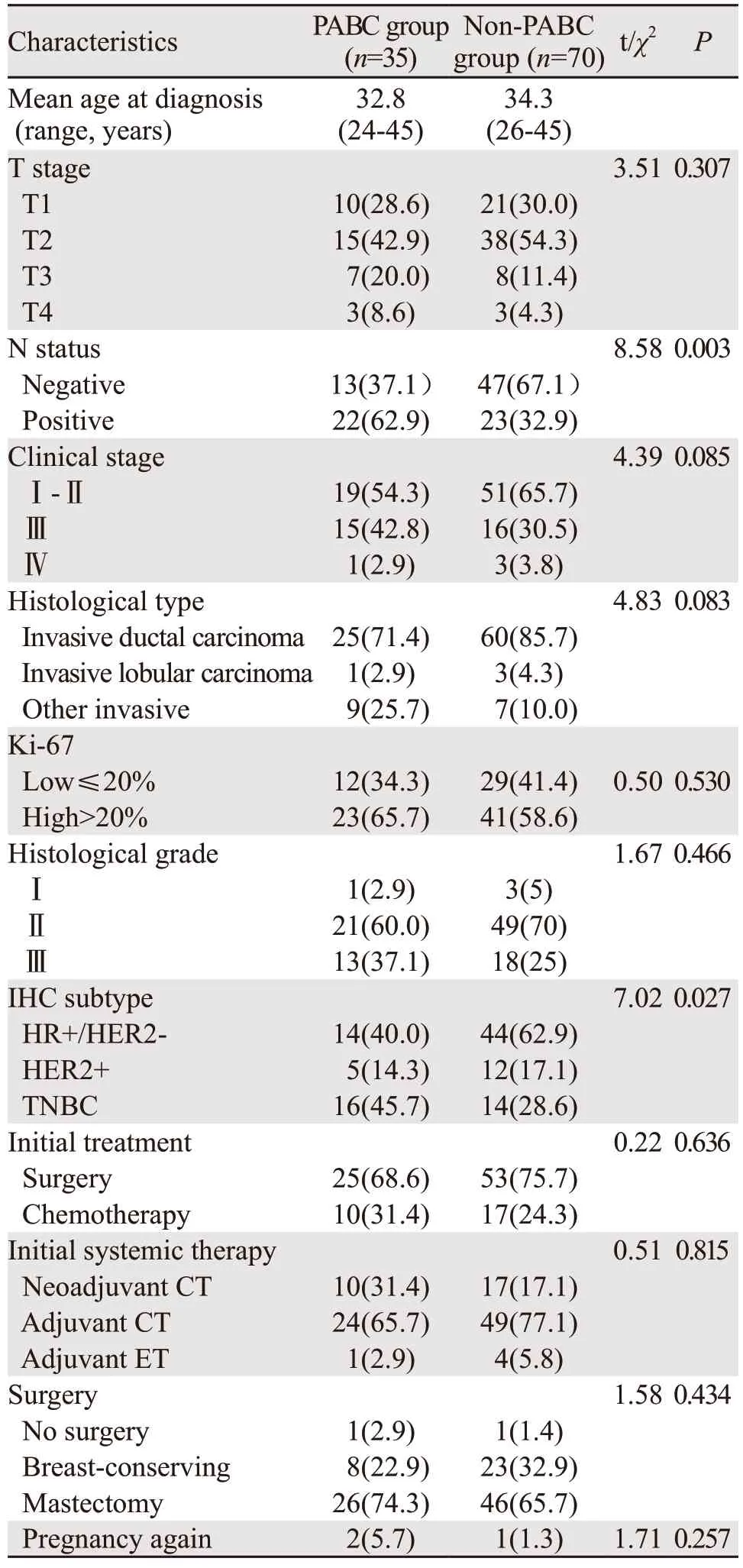
表1 PABC组和non-PABC组患者基本特征 (%(n))Table l Baseline characteristics of PABC patients and non-PABC controls (%(n))
2.2 新辅助化疗病理完全缓解(pCR)情况
排除未接受治疗的患者,PABC组中10例和对照组中17例接受了新辅助化疗,本研究PABC组中妊娠期间的患者行AC-T方案周疗(该3例患者HER-2表达均为阴性),其他患者均行AC-T/TCb方案3周化疗,HER-2阳性患者联合靶向治疗。PABC组总pCR率30.0%(3/10),非PABC患者总pCR率41.2%(7/17),两组比较差异无统计学意义(P=0.692),见图1。但因病例数较少,没有进一步按分子分型进行分层评估各亚型的pCR率。
2.3 患者生存情况分析
PABC 组中位随访时间为68.5 月(IQR 46.1~83.5月),non-PABC组为70.7月(IQR 53~85.8)。PABC组局部复发3例,转移15例,死亡9例;non-PABC组局部复发5例,转移14例,死亡11例。针对Ⅰ~Ⅲ期乳腺癌,PABC组与non-PABC组相比复发率显著增加,PABC组患者的5年DFS为51.6%,non-PABC组为72.8%,差异有统计学意义(P=0.029),见图2A;两组之间OS比较差异无统计学意义(87.6%vs.76.3%,P=0.183),见图2B。
2.4 预后单因素及多因素分析
Cox比例风险模型进行单因素及多因素分析预测患者预后,见表2,PABC和non-PABC相比,单因素分析显示DFS与IHC分子分型、Ki-67比值、临床分期和妊娠显著相关;在多因素分析显示,DFS与临床分期、妊娠、IHC分子分型显著相关(P<0.05)。在单因素分析中,与OS相关的因素是临床分期和分子分型,多因素分析再度证实了这种相关性(临床分期:P<0.001;分子分型:P=0.011),多因素分析显示妊娠与OS无显著相关性(P=0.379)。
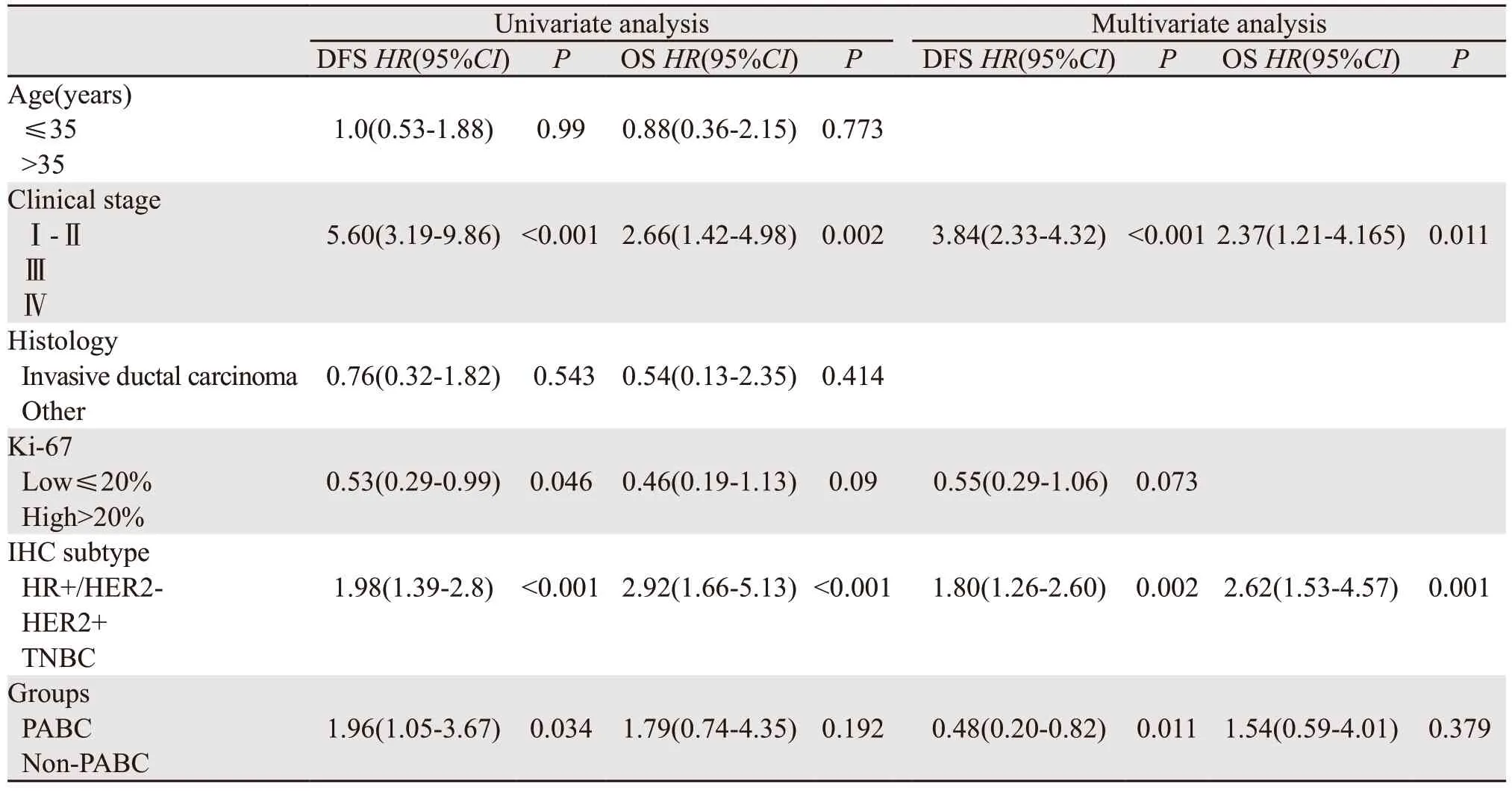
表2 单因素分析及多因素Cox回归分析预测PABC组和non-PABC组的预后Table 2 Univariate and multivariate Cox regression analyses for OS and DFS of PABC patients and non-PABC controls
3 讨论
PABC虽然相对少见,但近年来其发病率有所增加,考虑到系统治疗对胎儿的影响,对临床医生也提出了特别的挑战。国外有研究报道PABC发病率约占所有乳腺癌的0.2%~2.5%[12-13],<40岁乳腺癌患者中有6%~15%和妊娠相关[14-15]。近年来我国报道PABC发病率约占所有乳腺癌的7%,发病率较国外更高,这可能与我国开放二胎政策、生育年龄延迟及与我国乳腺癌发病高峰更年轻等因素有关[16-17]。最近10年我们单中心统计发现2.3%的乳腺癌与妊娠有关。本研究中,没有发现患者有乳腺癌家族史,PABC组患者平均年龄32.8岁,大多数PABC(71.4%)患者在产后1年确诊。本研究所有PABC患者都是通过体格检查和(或)影像学检查发现,大部分患者可触及肿块,我们的发现与文献报道一致[18-19],有必要对患者和医生进行PABC相关知识的普及,以期及时发现和诊断。
外科手术仍是PABC非常重要的治疗方式,手术治疗处于综合治疗的基石地位,本研究中除1例初诊Ⅳ期乳腺癌,其余34例均进行了手术治疗,目前认为在妊娠的任何阶段及哺乳期均可安全进行手术治疗[20];手术不增加孕妇死亡风险及胎儿先天性畸形风险,延迟手术可能增加乳腺癌转移潜在风险[21]。许多研究表明,保乳手术和乳房切除术的长期生存率相当[22-23]。患者的意愿和肿瘤特征,尤其是肿瘤大小和是否多中心性等指标才是决定能否保乳的关键因素。一般在怀孕的前三个月首选乳房切除术,以避免延迟放疗对预后造成不良影响,但有人认为在孕早期也可进行保乳手术而且不会影响预后[23]。
本研究对处于妊娠期间的患者没有进行前哨淋巴结活检(sentinel lymph node biopsy,SLNB),目前PABC能否进行SLNB尚有争议,因为前哨淋巴结活检需要在乳房内注射放射性同位素标记的胶体或蓝色染料为前哨淋巴结示踪,这些示踪剂在怀孕期间使用有一些限制。异硫蓝和亚甲蓝被美国FDA定义为C类药物,认为可能引起过敏性休克或者胎儿畸形;但Gropper对7例PABC患者使用亚甲蓝进行SLNB,生育的孩子没有发现畸形[24],目前认为Tc-99m硫胶体是相对安全的[21]。Pandit-Taskar等[25]使用Tc-99m硫胶体对PABC患者进行前哨淋巴结示踪,注射18.5 MBq后发现胎儿暴露的最大放射性剂量为0.014 mGy,母亲暴露的总剂量估计为0.245 mGy,远低于美国国家辐射防护委员会为孕妇设定的50 mGy的安全暴露阈值。因此怀孕期间使用注射放射性同位素标记的胶体进行前哨淋巴结示踪对胎儿似乎是安全的。
本研究PABC组在妊娠期间进行新辅助化疗的患者仅3例,更多的患者因担忧化疗对胎儿的影响不愿意在妊娠期间进行化疗,未化疗的患者选择了终止妊娠后再进行化疗,化疗过程中未发现母亲明显并发症和胎儿发育不良。目前数据表明,怀孕初期三个月内不宜进行化疗,因为此时刚好是胎儿在器官发育的关键时期,化疗导致胎儿畸形的风险最大;而在孕中期和孕晚期化疗后胎儿畸形的风险约为1.3%,与未暴露于化疗人群相比差异无统计学意义[12,26]。目前蒽环类或紫杉类均得到了广泛应用,其中紫杉类得到了ESMO指南的推荐[27],紫杉醇每周给药方案毒性更低,且疗效优于紫杉醇每2周一次的剂量密集方案,中国专家共识不建议对PABC进行剂量密集方案化疗[28]。一项小型研究[29]对比了每2周一次剂量密集化疗的10例女性和每3周一次常规化疗的99例女性的妊娠结局,研究发现两组胎儿的出生体重、分娩时的胎龄、先天性异常和中性粒细胞减少症的发生率没有明显不同。
单因素及多因素分析均发现肿瘤分期和IHC分子分型才是影响患者预后的独立危险因素,本研究结果与评估PABC预后的荟萃分析的结论一致[1,4-5]。在Ploquin等[9]的一项多中心研究中,111例PABC患者按照年龄、临床分期、IHC分子分型、是否新辅助化疗的使用情况与Non-PABC患者进行匹配,该研究发现和non-PABC患者相比,PABC患者总体5年DFS更差,但不同分子亚型预后有差异,HR阳性和三阴性患者复发率增加(61%vs.70.5%;54.3%vs.65.1%);但HER2阳性/HR阴性病例没有发现有差异,病例数较少可能影响结果的判定,本研究中PABC组仅8例患者HER2呈阳性。与非PABC相比,关于PABC的研究结果不一致的原因尚不清楚。我们未来的研究需要确定PABC复发风险增加是由于肿瘤生物学行为还是妊娠期间或产后乳房微环境的改变所致,还是由于因PABC状态导致治疗方案变化所致。
O’Sullivan等[30]的一项回顾性研究中,PABC患者被分为在妊娠期间确诊组和分娩后一年内确诊组,随后按年龄(±5岁)、疾病分期和诊断时间进行匹配,发现对妊娠期乳腺癌的总生存没有影响。Ploquin等[9]研究提示PABC的5年OS为83.1%,对照组non-PABC的OS为85.5%,两组间比较差异无统计学意义;Zhang等[31]也有相似发现,两组之间中位OS差异无统计学意义(82.8月vs.80.1月)。PABC诊断后延迟治疗可能影响患者预后,本研究PABC组中仅有3例在妊娠期间开始化疗,PABC组中5例选择流产终止妊娠,处于孕晚期的2例选择提前分娩终止妊娠,所有患者均在确诊乳腺癌后的3周内开始治疗,没有明显延迟治疗的情况,因此没有分析延迟治疗对预后的影响。
PABC患者肿瘤分期相对更晚,复发率也更高,PABC的治疗需要多学科专家进行病例讨论,在治疗前应向患者充分告知妊娠期间接受抗肿瘤治疗可能存在的风险及获益,并尊重患者的意愿。治疗应以常规乳腺癌治疗方案为基础,结合患者的妊娠情况、肿瘤分期、手术指征、放化疗指征等进行综合评估后并制定详尽的治疗方案,确诊后应尽早开始系统化、规范化治疗。另外还需要进一步研究以便早诊早治,提高PABC的治疗效果,减少复发和进展。

